新型双卤代吡啶酰腙的合成及生物活性研究
2020-05-13雷渭辉刘向荣杨再文赵顺省
雷渭辉, 刘向荣, 杨再文, 赵顺省
(西安科技大学 化学与化工学院,陕西 西安 710054)
酰腙类化合物是一类特殊的Schiff碱类化合物,是由酰肼中伯胺氮原子与醛或酮的羰基发生亲核加成反应缩合而成,其分子结构中含有生物活性基团(CO—NH—N=CH),具有抗肿瘤、抗菌、消炎镇痛、杀虫、抑菌等多种生物活性,因此其在农药与医药方面具有广泛的应用前景[1-3]。其中,含吡啶类酰腙相比于只含苯环类酰腙往往具有更高的生物活性[4-5]。如曾凡付等[6-9]合成了含有芳香基团的酰腙类化合物,对菜粉蝶幼虫具有较强的触杀活性和胃毒活性,且其结构中含有吡啶环的酰腙体现出更强的杀虫活性。另外,据文献报道[10],通过将卤素引入到酰腙化合物中能有效提高化合物的生物活性,这是由于卤素具有增加分子亲脂性,从而提高对脂质膜渗透性,另外卤素的电负性可以增加中心分子生物活性等特点[11]。因此,含卤素酰腙化合物通常具有良好的生物活性[12-14],并被广泛用作杀虫、杀菌剂。例如,梁芳珍[15]等合成了含溴元素的酰腙化合物5-溴水杨醛硫代双酰腙,当其浓度为1%和0.1%时其对大肠杆菌、枯草杆菌及金黄色葡萄球菌具有一定抑菌性。5-氯水杨醛水杨酰腙相比于不含氯元素的水杨醛水杨酰腙对辣椒疫霉菌、烟草赤星菌和棉花枯萎菌均有较好的抑制作用。研究[16-17]合成了水杨醛-4-氯苯甲酰腙钒配合物以及2-硝基-5-呋喃苯甲醛-4-氯缩氨基脲酰腙,由于两个化合物中均含有氯元素,两个化合物均对锥虫和利什曼原虫有着较好的杀虫活性。
综上所述,若同时将吡啶环、卤素以及生物活性基团(CONHN=CH)结合起来,实现3类活性基团的叠加,有望得到具有特殊生物活性的新化合物。
本文以2-氯吡啶-4-甲酸甲酯(1)和水合肼为原料合成了2-氯吡啶-4-甲酰肼(2), 2与卤代(F, Cl, Br)对苯甲醛反应得到3种新型双卤代吡啶酰腙[C13H9N3OFCl(3a), C13H9N3OCl2(3b)和C13H9N3OClBr(3c)],其结构经1H NMR,13C NMR, IR和元素分析表征。利用紫外光谱研究了3a~3c与ct-DNA的作用模式;采用荧光光谱研究了3a~3c与BSA的作用方式;通过琼脂扩散法研究了3a~3c对大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌及铜绿假单胞菌的抑制活性。
1 实验部分
1.1 仪器与试剂
WRS-2型熔点仪;TU-1900型紫外分光光度计;LS-55型荧光光谱仪;Bruker Avance-400 MHz型核磁共振仪(DMSO-d6为溶剂,TMS为内标);Bruker TensorⅡ型傅里叶红外光谱仪(KBr压片);PE-2400-Ⅱ型元素分析仪。
ct-DNA, Sigma公司,生物纯;BSA,北京百灵威科技有限公司,生物纯;2-氯吡啶-4-甲酸甲酯,上海百舜生物科技有限公司;水合肼(80%),天津富宇精细化工有限公司;其余所用试剂均为分析纯。
1.2 合成
(1) 2的合成
在圆底烧瓶中加入1 5.16 g(30 mmol)和无水乙醇(30.00 mL),加热搅拌使其溶解;加入80%水合肼(3.64 mL),回流(80 ℃)反应3 h。冷却至室温,析出大量无色透明晶体,过滤,滤饼烘干,用无水乙醇重结晶得白色固体2,收率78%, m.p.172.01~173.31 ℃;1H NMRδ: 10.19(s, 1H, NH), 8.56~7.74(m, 3H, PyH), 4.67(s, 2H, NH2);13C NMRδ: 162.81, 151.34, 151.17, 144.29, 122.14, 121.05; Anal. calcd for C6H6N3OCl: C 42.00, H 3.52, N 24.49, found C 42.06, H 3.09, N 24.00。
(2) 3a~3c的合成(以3a为例)
在圆底烧瓶中加入2 0.17 g(1 mmol)和甲醇(10 mL),搅拌使其溶解;缓慢加入4-氟苯甲醛107 μL(1 mmol),加毕,回流(65 ℃)反应4 h。冷却至室温,析出大量白色固体,滤饼过滤,烘干得白色固体3a,收率82%, m.p.208.3~209.4 ℃;1H NMRδ: 12.15(s, 1H, NH), 8.62~7.75(m, 3H, PyH), 8.45(s, 1H, N=CH), 7.83~7.33(m, 4H, ArH);13C NMRδ: 165.08, 162.61, 160.68, 151.32, 148.78, 144.49, 130.95, 130.02, 122.68, 121.72, 116.38; IRν: 3470, 1669, 1598, 1534, 1237, 1138 cm-1; Anal. calcd for C13H9N3OFCl: C 56.23, H 3.27, N 15.13, found C 56.35, H 2.61, N 14.85。
用类似的方法合成3b和3c。
Scheme 1
3b: 白色固体,收率81%, m.p.218.5~220.1 ℃;1H NMRδ: 12.20(s, 1H, NH), 8.64~7.78(m, 3H, PyH), 8.44(s, 1H, N=CH), 7.85~7.56(m, 4H, ArH);13C NMRδ: 160.75, 151.33, 148.59, 144.41, 135.47, 133.28, 129.46, 128.97, 122.70, 121.73; IRν: 3443, 1687, 1589, 1540, 1291, 1165 cm-1; Anal. calcd for C13H9N3OCl2: C 53.09, H 3.08, N 14.29, found C 53.20, H 2.53, N 14.00。
3c: 白色固体,产率84%, m.p.228.3~228.8 ℃;1H NMRδ: 12.20(s, 1H, NH), 8.63~7.68(m, 3H, PyH), 8.42(s, 1H, N=CH), 7.83~7.71(m, 4H, ArH);13C NMRδ: 160.76, 151.33, 148.68, 144.42, 133.62, 132.42, 129.67, 124.31, 122.70, 121.73; IRν: 3452, 1673, 1594, 1542, 1273, 1174 cm-1; Anal. calcd for C13H9N3OClBr: C 46.12, H 2.68, N 12.41, found C 46.16, H 2.09, N 12.12。
1.3 3a~3c与ct-DNA的相互作用
在参比比色皿中加入3 mL现配制的0.01 mol·L-1的Tris-HCl缓冲溶液(pH=7.9),同时向样品比色皿中加入等体积现配制的1×10-4mol·L-1化合物溶液,首先扫描基线,之后用微量进样器分别向参比比色皿和样品比色皿中加入50 μL 100 mg·mL-1的ct-DNA溶液,连续加入6次,每次间隔5 min,使其充分混合,扫描波长范围为250~500 nm。
在温度恒定为(25±0.1) ℃的水浴锅中测定化合物与ct-DNA混合溶液的粘度。首先将25 mL的0.01 mol·L-1的Tris-HCl缓冲液加入粘度计中,记录缓冲溶液流经毛细管的时间,清洗粘度计后,加入用缓冲溶液配制的浓度为1×10-4mol·L-1ct-DNA溶液25 mL,再次记录ct-DNA流经毛细管的时间。最后加入等体积(50 μL/次)的浓度为1×10-4mol·L-1的化合物溶液,连续7次,记录每次混合液流经毛细管的时间。每组做3次平行实验,求平均值,由溶液的相对粘度公式作图[18]。
1.4 3a~3c与BSA的相互作用
配制0.01 mol·L-1的Tris-HCl缓冲溶液(pH=7.2),再用现制的Tris-HCl缓冲液配制1×10-5mol·L-1的化合物溶液和1×10-7mol·L-1的BSA溶液。取3 mL BSA溶液,加入到比色皿中,开始扫描,然后逐次向比色皿中加入等体积(30 μL/次)的化合物溶液,待样品与BSA相互作用3 min后开始测试,连续滴加6次。激发波长为280 nm,狭缝宽度为10 nm。
1.5 3a~3c的抑菌性能测试
利用琼脂扩散法[19]研究了3种酰腙化合物对大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌和铜绿假单胞菌的抑菌活性。采用LB培养基,以DMSO作为空白对照组。用DMSO配制得到2 mg·mL-1的化合物3a~3c溶液,为确定3a~3c的最小抑菌浓度,采用二倍稀释法将溶液稀释至1 mg·mL-1、0.5 mg·mL-1和0.25 mg·mL-1。采用数显游标卡尺测量透明抑菌圈的平均直径。抑菌圈的平均直径>8 mm,可判定有抑菌作用。
2 结果与讨论
2.1 表征(以3a为例)
3a的1H NMR谱图表明,δ12.15处的特征峰为3a的酰胺NH吸收峰,δ8.62~7.75处特征峰为吡啶环的吸收峰,δ8.45处特征峰为腙N=CH吸收峰,且NH和N=CH质子峰均为单峰,苯环特征峰位于δ7.83~7.33间。可看出3a以酮式结构存在。
3a的13C NMR谱图表明,δ148.78处的碳原子为3a腙N=CH碳原子,酰胺C=O处碳原子位移由2中的δ162.81变为3a中的δ162.61。

表1 3a~3c与ct-DNA的结合参数Table 1 Binding parameters of 3a~3c with ct-DNA
3a的IR分析显示,3470 cm-1处吸收峰属于酰胺N—H伸缩振动峰,1669 cm-1处吸收峰属于酰胺C=O伸缩振动峰,1598 cm-1处吸收峰属于腙C=N伸缩振动峰,1534 cm-1处的吸收峰属于吡啶环C=N的吸收峰,1237 cm-1处的吸收峰属于酰胺C—N伸缩振动峰,1138 cm-1处的吸收峰属于吡啶环C—N伸缩振动峰。
2.2 生物活性
(1) 3a~3c与ct-DNA的相互作用
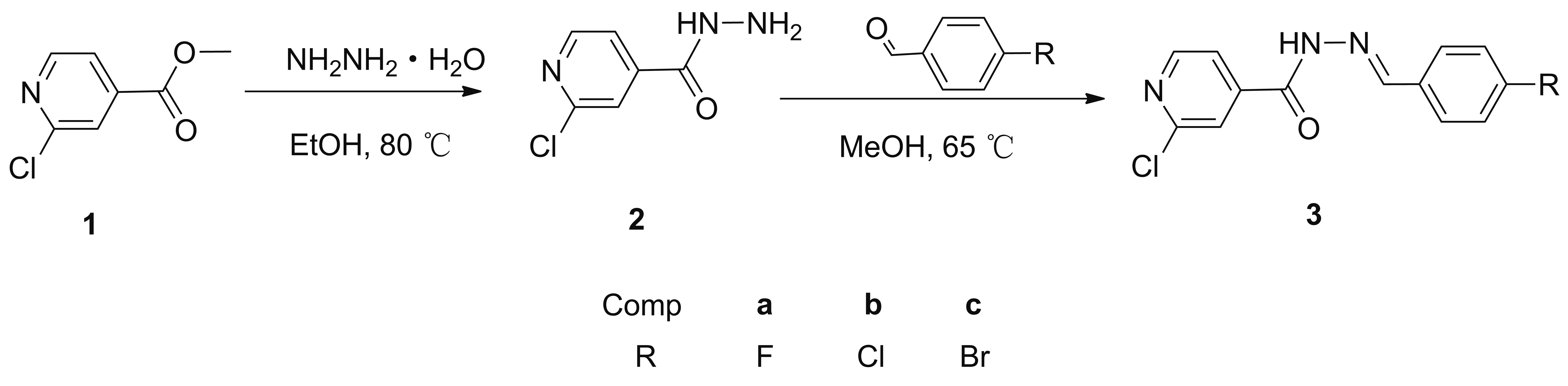
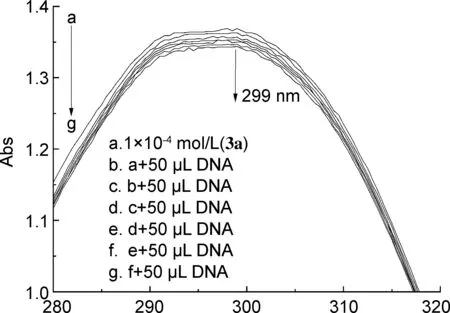
以3a为例,3a与ct-DNA相互作用的紫外光谱图如图1所示,3a~3c的cDNA/(εa-εf)与cDNA关系见图2。紫外光谱可以用来研究酰腙化合物与ct-DNA相互作用的方式[20],若发生减色效应说明化合物是以插入的方式与ct-DNA相互作用。这是由于化合物本身存在的空π*轨道与ct-DNA发生耦合而填充部分电子,导致π-π*跃迁概率下降,从而出现减色效应;此外,由于化合物插入ct-DNA后,长链ct-DNA分子的“屏蔽”作用使得π平面的通光量减少,也会出现减色效应[21]。
由化合物与ct-DNA的结合常数Kb计算公式[22],得到拟合直线,Kb即为直线斜率和截距之比,拟合结果列于表1中。
λ/nm图1 化合物3a与ct-DNA作用的紫外光谱图Figure 1 UV spectra of interaction between compound 3a with ct-DNA
从图1可以看出,随着ct-DNA浓度的增加,吸光度逐渐减小,3a在299 nm处出现减色效应。3b、 3c在305.5 nm、 308 nm处也出现了类似的减色效应,由此可以判断3a~3c均是以插入的模式与ct-DNA相互作用。由表1可以看出,3a~3c与ct-DNA的结合常数依次为5.14×106、 1.87×107和9.93×106L·mol-1,可看出3a~3c与DNA的结合能力均较强[23],并且3b的结合常数大于3a和3c,表明3b与ct-DNA的结合能力更强。
cDNA/10-4(mol·L-1)图2 3a~3c的cDNA/(εa-εf)与cDNA关系图Figure 2 Plot of cDNA/(εa-εf) against cDNA of 3a~3c
图3为3a~3c的(η/η1)1/3与ccompound/cDNA关系图。从图3中可以看出,随着3a~3c的浓度的增加,化合物与ct-DNA混合溶液的相对粘度升高,这是由于为了容纳3a~3c, ct-DNA相邻碱基对间的距离增大,双螺旋长度增长,导致混合溶液的粘度增加[24]。说明3a~3c均以插入方式与ct-DNA作用,这与紫外光谱得出的结论一致。
(2) 3a~3c与BSA的相互作用
荧光猝灭分为静态猝灭和动态猝灭,静态猝灭是猝灭剂与BSA形成了复合物,而动态猝灭是两者发生相互碰撞造成的,可用Stern Volmer和Lineweaver-Burk方程[25-26]来描述。

表2 3a~3c与BSA的动态荧光猝灭参数Table 2 Dynamic fluorescence quenching parameters of 3a~3c with BSA

表3 3a~3c与BSA的静态荧光猝灭参数Table 3 Static fluorescence quenching parameters of 3a~3c with BSA

ccompound/cDNA图3 3a~3c的(η/η1)1/3与ccompound/cDNA关系图Figure 3 Plot of (η/η1)1/3 against ccompound/cDNA of 3a~3c
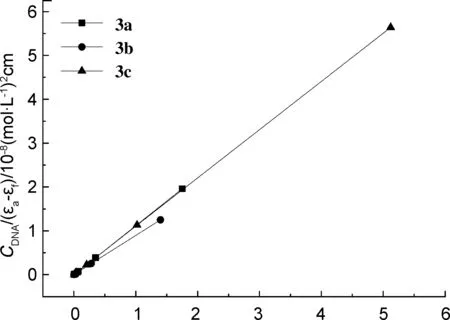
以3a为例,3a与BSA相互作用的荧光曲线和3a~3c与BSA作用的结合曲线图分别见图4和图5。如图4所示,随着化合物浓度增大,荧光猝灭的峰形和位置基本保持不变,但荧光强度呈梯次下降,在340 nm左右发生荧光猝灭,说明3a与BSA发生了相互作用。3b,3c与BSA作用发生荧光猝灭的峰形和位置与3a相似。
假设两者是动态猝灭的过程。根据Stern Volmer,对Q和F0/F进行线性拟合,拟合结果见表2。由表2可知,猝灭速率常数Kq大于最大动态猝灭速率常数(2×1010L·mol-1·s-1),表明酰腙化合物与BSA的相互作用并不是由分子碰撞引起的,而是形成了复合物。
根据Lineweaver-Burk,以lg[Q]对lg[(F0-F)/F]进行线性拟合,得到图5,斜率为n,截距为lgKA。拟合结果列于表3,可以看出,3a~3c与BSA均以近似1/1形成了复合物,表明酰腙化合物可以在生物体内被蛋白质运输与储存[27]。3a~3c与BSA的结合常数KA分别为1.87×103、 9.77×107、 9.37×104L·mol-1,KA(3b)>KA(3c)>KA(3a),表明氯代酰腙化合物3b较其他两种卤代化合物3a和3c与BSA的结合能力更强。
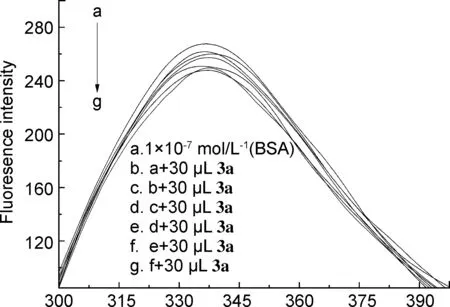
λ/nm图4 3a与BSA作用的荧光曲线Figure 4 The fluorescence curves of interaction between 3a and BSA
(3) 3a~3c的抑菌活性研究
表4为DMSO和3a~3c对4种细菌的抑菌圈数据,抑菌顺序为大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌和铜绿假单胞菌。由表4可以看出,3a~3c相对于空白对照组均对4种细菌有一定抑菌能力。同一浓度下,3a对4种细菌的抑菌能力不断减弱,3b对4种细菌的抑菌能力先增强后减弱,3c对4种细菌的抑菌能力不断增强,且3a相对于3b, 3c的抑菌能力最强,这是由于在生物体内,含氟化合物对膜、组织等具有较强的渗透力,提高了含氟化合物在生物体内的吸收和传递速度[28]。同一化合物对不同细菌的抑菌效果不同,3a对大肠杆菌的抑菌能力最强,3b对枯草芽孢杆菌的抑菌能力最强,3c对铜绿假单胞菌的抑菌能力最强。随着化合物浓度降低,3a~3c的抑菌能力不断降低。在化合物浓度为2 mg·mL-1时,3a对4种细菌的抑菌圈直径依次为10.97、 10.92、 10.90和10.89 mm。在化合物浓度为0.25 mg·mL-1时,3a~3c对4种细菌的抑菌圈直径接近于空白对照组的抑菌圈直径,因此3a~3c的最小抑菌浓度为0.25 mg·mL-1。
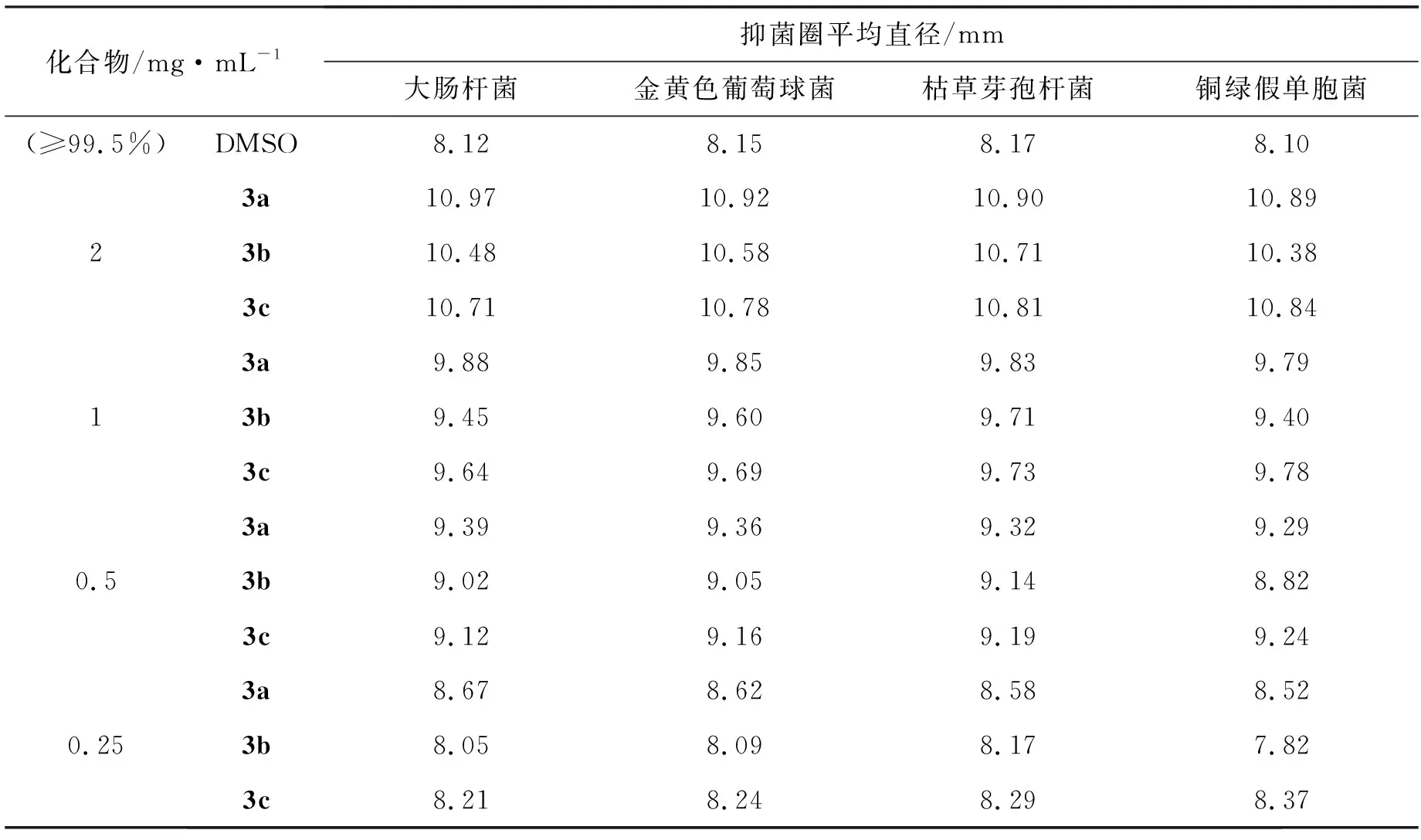
表4 DMSO和3a~3c对4种细菌的抑菌圈数据Table 4 The date of inhibition zones of DMSO and 3a~3c against four kinds of bacteria
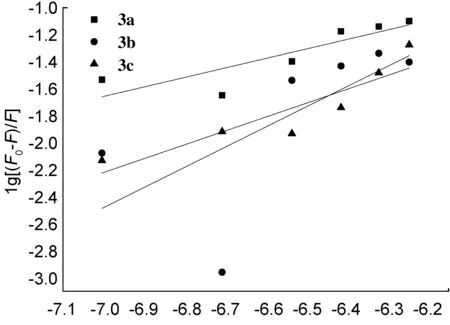
lg[Q]图5 3a~3c的lg[Q]与lg[(F0-F)/F]的关系曲线Figure 5 Plot of lg[(F0-F)/F] against lg[Q] of 3a~3c
合成了3种新型双卤代吡啶酰腙(3a~3c)。 3a~3c均是以插入方式与ct-DNA产生相互作用;化合物与BSA通过静态猝灭的方式形成复合物;3a~3c与ct-DNA, BSA的结合强度关系为:3b>3c>3a。 3a~3c对大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌和铜绿假单胞菌4种细菌均有一定的抑菌能力。其中3a对4种细菌的抑菌能力最强。
