LGR5和E-cadherin在胃癌组织中的表达及临床意义
2020-05-13陈维顺艾琼嘉刘敏姬胡洪赛屈伟明
谭 林 王 骞 陈维顺 艾琼嘉 刘敏姬 胡洪赛 屈伟明
作者单位:412007 株洲 中南大学湘雅医学院附属株洲医院消化内科
胃癌是常见的消化系统恶性肿瘤,2013年数据显示我国胃癌新发病例约43万例,发病率排在全部恶性肿瘤的第3位[1]。目前,尽管胃癌的诊断和治疗均取得了一定进展,但预后仍不理想,其中胃癌发生侵袭转移是导致患者死亡的重要原因。因此,亟需寻找特异性的预后预测及治疗靶点。上皮-间质转化(epithelial-mesenchymal transition,EMT)是促进肿瘤侵袭转移的关键步骤,研究显示上皮细胞表型蛋白E-钙粘蛋白(E-cadherin)表达下调可导致EMT发生[2-4]。富含亮氨酸重复序列G蛋白偶联受体5(leucine-rich repeat-containing G protein-coupled receptor 5,LGR5)是一种表达于多种正常细胞及肿瘤细胞表面的膜蛋白,可通过激活Wnt/β-catenin信号通路诱导EMT,促进胃癌细胞侵袭迁移[5]。然而,LGR5和E-cadherin在胃癌中的表达及其与预后的关系尚未清楚。本研究通过检测LGR5和E-cadherin在胃癌组织及癌旁正常组织中的表达,分析两者与临床病理特征及预后的关系,为寻找胃癌新的生物学标志物提供思路。
1 资料与方法
1.1 临床资料
收集2014年8月—2016年5月在中南大学湘雅医学院附属株洲医院胃癌根治手术切除的癌组织标本115例及相应的癌旁正常组织标本20例(均为手术切缘,病理证实无癌浸润),其中男性82例,年龄35~86岁(平均年龄61.0岁)。纳入标准:⑴经病理诊断为胃癌;⑵术前未行化疗及放疗;⑶顺利行胃癌根治术;⑷临床及病理资料完整,可追踪随访。排除标准:⑴合并其他恶性肿瘤者;⑵有严重心、肝、肾等重要脏器功能损害或其他严重基础疾病者。组织标本获取和使用经本院伦理委员会批准,患者知情同意并签署知情同意书。
1.2 免疫组化法检测胃癌组织LGR5和E-cadherin的表达
兔抗人LGR5多克隆抗体(ab75732)购自英国Abcam公司;鼠抗人E-cadherin单克隆抗(MAB-0738)购自福州迈新公司。所有标本经4%多聚甲醛固定后,脱水、透明、浸蜡包埋,制成4 μm厚连续切片,按照SP法进行免疫组化染色。高倍镜视野(×200)下每片随机选择5个视野进行拍照观察。结果判断:由病理科医师双盲阅片,以细胞膜、细胞质、细胞核中出现黄色或黄褐色颗粒视为免疫组化染色阳性。免疫组化计分包括染色强度及阳性细胞比例确定。按染色强度分级:无染色或与背景一致的浅黄色记0分,黄色记1分,棕黄色记2分,黄褐色记3分。按阳性细胞比例分级:阳性细胞数<5%计0分,5%~25%计1分,26%~50%计2分,>50%计3分。每张切片得分由染色强度评分与阳性细胞比例评分相加,0~3分为阴性表达,4~6分为阳性表达。
1.3 随访
采用门诊或电话定期随访,自患者手术当天起每半年随访1次,随访截至2019年9月,以患者死亡、失访或最后随访时间为终点,随访内容主要为患者生存情况。中位随访时间为36个月,随访期间死亡60例。总生存期定义为自患者入组开始至因任何原因死亡的时间。
1.4 统计学方法
采用SPSS 25.0软件进行数据分析。LGR5和E-cadherin在癌组织和癌旁正常组织中表达的差异及其与临床病理特征的关系采用χ2检验或校正χ2检验;LGR5与E-cadherin表达相关性采用Spearman检验;采用Kaplan-Meier法计算生存率、组间生存曲线的比较采用Log-rank检验;采用Cox比例风险回归模型分析LGR5、E-cadherin与预后的关系。以双侧P<0.05为差异有统计学意义。
2 结果
2.1 胃癌组织及癌旁正常组织中LGR5和E-cadherin的表达
LGR5主要表达于细胞质,在胃癌组织中阳性率为62.6%(72/115),其中有转移胃癌组织中的阳性率为78.9%(56/71),无转移胃癌组织中的阳性率为36.4%(16/44);在癌旁正常组织中的阳性率为35.0%(7/20)。胃癌组织与癌旁正常组织、有转移胃癌组织与无转移胃癌组织组的LGR5阳性表达比较,差异均有统计学意义(χ2=25.573,P<0.001;χ2=20.969,P<0.001)。
E-cadherin主要表达于细胞质与细胞膜,在胃癌组织中阳性率为53.9%(62/115),其中有转移胃癌组织中的阳性率为32.4%(23/71),无转移胃癌组织中的阳性率为88.6%(39/44);癌旁正常组织中的阳性率为100.0%(20/20)。胃癌组织与癌旁正常组织、有转移胃癌组织与无转移胃癌组织的E-cadherin阳性表达比较,差异均有统计学意义(χ2=44.829,P<0.001;χ2=34.583,P<0.001)。见图 1。

图1 LGR5和E-cadherin在胃癌及癌旁正常组织中的表达(SP×200)Fig.1 Expression of LGR5 and E-cadherin in gastric cancer tissues and adjacent normal tissues(SP×200)
2.2 LGR5和E-cadherin的表达与胃癌患者临床病理参数的关系
LGR5表达与肿瘤大小、分化程度、TNM分期、浸润深度、淋巴结转移及远处转移有关(P<0.05);E-cadherin的表达与肿瘤大小、TNM分期、浸润深度、淋巴结转移及远处转移有关(P<0.05)。见表1。
2.3 胃癌组织中LGR5表达与E-cadherin表达的关系
Spearman相关性分析结果显示,在胃癌组织中,LGR5与 E-cadherin的表达呈负相关(r=-0.318,P=0.001)。见表2。
2.4 LGR5和E-cadherin表达与预后的关系
Kaplan-Meier生存分析显示,LGR5阳性表达组1年、3年总生存率及中位生存时间分别为63.9%、38.9%、21个月,LGR5阴性表达组分别为88.4%、69.8%、36个月,差异有统计学意义(P<0.001)。E-cadherin阴性表达组1年、3年总生存率及中位生存时间分别为56.6%、30.2%、36个月,E-cadherin阳性表达组分别为87.1%、67.7%、15个月,差异有统计学意义(P<0.001)。见图2。
单因素Cox回归分析显示,肿瘤大小、分化程度、浸润深度、TNM分期、淋巴结转移、远处转移、LGR5表达阳性和E-cadherin表达阴性与预后有关(P<0.05)。多因素Cox回归分析显示,TNM分期Ⅲ~Ⅳ期、淋巴结转移、远处转移、LGR5表达阳性及E-cadherin表达阴性是影响预后的独立危险因素(P<0.05)。见表3。

表1 LGR5和E-cadherin在胃癌组织中的表达及与临床病理参数的关系Tab.1 Relationship between the expression of LGR5,E-cadherin and the clinicopathological characteristics of gastric cancer tissues
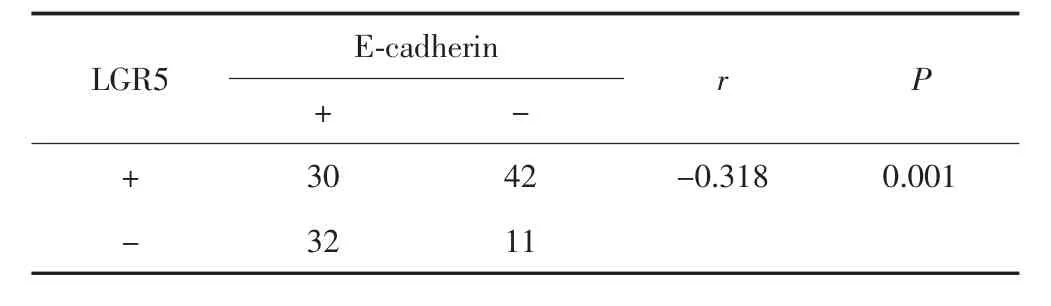
表2 LGR5与E-cadherin在胃癌组织中表达的Spearman相关性分析Tab.2 Spearman correlation analysis of the expression of LGR5 and E-cadherin in gastric cancer tissues

图2 LGR5和E-cadherin阳性表达与阴性表达胃癌患者的生存曲线Fig.2 Survival curves of gastric cancer patients with LGR5 and E-cadherin positive expression and negative expression
3 讨论
LGR5是G蛋白偶联受体家族视紫红质亚家族中的一员,由富含18个亮氨酸的重复单位和7个跨膜区域组成。LGR5阳性表达的细胞具有某些干细胞特征,可表达于正常组织和肿瘤组织,在食管腺癌、胃癌、结直肠癌、肝癌、卵巢癌等肿瘤组织中呈弥漫性过表达[6-7]。本研究发现,LGR5在胃癌中的表达高于癌旁正常组织,且主要在有转移的胃癌组织中表达,提示LGR5在胃癌中可能发挥促癌作用,与国内文献报道基本一致[8-9]。进一步的临床分析显示LGR5在分化程度低、浸润程度深、TNM分期为Ⅲ~Ⅳ期、合并淋巴结转移或远处转移患者中高表达,提示LGR5高表达可能与肿瘤进展相关,表达量越高,肿瘤越易发生侵袭转移。此外,Kaplan-Meier生存分析显示,LGR5表达阳性患者的生存率明显低于LGR5表达阴性患者,多因素Cox回归分析亦发现LGR5高表达是影响胃癌患者总生存期的独立危险因素,说明LGR5高表达提示患者预后不良。WANG等[10]研究也发现,过表达LGR5与结直肠癌不良预后相关。其可能机制为LGR5与配体R-脊椎蛋白(R-spodin)结合后,可以中和Rnf43/Znrf3的降解信号,从而活化 Wnt/βcatenin信号通路参与肿瘤的EMT过程,进而促进肿瘤侵袭转移,最终导致患者预后不良[11]。

表3 影响胃癌患者预后的Cox回归分析Tab.3 Cox regression analysis of prognosis in gastric cancer patients
E-cadherin是一种依赖Ca2+的黏附分子,通过β-catenin等与肌动蛋白纤维相连形成并稳定细胞间连接;E-cadherin的缺失是EMT的最重要的标志性变化,也是上皮肿瘤细胞发生侵袭转移的前提条件[12]。研究证明EMT在包括胃癌在内的多种上皮源性肿瘤侵袭和早期转移中起决定性作用[13-14]。本研究发现,E-cadherin在胃癌组织中的表达明显低于癌旁正常组织,且在转移组织中的表达低于无转移的胃癌组织,同时E-cadherin在浸润程度深、TNM分期为Ⅲ~Ⅳ期、有淋巴结转移或远处转移患者中低表达,且E-cadherin阴性表达患者术后总生存期低于阳性表达患者,多因素Cox回归分析发现E-cadherin是影响患者总生存的独立因素,说明E-cadherin与胃癌发生发展和侵袭转移密切相关,且E-cadherin低表达提示患者预后不良,与现有文献[15-16]报道基本一致。
本研究进一步分析LGR5与E-cadherin表达的相关性,发现两者呈负相关。既往有研究发现,LGR5在胃癌组织中表达明显上调,且与EMT诱导因子PRRX1、TWIST1和BMI1的表达密切相关,在胃癌细胞中LGR5可通过激活TWIST1下调E-cadherin表达,从而诱导EMT的发生,促进细胞侵袭转移[17]。故推测LGR5可能通过影响E-cadherin的表达促进EMT发生,最终导致胃癌侵袭转移及不良预后。
综上所述,LGR5在胃癌中高表达,且与患者不良预后有关,可能通过下调E-cadherin的表达而促进EMT发生实现。LGR5有望作为评估患者预后、监测术后肿瘤侵袭转移的分子标志物及诊疗的新靶点。但本研究为单中心回顾性研究,且纳入临床样本量有限,有关结论尚需多中心大样本研究加以证实。
