盐霉素通过靶向调控ALDH影响三阴性乳腺癌细胞MDA-MB-231增殖和凋亡
2020-05-13赵菊梅
何 朵 吴 博 赵菊梅
作者单位:716000 延安 延安大学医学院;延安市肿瘤防治研究重点研究室
乳腺癌是女性常见的恶性肿瘤之一,其发病率位居女性恶性肿瘤的首位[1-2]。而三阴性乳腺癌作为乳腺癌的一种特殊亚型,具有较高的肿瘤异质性,易发生局部复发和远处转移,且对内分泌治疗和分子靶向治疗不敏感,化疗成为三阴性乳腺癌治疗的主要手段,但转移或复发的三阴性乳腺癌易耐药,因此亟需进一步开发针对三阴性乳腺癌的新型化疗药物以及治疗靶点[3-5]。ALDH是乳腺癌干细胞(cancer stem cells,CSCs)最为可靠的标志物,在乳腺癌干细胞表面高表达,且表达与乳腺癌的发生、发展、预后和转移密切相关,可作为三阴性乳腺癌的独立预后因素[6-7]。盐霉素(salinomycin,Sal)是一种羧基载体类钾离子载体抗生素。研究表明盐霉素作为一种新型的抗肿瘤药物,能够通过诱导凋亡而抑制多种癌细胞及癌干细胞生长[8-10]。但Sal对乳腺癌细胞凋亡的作用以及是否与乳腺癌干细胞表面标志物ALDH的表达相关尚不明确。本研究观察Sal对MDA-MB-231细胞生长、凋亡的影响,并探讨其可能的作用机制,为三阴性乳腺癌治疗提供新的靶点。
1 材料与方法
1.1 主要试剂和仪器
人乳腺癌细胞系 MDA-MB-231、MCF7、T47D购自美国模式培养物集存库(ATCC);Sal购自上海安奈德化学技术中心;RPMI 1640培养基购自美国Gibco公司;二亚基亚砜(DMSO)、四甲基偶氮唑蓝(MTT)购自美国Sigma公司;胎牛血清购自美国Invitrogen公司;Annexin V-FITC细胞凋亡检测试剂盒购自南京凯基生物科技发展有限公司;ALDEFLOUR kit购自加拿大StemCell公司;Bcl-2抗体、Bax抗体、Cleaved-PARP抗体购自英国Abcam公司;Cleaved-Caspase-3抗体购自武汉三鹰公司。MTT购自Biosharp公司;酶标仪购自美国Thermo Fisher Scientific公司;流式细胞仪购自美国BD公司。
1.2 细胞培养与分组
人乳腺癌细胞MDA-MB-231置于含10%FBS、青霉素100 U/mL和链霉素100 U/mL的RPMI 1640培养基,37℃、5%CO2培养箱中培养,待细胞长至80%~90%密度时用胰酶消化传代;每2~3 d传代1次,取处于对数生长期的细胞进行实验。根据细胞中加入的Sal浓度分组:对照组 0 μmol/L Sal,以及不同浓度(1 μmol/L、2 μmol/L、4 μmol/L、8 μmol/L、16 μmol/L、32 μmol/L)的 Sal组。
1.3 MTT实验检测MDA-MB-231细胞增殖情况
取对数生长期细胞,制成单细胞悬液,调整细胞浓度为 5×104/mL,96孔板每孔加入 100 μL细胞悬液,置于37℃、5%CO2培养箱过夜培养,待细胞贴壁后按照 1μmol/L、2μmol/L、4μmol/L、8μmol/L、16μmol/L、32 μmol/L的终浓度依次加入Sal,每组设置5个复孔,以相同体积的培养基作为空白对照组。分别于24 h、48h、72 h每孔加 20 μL MTT 溶液(5 mg/mL),培养 4 h,弃去孔内培养液,每孔加入150 μL DMSO,采用酶联免疫检测仪检测490 nm处各孔吸光度(OD)值并计算细胞增殖抑制率。细胞增殖抑制率(%)=[(实验组OD值-空白对照组OD值)/(对照组OD值-空白对照组OD值)]×100%。实验至少重复3次。
1.4 流式细胞仪检测MDA-MB-231细胞凋亡情况
Sal作用48 h后,取各组对数生长期MDA-MB-231细胞,收集细胞悬液,调整细胞浓度为5×105/mL,PBS清洗,离心后弃上清液,分别加入500μLBindingBuffer和FITC标记的Annexin-V 5 μL,室温避光30 min,加入PI 5μL,避光反应5~10 min,PBS清洗后离心弃上清液,加入400 μL Binding Buffer重悬,流式细胞仪检测细胞凋亡情况。实验至少重复3次。
1.5 流式细胞仪检测MCF7、T47D、MDA-MB-231细胞表面标志物ALDH的表达
取对数生长期MCF7、T47D、MDA-MB-231细胞,胰酶消化制成单细胞悬液,按照5×105/mL细胞浓度接种于6孔板,每孔加入2 mL细胞悬液以及不同浓度(0 μmol/L、2 μmol/L、4 μmol/L、8 μmol/L)Sal作用48 h。用ALDEFLUOR Buffer重悬细胞并调整细胞浓度为 1×106/mL,DEAB 管中加入 5 μL DEAB;TEST管加入1 mL细胞,转移0.5 mL至DEAB管,孵育25~45 min,离心弃上清液,300 μL ALDEFLUOR Buffer重悬,流式细胞仪上机检测。实验至少重复3次。
1.6 Western blot检测凋亡相关蛋白 Bcl-2、Bax、PARP、Caspase-3的表达
Sal作用48 h后,取各组对数生长期MDA-MB-231细胞,收集细胞并提取总蛋白,BCA试剂盒测定蛋白浓度,SDS-PAGE电泳分离,电转至PVDF膜上,封闭1 h,分别加入凋亡相关蛋白 Bcl-2、Bax、PARP、Caspase-3和内参蛋白GAPDH等抗体,4℃孵育过夜;加入二抗,室温孵育1 h,ECL曝光显影成像。实验至少重复3次。
1.7 qRT-PCR检测MDA-MB-231细胞凋亡相关分子Bcl-2、Bax、PARP 及 Caspase-3 mRNA 的表达
Sal作用48 h后,取各组对数生长期MDA-MB-231细胞,Trizol试剂盒提取总RNA,测定260/280 nm OD值,确定RNA纯度及浓度。按反转录试剂盒反转录获得相应的cDNA。以GAPDH为内参。实时荧光PCR反应混合液共20 μL,反应条件:95℃反应 5 min预变性;95 ℃反应20 s,58 ℃反应20 s,72 ℃反应20 s,72 ℃反应 10 min,共 40 个循环,并采用 2-ΔΔCt法计算目的基因mRNA的相对表达量。引物序列见表1。实验至少重复3次。

表1 引物序列Tab.1 Primer sequence
1.8 基于TCGA数据库分析ALDH与凋亡相关分子表达的相关性
在 TCGA 数据库(https://portal.gdc.cancer.gov)中下载乳腺癌组织及其癌旁正常组织的RNA-Seq数据(n=1 218),以及与其对应的临床样本信息资料。并根据所对应的临床信息进一步筛选三阴性乳腺癌组织(n=306),分析ALDH与凋亡信号通路相关分子Bcl-2、Bax、PARP及Caspase-3 mRNA表达的相关性。
1.9 统计学方法
采用GraphPad Prism 5.0软件进行统计分析。计量数据多组间比较采用单因素方差分析,多重比较使用Dunnett′s t检验,相关性分析采用Pearson法。以双侧P<0.05为差异有统计学意义。
2 结果
2.1 流式细胞术筛选ALDH高表达乳腺癌细胞系
流式细胞仪检测结果显示,MCF7、T47D、MDAMB-231细胞的ALDH相对表达比例分别为2.44%、1.27%、4.34%,其中MDA-MB-231细胞的比例最高,见图1。故选取MDA-MB-231细胞进行后续研究。
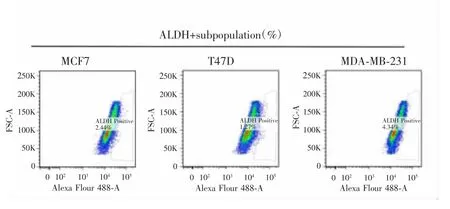
图1 MCF7、T47D、MDA-MB-231乳腺癌细胞ALDH表达情况Fig.1 Expression of ALDH in MCF7,T47D and MDA-MB-231 breast cancer cells
2.2 Sal对MDA-MB-231细胞增殖的影响
MTT 法检测结果显示,Sal在 24 h、48 h、72 h 均可以剂量依赖的方式抑制MDA-MB-231细胞增殖,且组间差异有统计学意义(F24=83.080,P24<0.001;F48=41.810,P48<0.001;F72=248.600,P72<0.001),多重比较发现,2 μmol/L 组、4 μmol/L 组、8 μmol/L 组、16 μmol/L组、32 μmol/L组的细胞活力均低于对照组(均P<0.01),见图 2。而 16 μmol/L 组、32 μmol/L 组 24 h、48 h、72 h的细胞抑制率均低于50%,因此选择2 μmol/L、4 μmol/L、8 μmol/L 作用 48 h 进行后续研究。

图2 Sal对乳腺癌细胞MDA-MB-231增殖的影响Fig.2 Effect of Sal on proliferation of breast cancer cell MDA-MB-231
2.3 Sal对MDA-MB-231细胞凋亡的影响
流式细胞仪检测结果显示,Sal作用MDA-MB-231细胞48 h后,各组细胞凋亡率差异有统计学意义(F=10.080,P=0.004),进一步多重比较发现,2 μmol/L组、4 μmol/L 组、8 μmol/L 组的细胞凋亡率均高于对照组(t2=13.110,P2=0.006;t4=11.290,P4=0.008;t8=7.185,P8=0.019),且Sal可浓度依赖的促进MDA-MB-231细胞凋亡。见图3。
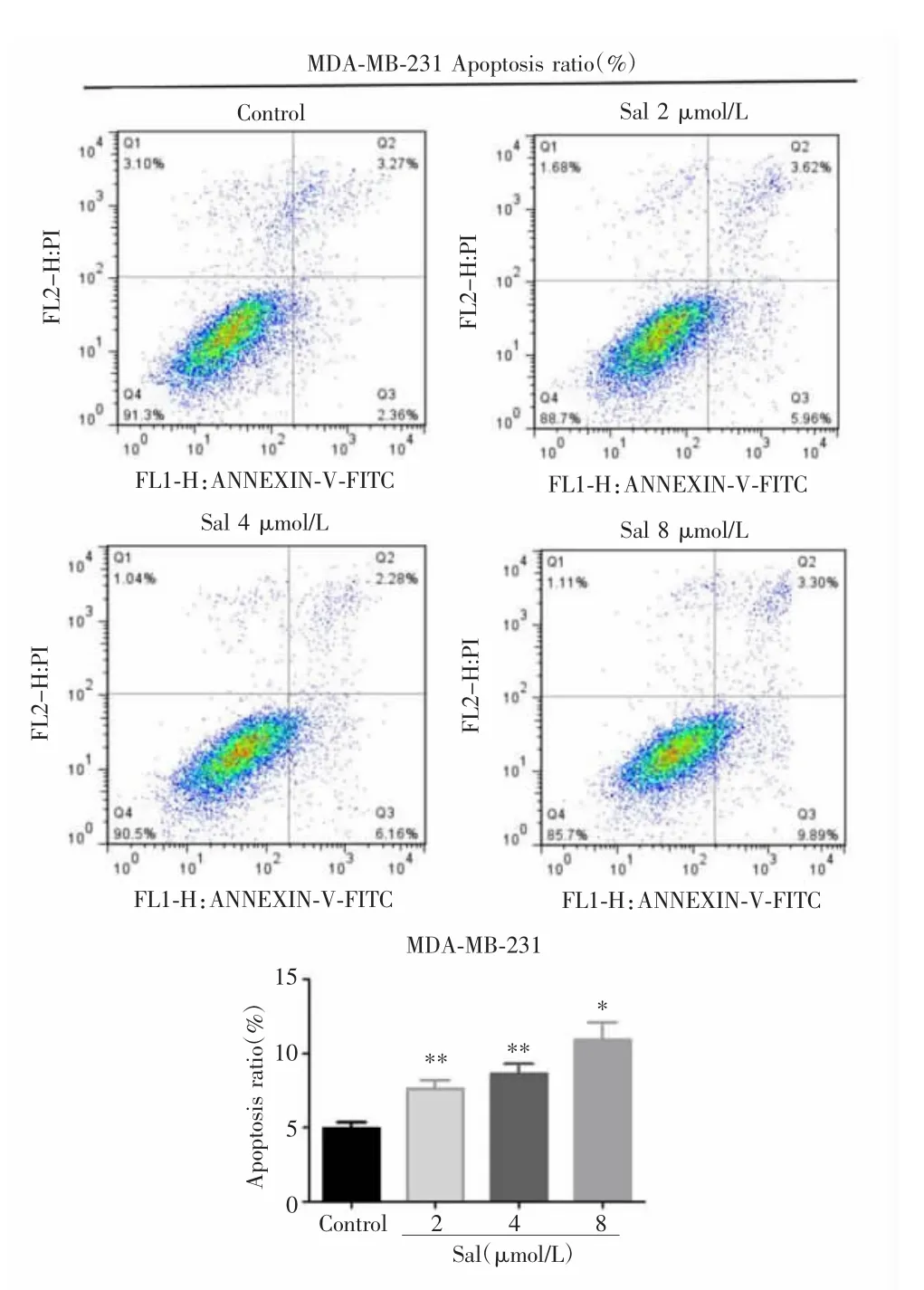
图3 Sal对乳腺癌细胞MDA-MB-231凋亡的影响Fig.3 Effect of Sal on apoptosis of breast cancer cell MDA-MB-231
2.4 Sal对MDA-MB-231细胞凋亡相关分子表达的影响
qRT-PCR检测结果显示,Sal作用MDA-MB-231细胞48 h后,各组细胞凋亡相关分子Caspase-3、Bcl2、Bax、PARP mRNA的表达差异均有统计学意义(FCaspase-3=143.200,PCaspase-3<0.001;FBcl-2=70.200,PBcl-2<0.001;FBax=47.930,PBax<0.001;FPARP=34.470,PPARP<0.001),多重比较显示,2 μmol/L 组、4 μmol/L 组、8 μmol/L 组 Bcl-2、PARP、Caspase-3mRNA的表达均低于对照组(均P<0.05),Bax mRNA 表达均高于对照组(均 P<0.05)。见图 4。Western blot结果显示,与对照组相比,2 μmol/L 组、4 μmol/L 组、8 μmol/L 组 Bcl-2、Caspase-3蛋白表达呈剂量依赖性降低,而PARP、Bax蛋白表达呈剂量依赖性增加。见图5。
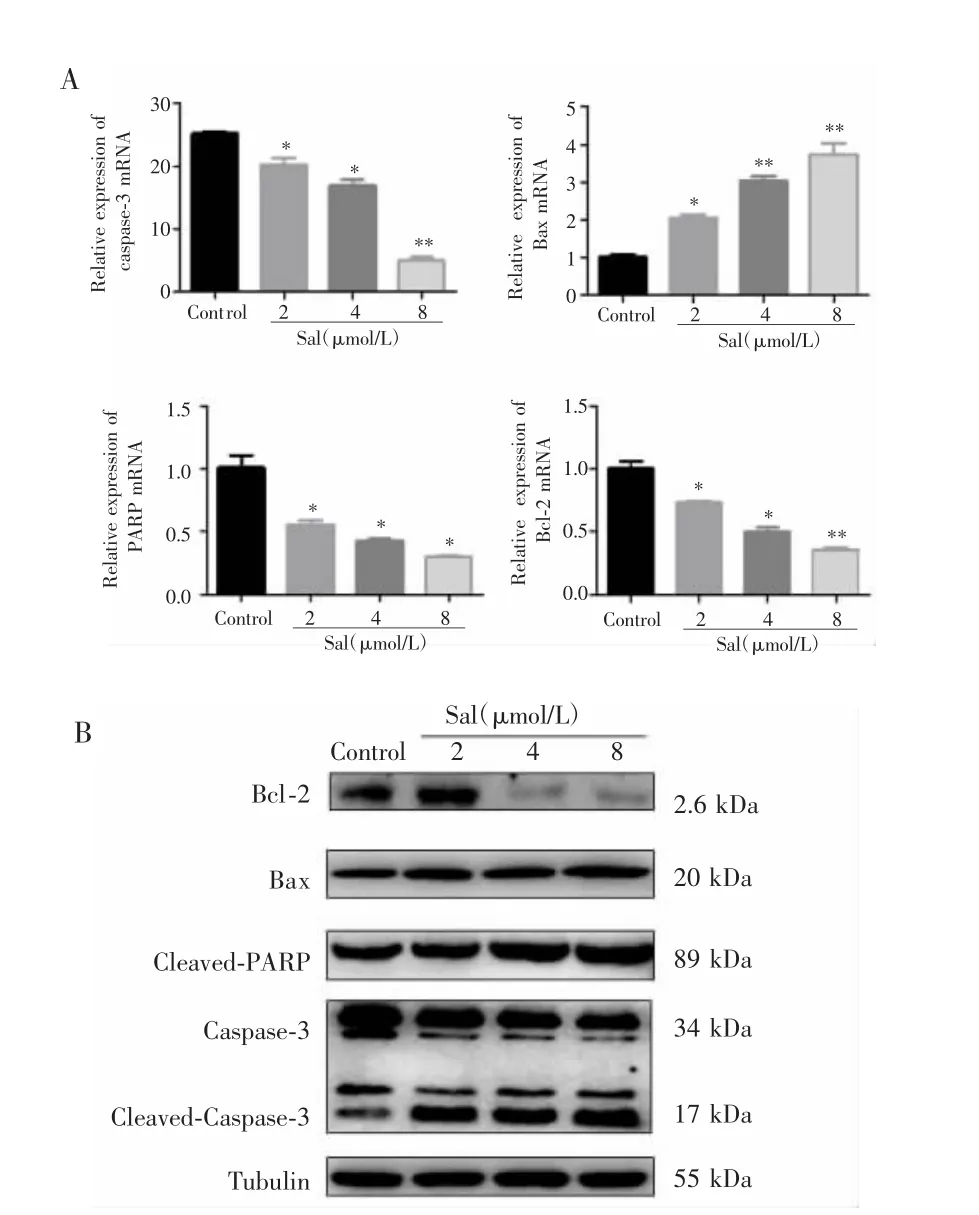
图4 Sal对乳腺癌细胞MDA-MB-231凋亡相关分子表达的影响Fig.4 Effect of Sal on the expression of apoptosis-related molecules MDA-MB-231 in breast cancer cells
2.5 Sal对乳腺癌MDA-MB-231肿瘤干细胞表面标志物ALDH表达的影响
流式细胞仪检测结果显示,Sal作用MDA-MB-231细胞48 h后,各组乳腺癌干细胞表面标志物ALDH 表达差异有统计学意义(F=94.390,P<0.001),多重比较显示,2 μmol/L 组、4 μmol/L 组、8 μmol/L组ALDH表达均低于对照组(t2=6.672,P2=0.022;t4=9.844,P4=0.010;t8=102.800,P8<0.001),且 Sal呈浓度依赖性抑制ALDH在MDA-MB-231细胞中的表达。见图5。
2.6 TCGA数据库分析ALDH与凋亡相关分子表达的相关性
TCGA数据库分析结果显示,ALDH与抗凋亡相关分子 Bcl-2(r=0.209,P=0.007)以及 Caspase-3(r=0.235,P=0.002)的表达呈正相关,与 Bax(r=-0.326,P<0.001)及 PARP(r=-0.453,P<0.001)的表达呈负相关。见图6。

图5 Sal对乳腺癌细胞MDA-MB-231肿瘤干细胞表面标志物ALDH表达的影响Fig.5 Effect of Sal on expression of surface marker ALDH in MDA-MB-231 breast cancer cell

图6 基于TCGA数据库分析ALDH与凋亡相关分子表达的相关性Fig.6 Analysis of the correlation between ALDH and the expression of apoptosis-related molecules based on TCGA database
3 讨论
Sal是从白色链霉菌发酵液中分离出的一种新的生物活性物质,通过干扰细胞内外阳离子(Na+、K+)平衡,改变渗透压,杀死病原微生物,是一种典型的离子载体抗生素[11]。既往研究发现Sal能够抑制多种癌细胞及干细胞的生长及转移,并诱导其凋亡,抵抗耐药[12]。本研究采用MTT法检测不同时间点(24 h、48 h、72 h) 不同浓度(1~32 μmol/L)Sal作用 MDAMB-231细胞的增殖情况,发现Sal可抑制细胞增殖,且呈剂量依赖关系。进一步采用流式细胞仪检测Sal对MDA-MB-231细胞凋亡的影响,同样发现Sal能以剂量依赖的方式诱导MDA-MB-231细胞凋亡。同时,Western blot检测结果显示,Sal作用48 h后MDAMB-231细胞Caspase-3、PARP活化增多,Bax表达增加,而Bcl-2表达下降。以上结果表明Sal可抑制乳腺癌细胞MDA-MB-231增殖,并促进细胞凋亡。
ALDH是催化细胞内乙醛氧化为乙酸的细胞溶质酶,参与多种组织的分化与基因表达,表达相对稳定,不易受外界因素干扰,是CSCs可靠的标志物,可作为乳腺癌的预后指标,有望成为乳腺癌治疗的新靶点[13]。研究表明ALDH活性降低可引起癌细胞增殖并促进癌细胞凋亡[14-15]。CANUTO等[16]通过ALDH抑制剂抑制ALDH的活性,发现可诱导过表达Bcl-2的肝癌细胞凋亡,抑制肝癌细胞的生长。NAKOPOULOU等[17]研究发现,ALDH降低的同时伴Caspase-3活性下降。ZHANG等[18]亦发现过表达ALDH能够保护细胞免受由过氧化应激引起的Caspase-3启动的凋亡。为进一步探讨Sal是否通过乳腺癌干细胞表面标志物ALDH发挥细胞凋亡抑制作用,本研究采用流式细胞仪检测Sal对MDA-MB-231乳腺癌干细胞表面标志物ALDH表达的影响,结果显示Sal可以浓度依赖的方式抑制ALDH在MDA-MB-231细胞中的表达。采用TCGA数据库分析细胞凋亡相关分子与ALDH之间的相关性,结果显示ALDH与Caspase-3、Bcl-2的表达呈正相关,而与Bax、PARP的表达呈负相关。其中PARP剪切被认为是细胞凋亡的一个重要指标,亦是 Caspase-3激活的指标[19]。而Bcl-2、Bax不但可作为Caspase-3的上游调控机制,参与对Caspase-3活性的调节,还可作为Caspase-3的直接底物作用于Caspase-3的下游[20-21],二者在细胞凋亡传导过程中既相互联系又相互制约[22-23]。因此认为,Sal可能通过靶向调控ALDH的表达从而促进Bcl-2与Bax的相互作用,进一步激活下游底物PARP,Caspase-3的表达,最终促进肿瘤细胞凋亡,从而影响肿瘤生长。
综上所述,Sal可抑制三阴性乳腺癌细胞MDAMB-231增殖,并诱导其凋亡,可能通过下调肿瘤干细胞表面标志物ALDH表达实现,但Sal在发挥较强抗肿瘤活性的同时,其显著的神经和肌肉毒性也不容忽视[24-25],因此仍需进一步研究以提高其抗肿瘤活性、降低细胞毒性,从而为Sal成为一种新型的抗肿瘤药物提供依据。
