基于单细胞质谱流式技术分析膀胱肿瘤微环境中免疫细胞的组成
2020-05-13赖智勇胡嘉欣李枝键李天宇谢远亮王秋雁
赖智勇 胡嘉欣 李枝键李天宇 谢远亮 王秋雁
作者单位:530021 南宁 1广西医科大学基因组与个体化医学研究中心;2广西医科大学第一附属医院泌尿外科;3广西医科大学附属肿瘤医院泌尿外科
膀胱癌是泌尿系统常见的恶性肿瘤,2018年全球约有54.9万例新发病例和20万例死亡病例[1]。膀胱癌具有多中心、易复发及浸润性生长等特点[2],目前越来越多的证据表明膀胱癌是一组分子异质性疾病[3-4]。肿瘤异质性是影响治疗效果的主要因素之一[5]。因此,对膀胱癌异质性进行研究,分析不同患者疾病特点,有助于提供个性化治疗。单细胞技术可通过分析肿瘤微环境中细胞亚群的多样性及进化关系实现对肿瘤异质性研究[6]。作为单细胞理论的一种代表性应用,单细胞质谱流式技术(single-cell mass cytometry,CyTOF)采用金属同位素标记抗体,克服了传统流式通道间发射光谱信号重叠带来的影响,且可同时对单个细胞中多达40种参数进行检测,实现对细胞亚群的精确分析[7]。自从实现对人外周血细胞组分检测以来[8],CyTOF 在肾癌[9]、肺腺癌[10]、乳腺癌[11]等多种实体肿瘤的异质性分析中发挥了重要作用。本研究采用CyTOF对膀胱癌及癌旁组织的浸润性免疫细胞进行分群,并比较免疫细胞组成的差异,以期为膀胱癌的精准治疗提供依据。
1 资料与方法
1.1 一般资料
选择2018年12月—2019年3月在广西医科大学第一附属医院及广西医科大学附属肿瘤医院行膀胱癌根治术的患者为研究对象,收集其癌组织及其癌旁组织(距离肿瘤边缘2 cm)。纳入标准:⑴术后病理确诊为膀胱癌;⑵术前未接受免疫治疗、靶向治疗及放化疗。排除标准:⑴术前行经尿道膀胱肿瘤电切术者;⑵根治术后膀胱解剖提示组织坏死严重者;⑶膀胱肿瘤多发,未取得癌旁组织者。共4例患者符合标准纳入研究,临床病理资料见表1。本研究通过广西医科大学医学伦理委员会批准,患者及其家属知情同意。
1.2 试剂及仪器
DMEM/F12培养基、FBS特级血清购自北京Cellmax公司;胶原酶I购自美国Gibco公司;台盼蓝染液、红细胞裂解液及HBSS平衡液及青/链霉素双抗混合液均购自北京索莱宝科技有限公司;Dnasel、DMSO均购自美国Sigma-Aldrich公司;Fc受体封闭溶液购自美国Biolegend公司;抗体稳定缓冲液购自德国Candor Bioscience公司;MaxPar抗体标记试剂盒、顺铂、镧系金属标签、EQTM四元素校准磁珠、Helios 2 CyTOF质谱流式细胞仪均购自美国Fluidigm公司;MACSmixTM组织混悬仪、GentleMACS组织解离器均购自德国Miltenyi公司。

表1 膀胱癌患者的临床病理资料Tab.1 Clinicopathological characteristics in patients with bladder cancer
1.3 实验方法
1.3.1 单细胞悬液的制备 取新鲜膀胱癌组织及其癌旁组织,剪碎后转移至C管,加入胶原酶Ⅰ溶液(每l mL HBSS 加入 2 mg胶原酶Ⅰ和 20 μg DNaseI),置于gentleMACS组织处理器上解离。然后置于混悬仪上,37℃孵育,至无明显块状。于70 μm细胞滤器冰上过滤组织悬液,4℃离心后弃上清液。冰上裂解红细胞,加入预冷PBS重悬洗涤。按体积比1∶9将DMSO、FBS配制成冻存液,-80℃保存。
1.3.2 镧系金属探针标记 向管内加入95 μL L-Buffer重悬polymer,加入镧系金属溶液混匀,37℃水浴。50 kDa 超滤管中加入 100 μg 抗体和 400 μL R-Buffer,12 000×g,离心弃滤液。稀释TCEP至4 mmol/L。超滤管中加入TCEP-R-Buffer,混匀后37℃水浴30 min。取3 kDa超滤管,加入200 μL L-Buffer以及metal-loaded polymer混合物,离心,弃滤液。柱中加入400μL C-Buffer,离心,弃滤液。取出50kDa超滤管,加入300μLC-Buffer,离心,弃滤液。取出3 kDa超滤管和50 kDa超滤管后弃滤液,3 kDa超滤管中加入C-Buffer,重悬metalloaded polymer,转移至50 kDa超滤管中吹打混匀,37℃孵育90 min。取出滤管,抗体混合液中加入W-Buffer,离心后清洗 3次,管内加入80 μL W-Buffer,混匀,检测抗体浓度,离心后加入抗体稳定液,再次离心,-20℃保存。
1.3.3 细胞表面抗体标记 37℃下快速复苏细胞,离心去除DMSO后加入完全培养基重悬。稀释悬液后取少量用于台盼蓝染色,计数后留取150万细胞,PBS重悬。按1∶10 000比例配制Cisplatin,每管加入1 mL,避光孵育5 min,4℃离心,加入细胞染色缓冲液(CSB)后离心。按1∶50配制Fc受体阻断剂,每管加入50 μL,孵育10 min。每管加入50 μL抗体混合物,孵育1 h后加入CSB清洗,离心后弃上清液。按1∶4配制核抗原染色缓冲液工作溶液,每管加入1 mL,孵育30 min后加入2 mL核抗原染色渗透液,离心弃上清液。每管加入1 mL 1.6%甲醛工作液固定,孵育10 min,离心弃上清液。每管加入Ir工作液(1∶1 000),混匀后4℃过夜。取出样本,加入CSB及ddH20清洗。每管加入10%EQTM四元素校准磁珠溶液,重悬细胞,4℃保存,待上机检测。
1.3.4 CyTOF质谱数据分析 采用Helios 2 CyTOF质谱流式细胞仪检测样品中肿瘤浸润性免疫细胞26种免疫相关标志物的表达。采集流式数据后,导入CyTOF软件(v6.7)进行归一化合并。于Cytobank云平台(https://www.cytobank.org/)分析流式细胞实验标准文件(FCS)数据。通过t分布随机邻域嵌入(t-SNE)算法生成t-SNE图,对CD45+细胞进行聚类,分析不同细胞亚群表型及相对含量的差异。实验及数据分析流程如图1所示。
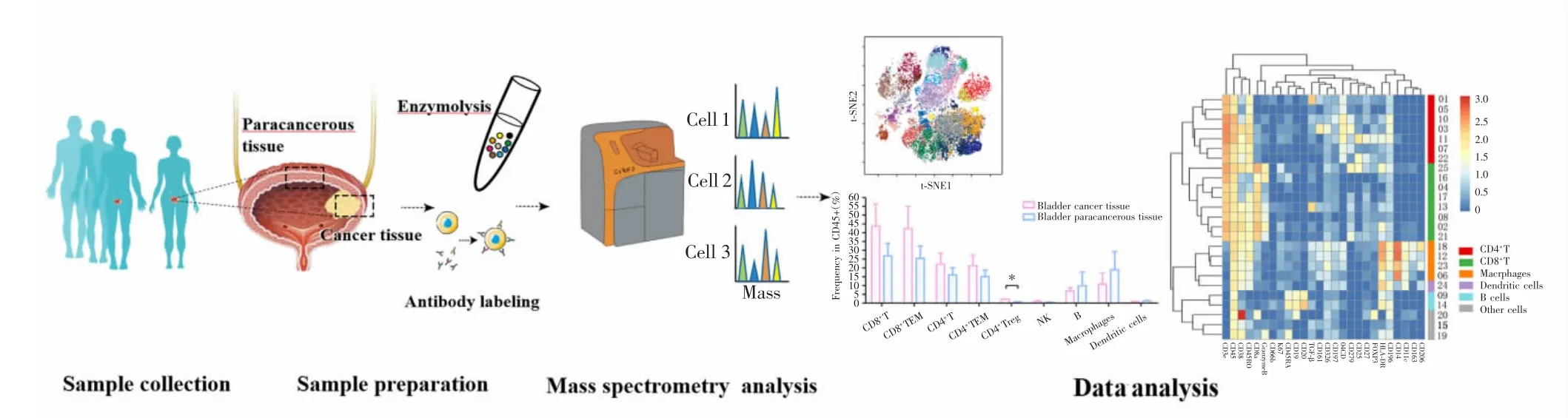
图1 实验设计及数据分析流程Fig.1 Experimental design and data analysis flow
1.4 统计学方法
采用SPSS 22.0软件进行数据分析。鉴于本研究中的样本量过少(n=4),故根据数据分布特点,选择配对样本t检验的Bootstrap法比较膀胱癌组织和癌旁组织两组数据中各类细胞亚群之间的差异。以双侧P<0.05为差异有统计学意义。
2 结果
2.1 膀胱肿瘤微环境免疫细胞亚群分布
根据门控圈取的20 000个CD45+免疫细胞上主要免疫标志物的表达水平,将其分成7个CD4+T细胞簇(CD3e+、CD4+、CD45RO+),即亚群 01、03、05、07、10、11、22;8 个 CD8+T 细胞簇(CD3e+、CD8a+),即亚 群 02、04、08、13、16、17、21、25;4 个 巨 噬 细 胞 簇(CD3e-、CD11c+、CD14+、CD38+、CD45RO+、HLA-DR+),即亚群 06、12、18、23;2 个 B 细胞簇(CD3e-、CD19+、CD20+、CD45RA+、HLA-DR+),即亚群 09、14;1 个树突状细胞簇 (CD3e-、CD38+、CD45RO+、HLA-DR+),即亚群24和3个其他类型免疫细胞(15、19、20),见图2A~B。聚类分析结果显示这些细胞亚群具有多样性,见图2C。

图2 膀胱肿瘤微环境免疫概况Fig.2 Overview of bladder cancer microenvironmental immunity
2.2 膀胱癌组织与癌旁组织中免疫细胞亚群的差异性
基于细胞表型间的相似性,本研究将癌组织与癌旁组织中CD45+细胞分为13类主要免疫细胞,分别为B细胞、巨噬细胞(macrophages)、树突状细胞(dendritic cells)、自然杀伤细胞(NK cells)、CD8+幼稚T细胞(CD8+T naive)、CD8+中枢记忆 T细胞(CD8+TCM)、CD8+有效记忆 T 细胞(CD8+TEM)、CD8+终末分化效应记忆T细胞(CD8+TEMRA)、CD4+Treg细胞、CD4+幼稚 T 细胞(CD4+T naive)、CD4+TCM、CD4+TEM、CD4+TEMRA,其在癌组织及癌旁组织中的分布特点见图3A。根据这些细胞表达抗体标记的差异性,进一步将其手工标记细分为18个免疫细胞亚群,包括CD4+T(CD4+Treg细胞、CD4+T naive、CD4+TCM、CD4+TEM、CD4+TEMRA),CD8+T(CD8+T naive、CD8+TCM、CD8+TEM、CD8+TEMRA),DP,DN 等 11 个 T 细胞亚群以及B细胞,巨噬细胞,树突状细胞,自然杀伤细胞,CD14-HLA-DR+,CD14-HLA-DR-,CD19-CD3-。通过Sunburst图呈现这18个免疫细胞亚群在CD45+细胞中的占比(图3B),发现T细胞的占比最大,在癌组织和癌旁组织中的平均占比分别为76.73%、47.60%;其次为B细胞,在癌组织和癌旁组织中平均占比分别为6.34%、15.20%;巨噬细胞在癌组织和癌旁组织中占比分别为8.84%、23.82%。将4例患者数据合并后计算发现,CD4+Treg细胞在癌旁组织中平均占比为0.81%,在癌组织中为2.20%,差异具有统计学意义(P=0.016),而其他类型免疫细胞的所占比例组间差异无统计学意义(P>0.05),见图 3B~C。
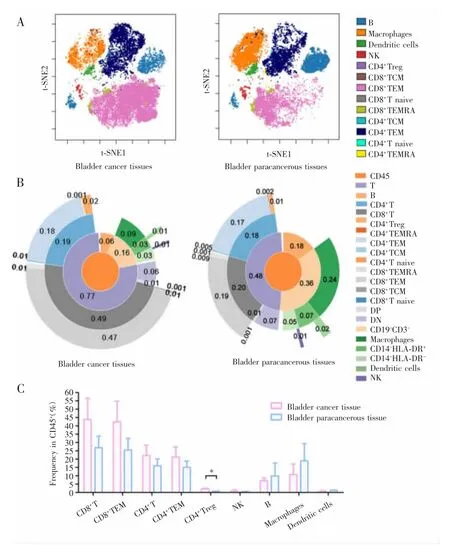
图3 膀胱癌组织与癌旁组织免疫细胞亚群之间的差异Fig.3 Difference in immune cell subpopulations between bladder cancer tissues and paracancerous tissues
3 讨论
免疫治疗在肿瘤治疗中取得了较大进展,目前主要的免疫检查点抑制剂PD-1/PD-L1为多种实体肿瘤患者带来了长期的生存获益[12-14],但是客观有效率仅为10%~30%[12]。膀胱癌诊断主要依靠组织学和免疫组织化学染色,但因存在组织学变异,不同患者预后并不同[15]。GALON 等[16]研究发现肿瘤复发和总生存时间在很大程度上取决于局部适应性免疫反应的状态,肿瘤样本中免疫细胞的类型、密度和位置较组织病理学检查能更好地预测患者生存。单细胞技术是目前用于研究肿瘤异质性的重要手段[17],质谱流式细胞术作为其代表应用之一,结合了传统流式分析方法和质谱技术的双重优点[7]。从方法学上,质谱流式技术能够区分不同的细胞亚群,有助于对肿瘤异质性分析。
本研究基于CyTOF比较了4例膀胱癌患者癌组织与癌旁组织中的免疫细胞亚群。结果显示,采用免疫细胞标志物对细胞进行标记后,可将其分为25个亚群,主要包括8类细胞群:CD4+T细胞、CD8+T细胞、巨噬细胞、B细胞、树突状细胞和其他类型的免疫细胞。同时也得到了每个细胞亚群在CD45+细胞中的占比。其中T细胞是主要的免疫细胞群,在癌组织中占比较大,其次为B细胞、巨噬细胞和树突状细胞,与CHEVRIER等[9]对肾透明细胞癌的研究结果相符。T细胞及B细胞、巨噬细胞、树突状细胞在癌组织和癌旁组织中的差异表达,提示不同免疫细胞的富集具有一定的组织倾向性。同时这些细胞亚群在不同患者中的占比相差较大,也反映了不同个体间肿瘤免疫微环境的异质性。
CD4+Treg细胞是一类胸腺来源的细胞,具有维持自身耐受,调节抗肿瘤免疫反应作用[18]。其介导的免疫抑制是肿瘤免疫逃逸机制之一,也是目前进行肿瘤免疫治疗的主要障碍[19-20]。发生免疫逃逸的肿瘤可通过调节肿瘤浸润性白细胞的募集、扩增和功能,避免被免疫系统检测和消除[21]。本研究发现CD4+Treg细胞比例在膀胱癌组织和癌旁组织中存在差异(2.20%vs 0.81%),尽管其占比较小。在许多人类癌症中,Tregs细胞的高度浸润与患者预后不良有关[22]。研究证实CD4+Treg细胞与膀胱癌患者的病理分级、肿瘤浸润深度、淋巴结转移和复发均呈正相关[23-25]。因此,本研究认为CD4+Treg细胞在膀胱癌组织中的相对富集,可能介导了膀胱肿瘤对机体的免疫逃逸,因此值得对CD4+Treg细胞群开展更深入的研究,探究其在膀胱癌发生发展中发挥的作用。
本研究存在以下不足:⑴样本量较少。因早期诊断的表浅膀胱肿瘤多采用经尿道膀胱肿瘤电切术治疗,组织标本体积较小,且经过烧灼后细胞活力较低,故该类患者未纳入本研究。⑵可用商品化抗体较少。当前质谱技术仍在发展中,可用的高质量免疫细胞抗体数量相对较少,有待更多高质量商品化抗体的推出,以覆盖对更多免疫细胞表面标志物的检测。
本研究通过CyTOF实现了对膀胱浸润性免疫细胞的初步分群,发现T细胞为膀胱肿瘤微环境中的主要细胞群,且在癌组织中相对比例更高,而B细胞、巨噬细胞和树突状细胞则在癌旁组织中相对更高。CD4+Treg细胞在膀胱癌组织中的相对富集,可能介导了膀胱肿瘤对机体的免疫逃逸。此外,本研究提供了一种通过降维算法t-SNE分析膀胱癌和癌旁浸润性免疫细胞差异性的方法。希望后续能够通过更大且独立的队列,分析更多的细胞亚群,为阐明膀胱癌的发病转移机制提供参考依据。
