十二指肠球部和末端回肠黏膜菌群多样性分析
2020-05-13范慧宁瞿国强
范慧宁,瞿国强
(1.上海交通大学附属第六人民医院消化内科,上海 200233;2.上海健康医学院附属第六人民医院东院消化内科,上海 201306)
小肠菌群对宿主生理的各个方面包括免疫、代谢和内分泌功能有着深远的影响[1],负责从饮食中吸收90%的能量供应身体机能,特别是回肠末端包含着最大的淋巴结组织,包括内脏相关淋巴组织和Peyer's patches,这些组织对维持微生物平衡调节免疫稳态至关重要[2]。然而,有关人小肠菌群的信息有限,其特点是其相对较低的密度(102~107个/g),腔内小肠液流动和分泌部分肠道内杀菌物质[3]。此外,因为解剖学的特点,小肠部位的微生物样本收集很具挑战性,对小肠分布的菌群情况所知甚少。近年来,小肠微生物群的组成与健康和胃肠疾病的关系日益受到重视,本研究通过对胃肠镜获得的样本进行基于16S rRNA 的健康人群球部和末端回肠黏膜菌群多样性分析,为小肠功能及疾病的治疗提供一定的信息。
1 资料与方法
1.1 一般资料
选择上海健康医学院附属第六人民医院东院消化内镜中心行胃肠镜检查的患者作为研究对象。患者年龄为 21~50 岁,平均(32±0.2)岁;BMI 为 20 ~24 kg/m2。男女不限,比例相当,其中男27 例,女 26例,两组间研究对象一般资料差异无统计学意义(P>0.05)。所有入选对象均被告知并签署知情同意书。胃镜检查留取十二指肠球部黏膜正常的组织;肠镜检查留取末端回肠黏膜正常的组织。球炎及末端回肠炎患者纳入对象:内镜下消化道黏膜有充血红肿、糜烂表现,病理组织学诊断提示黏膜组织慢性炎症。疾病史:既往体健。药物史:近 1 个月未使用以下药物:抗生素;微生态制剂;抑制胃酸分泌药物;免疫抑制剂等;激素类;其它影响胃内菌群的药物。
1.2 方法
1.2.1 标本收集 对于符合标准的对象,使用无菌活检钳钳取2 块,使用一次性无菌注射器针头使标本从活检钳转移至无菌冻存管内,做好标记。-80 ℃冰箱保存。通过Excel 表格整理总结研究对象的一般资料,包括人口信息学、内镜结果、病理结果等。
1.2.2 微生物总DNA 提取 1 个月内,样本集齐后,使用干冰将样品寄送至送上海派森诺公司进行16SDNA 测序。
1.2.3 PCR 扩增细菌16SDNA 基因功能基因的不同区域 在该实验中,选用了细菌16S rRNA 基因的高度可变的V4 区用来测序,其长度约为250 bp。PCR 扩增选用细菌16S rDNA V4 区特异性引物,520F(5′⁃barcode +AYTGGGYDTAAAGNG⁃3′),802R(5′⁃TACNVGGGTATCTAATCC⁃3′)。前引物中的barcode 用来区分同一文库中的不同样品。PCR 运用NEB Q5 DNA 高保真聚合酶,对扩增结果进行2%琼脂糖凝胶电泳,并切取目的片段,然后使用Axygen 凝胶回收试剂盒回收目的片段。
1.2.4 PCR产物定量、混样利用Quant⁃iT PicoGreen dsDNA Assay Kit 对 PCR 物在 Microplate reader(BioTek 公司,FLx800)上进行定量,然后计算每个样品所需数量进行配比。
1.2.5 文库构建 该过程是利用 Illumina 公司的TruSeq Nano DNA LT Library Prep Kit 进行建库。
1.2.6 文库质检与测序 (1) 文库质检与定量。取1 μL文库,在 Agilent Bioanalyzer 机器上用 Agilent High Sensitivity DNA Kit 对文库做 2100 质检。利用Quant⁃iT PicoGreen dsDNA Assay Kit 在 Promega QuantiFluor 上对文库进行定量,合格的文库计算后浓度应在 2 nmol/L 以上。(2) 测序。对合格的文库,在MiSeq 机器上利用 MiSeq Reagent Kit V3(600cycles)进行2×300 bp 的双端测序。上述文库量的多少可根据实际情况控制为15~18 pmol/L。
1.3 分析方法
1.3.1 原始测序数据的筛选及质量控制 使用FASTQ 格式对测序原始数据保存。对通过质量初筛的双端序列使用FLASH 软件根据重叠碱基进一步配对连接。最后,根据每个样本对应的Index 信息,获得每个样本的有效序列。
1.3.2 可操作分类单元分析(OTU)划分和分类鉴定 通过OTU 对原始数据进行质控后,用QIIME软件,按97%的序列相似度进行归并和OTU 划分,并选取每个OTU 中具有最高丰度的序列作为OTU的代表序列。各样本(组)共有OUT 的数量运用R软件计算统计,各样本(组)所共有和独有的OUT所占的比例通过Venn 图直观地呈现出来。
1.3.3 α 多样性分析 获得OUT 丰度矩阵之后,可以通过分析体现群落丰富度Chao1 指数和ACE指数,以及体现群落均匀度的 Shannon 指数和Simpson 指数,计算每个样本群落的多样性,即Alpha 多样性。其中,Chao1 或 ACE 指数越大,即群落的丰富度越高。Shannon 或 Simpson 指数值越高,即群落多样性越高。
1.3.4 分类学组成分析 采用QIIME 软件,获得每个样品在在门和属分类水平上的组成和丰度分布表,并通过柱状图呈现分析结果。
1.3.5 组间分类学组成的差异分析 根据每个样本在各分类学水平的组成和序列分布,对两个或多个样本间的丰度差异进行比较,并用统计检验评价是否具有显著性差异。使用Mothur 软件和Metastats 的统计学算法,对门和属水平的各个分类单元在样本间的绝对丰度的差异进行统计学分析比较。
2 结 果
2.1 OUT聚类
以97%相似度的标准聚类,得到3 224 个OUT,其中球部与末端回肠标本独有的的数目分别为595、566,2 种标本共有的 OUT 数目为 2 063 个,见图1。
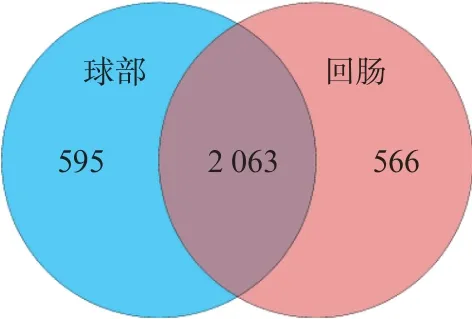
图1 Venn 图Fig.1 Venn diagram
2.2 肠道黏膜菌群α多样性分析
使用QIME 软件,OTU 丰度矩阵中每个样本的序列总数在不同深度下随机抽样,并绘制绘制稀疏曲线。横坐标表示每个样本中随机抽取的序列的总数;纵坐标表示在相应深度下观测到的OTU 数。曲线的长短反映了样本测序的数量,曲线越长,测序深度越高,观测到更高多样性的可能性更大。曲线的平缓反映了测序深度对于样品多样性的影响,曲线越平缓,说明测序结果已能足够反映当前样本所包含的多样性,继续增加测序深度已无法检测到的尚未发现的大量新OTU,α 多样性分析各指数值见表1,稀疏曲线图见图2,本实验结果表明测序结果已足够反映当前样本所包含的多样性。
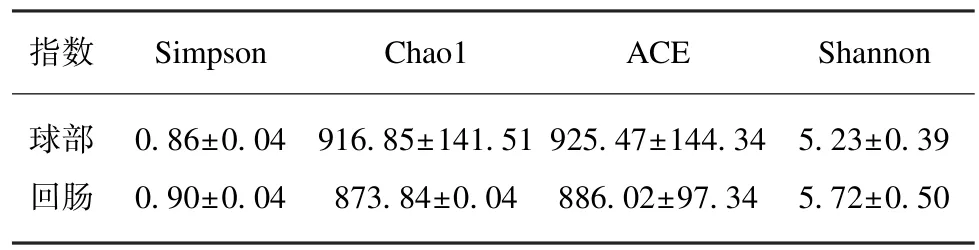
表1 球部和末端回肠黏膜菌群α 多样性Tab.1 Alpha diversity statistical analysis of the intestinal microbiome
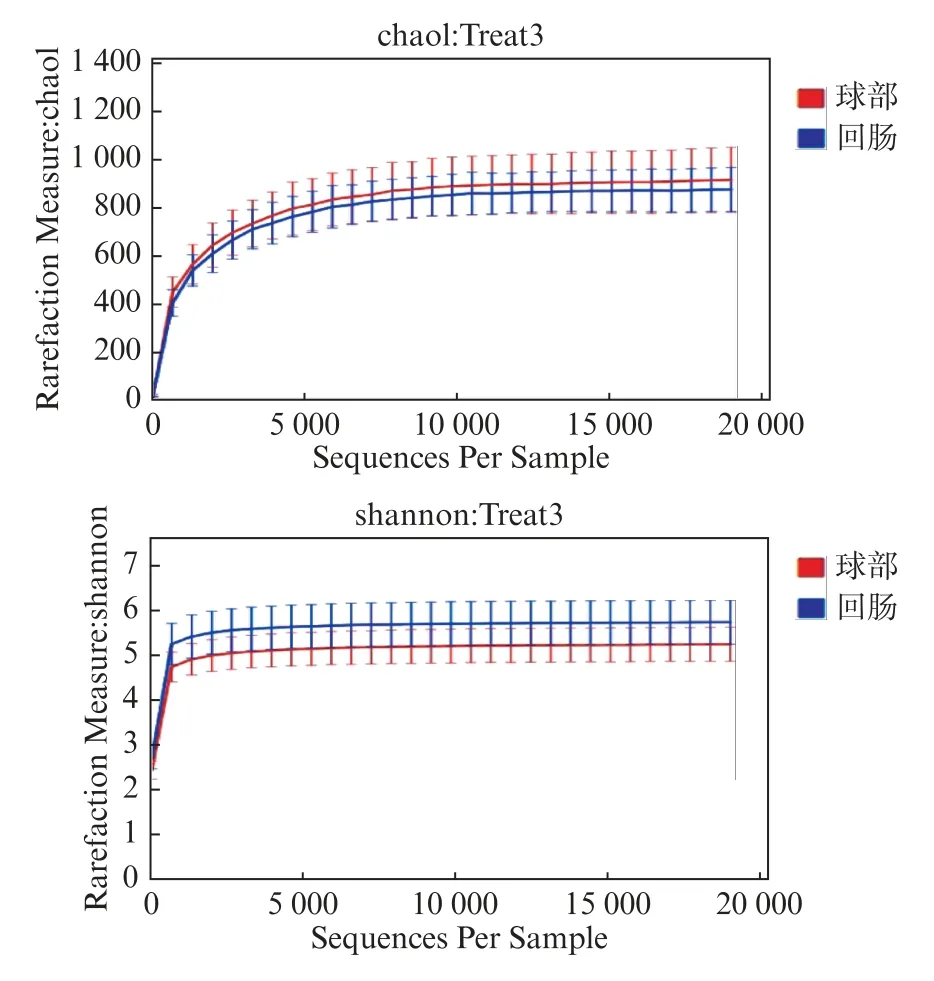
图2 α 多样性分析稀疏曲线图Fig.2 Rarefaction curves of alpha diversity statistical analysis
2.3 球部黏膜黏膜菌群结构
对所有OTU 进行物种归类,球部黏膜菌群测得个28 个门,397 个属。末端回肠黏膜测得25 个门,344 个属。两个部位在门水平上均以梭杆菌门、变形菌门、厚壁菌门、拟杆菌门、放线菌门(Fusobacteria,Proteobacteria,Firmicutes,Bacteroidetes,Actinoba⁃cteria)为主要菌群,但所占比例不同,球部优势菌群所占比例依次为 49.43%、25.93%、8.68%、5.19%、5.76%;末端回肠优势菌群所占比例依次为38.30%、29.61%、17.56%、8.15%、3.70%。属水平球部黏膜以鲸甘菌属、气单胞菌属、贪铜菌属、不动杆菌属、梭菌属 (Cetobacterium,Aeromonadaceae,Cupriavidus,Acinetobacter,Clostridium)为主要菌群,所占比例依次为 49.38%、6.42%、5.62%、4.78%、3.84%;末端回肠黏膜以鲸甘菌属、贪铜菌属、气单胞菌属、拟杆菌属、不动杆菌属(Cetobacterium,Cupriavidus,Aero⁃monadaceae,Bacteroides,Acinetobacter) 为主要菌群,所占比例依次为 37.56、12.83%、4.2%、3.84%、2.74%(表2~3)。所有检测样本在门(图3)和属(图4)水平以柱状图表示。
2.4 两组间分类组成的差异分析
运用Metastats 的统计学方法对门和属水平的各个分类单元在两组之间的序列量差异进行两两比较。在门和属水平各发现有显著差异的分类单元个数各为18、101 个。在门水平和属水平最有显著差异的前20 个分类单元间(图5 ~6)。以小提琴图结合箱线图的形式表达出来:小提琴图可以直观地显示数据的分布特征,其中,“小提琴”的宽度越宽,表明该序列量下对应的样本越多;箱线图边框表示四分位数间距(IQR),水平线代表中位值,上下触须分别代表1.5 倍IQR 范围,符号“•”表示超过范围的极端值。
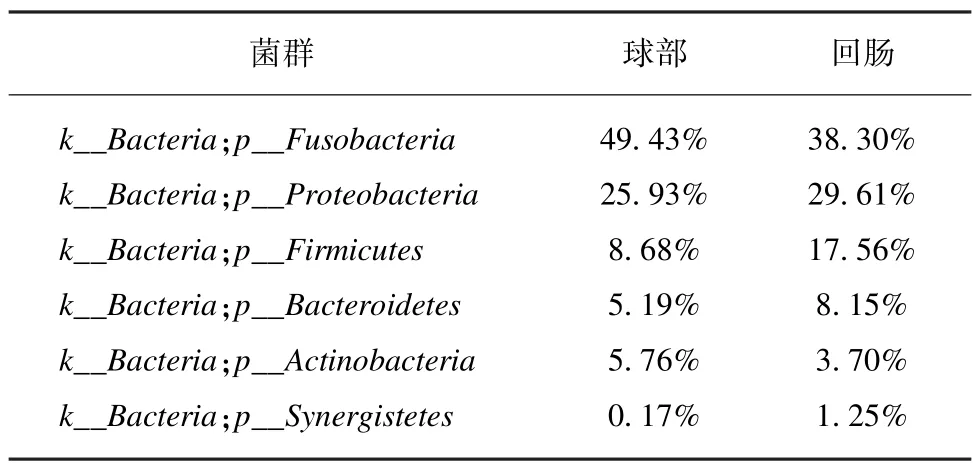
表2 球部和末端回肠黏膜优势菌群在门水平上的分布(>1%)Tab.2 The abundance of known bacterial species at the phylum level (>1%)
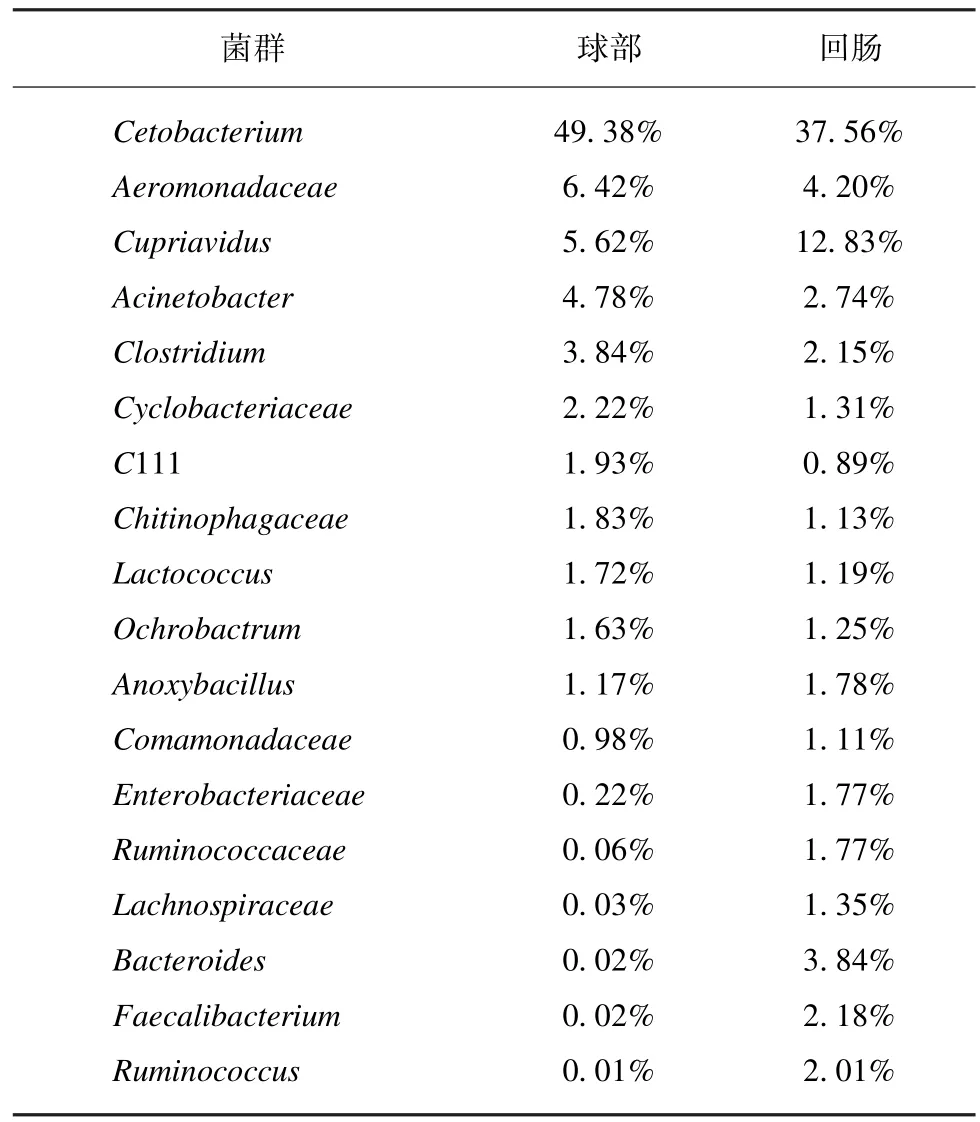
表3 球部和末端回肠黏膜优势菌群在属水平上的分布(>1%)Tab.3 The abundance of known bacterial species at the genus level (>1%)
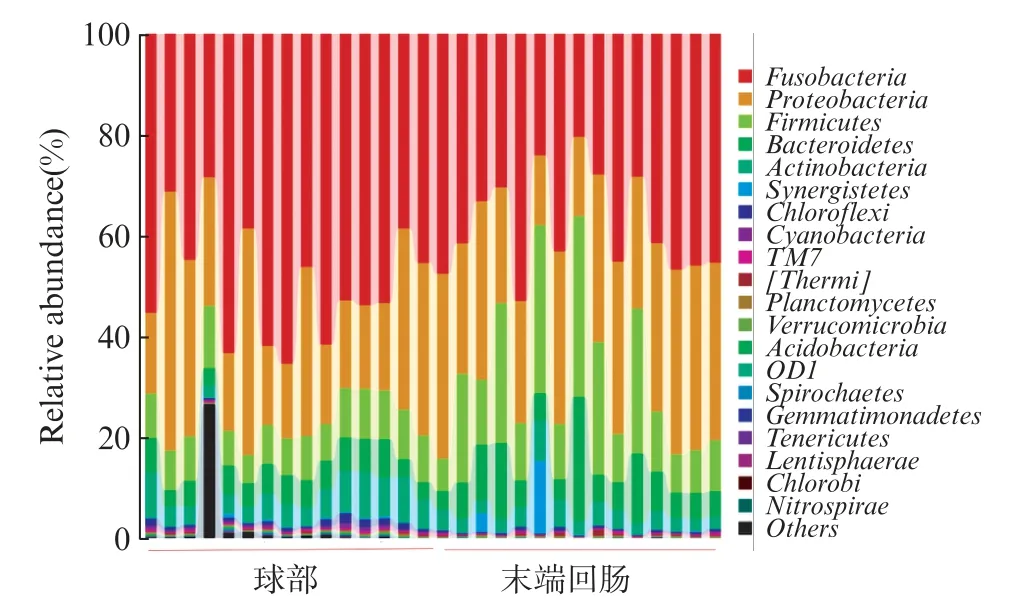
图3 两组间门水平菌群组成柱状图Fig.3 Bar graph showing the phylum level compositions of the bacterial communities

图4 两组间门水平菌群组成柱状图Fig.4 Bar graph showing the genus level compositions of the bacterial communities
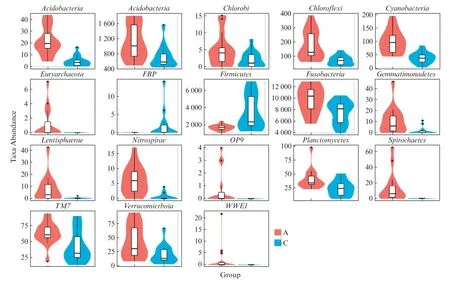
图5 两组间差异最显著的前20 个分类单元的丰度分布图(门水平)Fig.5 The abundance distributions of the top 20 taxa with the most significant differences between the two groups were visualized with violin plots(phylum level)

图6 两组间差异最显著的前20 个分类单元的丰度分布图(属水平)Fig.6 The abundance distributions of the top 20 taxa with the most significant differences between the two groups were visualized with violin plots(genus level)
2.5 球部正常黏膜与炎症状态菌群组成差异
进一步检测了8 对球部正常黏膜与炎症状态下黏膜菌群,结果显示:在门水平上,正常黏膜以Fusoba⁃cteria和Proteobacteria为优势菌群,所占比例分别为58.4%,16.1%;在炎症状态下,两种优势菌群的比例依次为43.7%,34.2%。两组间差异有统计学意义(P<0.05)。在属水平上,正常黏膜以Cetobacterium,Aeromona⁃daceae,Clostridium(比例分别为 58.4%、8.5%、4.8%)为主,炎症状态黏膜以Cetobacterium,Cupriavidus,Helicobacter(比例分别为43.6%、13.1%、4.5%)为主(表4)。

表4 球部正常黏膜和炎症状态下菌群门水平的分布情况(>1%)Tab.4 The abundance of known bacterial spicies at the phylum level in the normal and inflammation state of duodenal bulb(>1%)
2.6 末端回肠正常黏膜与炎症状态菌群组成差异
进一步检测了15 对末端回肠正常黏膜与炎症状态下黏膜菌群,结果显示:在门水平上,正常黏膜以Fusobacteria和Proteobacteria为优势菌群,所占比例分别为38.3%、29.61%;在炎症状态下,两种优势菌群的比例依次为36.86%、40.04%。但两组差异没有统计学意义(P>0.05)。在属水平上,正常黏膜以Cetobacterium,Cupriavidus,Enterobacteriaceae(分别为37.56%、12.83%、4.2%)为主,炎症状态黏膜仍以Cetobacterium,Cupriavidus,Faecalibacterium(分别为36.38%、16.53%、6.01%)为主(表5)。
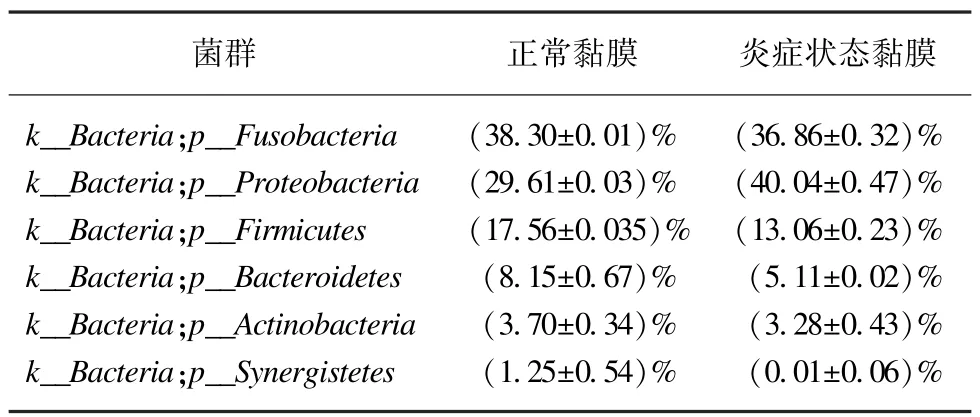
表5 末端回肠正常黏膜和炎症状态下菌群门水平的分布情况(>1%)Tab.5 The abundance of known bacterial spicies at the phylum level in the normal and inflammation state of terminal ileum(>1%)
3 讨 论
活检样本是目前人类研究黏膜菌群的金标准,小肠菌群的研究仍有较多的局限性,尤其是在选择有代表性的人体标本和应用可靠的分析方法方面。一些研究发现,在较高的分类学水平上,黏膜微生物成分沿肠道趋向于更稳定[4⁃5]。虽然粪便菌群是结肠黏膜菌群的代表,但活体组织检查是研究小肠黏膜菌群的最佳方法,内镜活检标本、抽吸标本、黏膜刷标本、十二指肠上段和回肠远端手术标本均可用于菌群分析[6]。
在肠道稳态情况下,本研究在门和属的水平上鉴定出了球部和回肠末端的菌群组成及多样性。从结果可以看出,小肠十二指肠球部和回肠末端在门水平上以Fusobacteria,Proteobacteria,Firmicutes,Bacteroidetes,Actinobacteria为主要菌群,这与先前肠道菌群研究结果相一致[7⁃8]。说明肠道菌群中优势菌群的组成基本一致。但是两个部位不同优势菌群所占比例不同,在门和属水平对比中,两组间最具显著差异包括18 个门和101 个属,说明在正常状态下,不同部位的肠道黏膜菌群组成是有差异的。提示着肠道不同部位在免疫、代谢、能量吸收等方面发挥不同功能,具体功能的探讨需要进一步深入研究。此外,不同个体同一部位肠道菌群的组成和多样性也存在一定的差异性。
在临床上,小肠非特异性炎症的发病率较高,具体病因与发病机制不十分明确。不同部位的黏膜炎症状态下,其黏膜的菌群可能存在一定的变化,因此进一步对不同部位黏膜炎症状态的菌群测序,对于探讨不同部位小肠非特异性炎症的病因、发病机制以及指导不同益生菌制剂的治疗或微生物的移植治疗等方面,具有有一定的临床意义和临床治疗指导价值。在黏膜炎症状态下,尤其是球炎中,菌群组成比例存在一定改变,其中一个明显的差异是机会致病菌Proteobacteria的丰度增加,Firmicutes和Bacteroides菌门比例下降,此外,炎症患者中乳酸菌群比例也有下降,这与之前炎症性肠病(inflammatory bowel diseases,IBD)中的研究一致发现,Proteobacteria属于革兰阴性菌,包含多种致病菌属,提示了肠道菌群的失调参与了炎症性肠病的发生发展[9⁃10];同时也提示了在临床上,有针对性的补充相应的益生菌制剂或微生物移植等可能对十二指肠球部炎症有一定的治疗价值。但是末端回肠炎没有显示出显著的菌群差异,仅存在部分菌群的轻微改变,提示部分菌群的改变参与肠炎的发生;有针对性的补充相应的益生菌制剂或微生物移植等可能对末端回肠炎症也具有一定的治疗指导价值。当然,由于实验的局限,这部分的结果可能还受到以下方面的影响。一方面,肠镜前需要服用泻药清肠,这个过程对肠道菌群必然存在一定影响,下一步的研究方案需要开发精确的取样器械,以求解决采样时可能出现的误差;另一方面,本课题纳入样本量较少,还需要进一步扩大样本量来验证等。
已知所研究的菌群中,Actinobacteria 中所含的菌属能够参与发酵碳水化合物并产生甲酸、乳酸盐等,并与体重指数呈负相关[11];Firmicutes中所含菌属能清除肠道中的气体,因其能将肠道中的气体转化成乙酸[12]。Bacteroidetes是一种厌氧且对胆汁耐受的革兰阴性菌,对促进相关淋巴组织和免疫前抗体的形成具有重要意义[13];研究表明,肠道Bacteroidetes可以通过调节多种宿主基因的表达,包括参与营养吸收、强化黏膜屏障和血管生成因子的表达,直接调节肠道功能[14⁃15]。在关于乳头状甲状腺癌术后功能减低的患者肠道细菌变化的研究中显示Bacterodietes出现显著性下降[16]。另外有研究显示Bacteroidetes中的某些特定的种属对预防Clostridium difficile感染起着重要作用[17]。因此Bacteroidetes平衡对肠道稳态至关重要。Actinobacteria中的Acinetobacter包含一组严格需氧的物种,如A.baumannii,与医院感染有关[18]。
截至目前,小肠功能及小肠肠道菌群研究尚少,但重视小肠肠道菌群与疾病相关性研究,且开发能够准确反映肠道环境的具有代表性的微创微生物采养工具是非常必要的。探索正常黏膜状态的菌群组成,对于炎症和其他疾病状态如IBD,肿瘤等微生物变化可能提供参考疗法,如益生菌疗法、关注饮食、微生物移植等。
