腹腔镜下袖状胃切除术治疗不同血脂水平肥胖患者的疗效研究
2020-05-13李贵芳张君宜梅芳芸高晶扬黄玥晔程晓芸
李贵芳,张君宜,梅芳芸,高晶扬,黄玥晔,程晓芸,曲 伸
(同济大学附属第十人民医院内分泌代谢病科,国家标准化代谢性疾病管理中心(十院),上海 200072)
肥胖是当今世界面临的一个重大公共卫生问题[1]。代谢综合征(metabolic syndrome,MS)是心血管疾病和糖尿病的一组危险因素,包括腹型肥胖、高血压、高三酰甘油血症、空腹血糖受损和高密度脂蛋白降低[2]。代谢性手术是目前国际上认可的能长期而有效的控制体重及改善代谢方法之一。在几种减重手术术式中,腹腔镜下袖状胃切除术(laparoscopic sleeve gastrectomy,LSG)是目前最常用的术式之一[3⁃6]。肥胖存在异质性,其中代谢正常型肥胖(metabolically healthy obese,MHO)和不健康肥胖症(metabolically unhealthy obesity,MUHO)正日益引起人们的关注。相比于MS,MHO 具有更低的死亡率及心血管疾病发生率[7]。三酰甘油(triglyce⁃rides,TG)是MS 的重要组分之一,也是代谢异常与非酒精性脂肪肝和腹型肥胖的临床特征之一。关于TG 作为减重手术效果预测指标的研究较少。本研究将肥胖患者分为TG 正常组与TG 异常组,旨在研究不同脂质水平患者的术后代谢指标改善情况,观察血脂水平差异对代谢指标的影响。
1 资料与方法
1.1 研究对象
纳入标准:BMI ≥35 kg/m2的肥胖者,接受LSG,术后6 个月定期随访。排除标准:患有严重的心肺功能异常,精神疾病患者。2012年12月—2019年4月,同济大学附属第十人民医院收治的105 例(男性50 例,女性55 例)肥胖患者符合上述标准纳入研究,全组患者年龄 12 ~66 岁,平均(31.58±11.31)岁。本研究已经在中国临床试验中心注册(ChiCTR⁃OCS⁃12002381)。
1.2 检测指标
1.2.1 人体测量学指标检测 由经过培训的专业医师测量所有受试者的身高、体重、颈围(NC)、腰围(WC)、臀围(HC),并计算 BMI 及腰臀比(WHR)。
1.2.2 生化指标检测 所有受试者隔夜禁食8 ~10 h,于清晨空腹抽取静脉血,分别测定门冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)、空腹血糖(FPG)、空腹胰岛素(FINS)、空腹 C 肽(FCP)、餐后 2 h 血糖(2hPG)、糖化血红蛋白(HbA1c)、总胆固醇(TC)、三酰甘油(TG)、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)、游离脂肪酸(FFA)、肌酐(Cr)、血尿素氮(BUN),其中血糖由葡萄糖氧化酶法(罗氏公司)测定,血清胰岛素采用放射免疫法检测,HbA1c 采用高压液相方法检测,血脂和血尿酸(uric acid,UA)用酶法(罗氏公司)测定。C 反应蛋白(CRP)、血沉(ESR)、IL⁃6、IL⁃8 和 TNF 用化学发光法(西门子公司)测定。肝酶及肾功能采用全自动生化检测仪检测。采用稳态模式评估法计算胰岛素敏感性指数(HOMA⁃IR)=FINS(U/L)×FPG(mmol/L)/22.5。血清游离 T3(FT3),血清游离 T4(FT4),促甲状腺激素(TSH)等甲状腺功能相关指标用放射免疫法测定。本研究中各项生化指标参考范围:TG <1.7 mmol/L,HDL 为1.04~1.55 mmol/L,FPG 为3.9~6.1 mmol/L,TSH 为0.38~4.34 mIU/L。
1.2.3 分组标准 分别根据基线TG、HDL、TSH 及血糖水平进行四种类型的分组,TG<1.7 mmol/L 为TG 正常组,TG≥1.7 mmol/L 为 TG 异常组;HDL≥1.04 mmol/L为 HDL 正常组,HDL<1.04 mmol/L为 HDL 异常组;TSH<2.5 mIU/mL 为 TSH 正常组,TSH≥2.5 mIU/mL 为 TSH 异常组;按照糖尿病诊断标准[8],分为血糖正常组(NDM)与糖代谢异常组(DM,包括空腹血糖受损、葡萄糖耐量减退和糖尿病)。
1.3 统计学方法
采用SPSS 22.0 统计学软件。符合正态分布和方差齐性的计量资料以±s表示,计数资料以例数表示。术前基线数据及手术前后相关指标的比较采用配对样本t检验。在TG 正常组与TG 异常组中,使用偏相关分析排除年龄及性别影响后,分析手术前后WC 变化值(ΔWC)、HC 变化值(ΔHC)与相关代谢指标变化的相关性(变化值以Δ 表示)。相关性分析中的相关变量纳入多元线性回归模型进行分析独立相关因素,并以年龄和性别作为校正因素。所有检验均以双侧P<0.05 认为差异有统计学意义。
2 结 果
2.1 临床资料比较
TG 正常组与TG 异常组相比,术前TG 正常组BMI、HC 水平比 TG 异常组的较高,TG 异常组患者的年龄要高于正常组,其余人体测量学指标在两组间并无统计学差异。与基线相比,术后6 个月两组BMI、NC、WC、HC、WHR、收缩压、舒张压均下降(P<0.01),见表1。
表1 肥胖患者手术前后的人体测量学的比较及按三酰甘油水平分组后手术前后变化Tab.1 The clinical characteristics of obese patients and the changes between different serum levels of TG groups(±s)
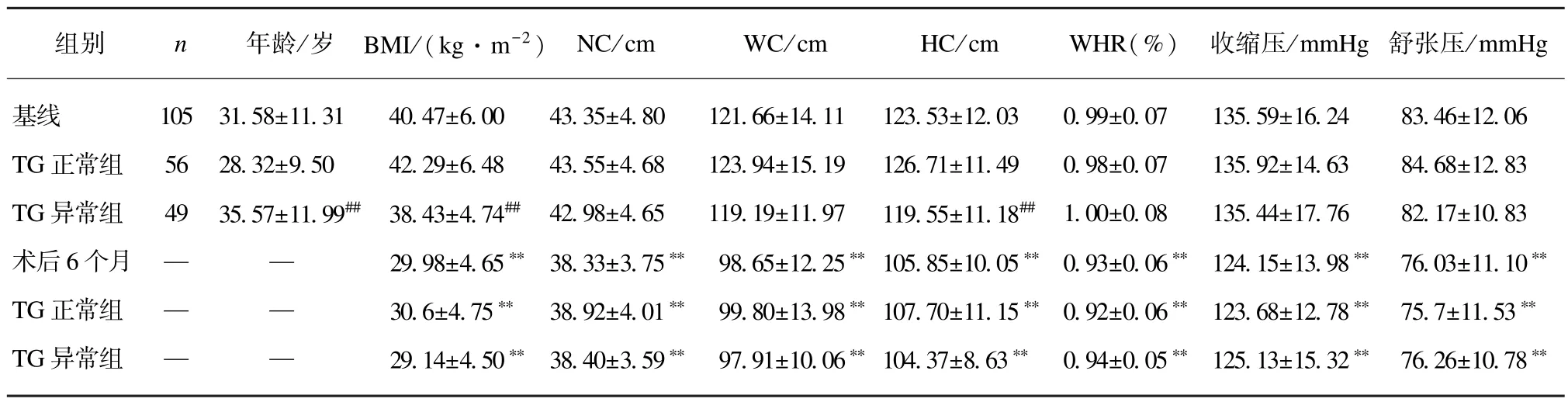
表1 肥胖患者手术前后的人体测量学的比较及按三酰甘油水平分组后手术前后变化Tab.1 The clinical characteristics of obese patients and the changes between different serum levels of TG groups(±s)
术后 6 个月与基线相比,∗P<0.05;术后 6 个月与基线相比,∗∗P<0.01 与 TG 正常组相比,#P<0.05;与 TG 正常组相比,##P<0.01;1 mmHg=0.133 kPa
组别 n年龄/岁 BMI/(kg·m-2) NC/cm WC/cm HC/cm WHR(%) 收缩压/mmHg 舒张压/mmHg基线 105 31.58±11.31 40.47±6.00 43.35±4.80 121.66±14.11 123.53±12.03 0.99±0.07 135.59±16.24 83.46±12.06 TG 正常组 56 28.32±9.50 42.29±6.48 43.55±4.68 123.94±15.19 126.71±11.49 0.98±0.07 135.92±14.63 84.68±12.83 TG 异常组 49 35.57±11.99## 38.43±4.74## 42.98±4.65 119.19±11.97 119.55±11.18## 1.00±0.08 135.44±17.76 82.17±10.83术后6 个月 — — 29.98±4.65∗∗ 38.33±3.75∗∗ 98.65±12.25∗∗ 105.85±10.05∗∗ 0.93±0.06∗∗ 124.15±13.98∗∗ 76.03±11.10∗∗TG 正常组 — — 30.6±4.75∗∗ 38.92±4.01∗∗ 99.80±13.98∗∗ 107.70±11.15∗∗ 0.92±0.06∗∗ 123.68±12.78∗∗ 75.7±11.53∗∗TG 异常组 — — 29.14±4.50∗∗ 38.40±3.59∗∗ 97.91±10.06∗∗ 104.37±8.63∗∗ 0.94±0.05∗∗ 125.13±15.32∗∗ 76.26±10.78∗∗
2.2 同TG水平的肥胖患者代谢指标的比较
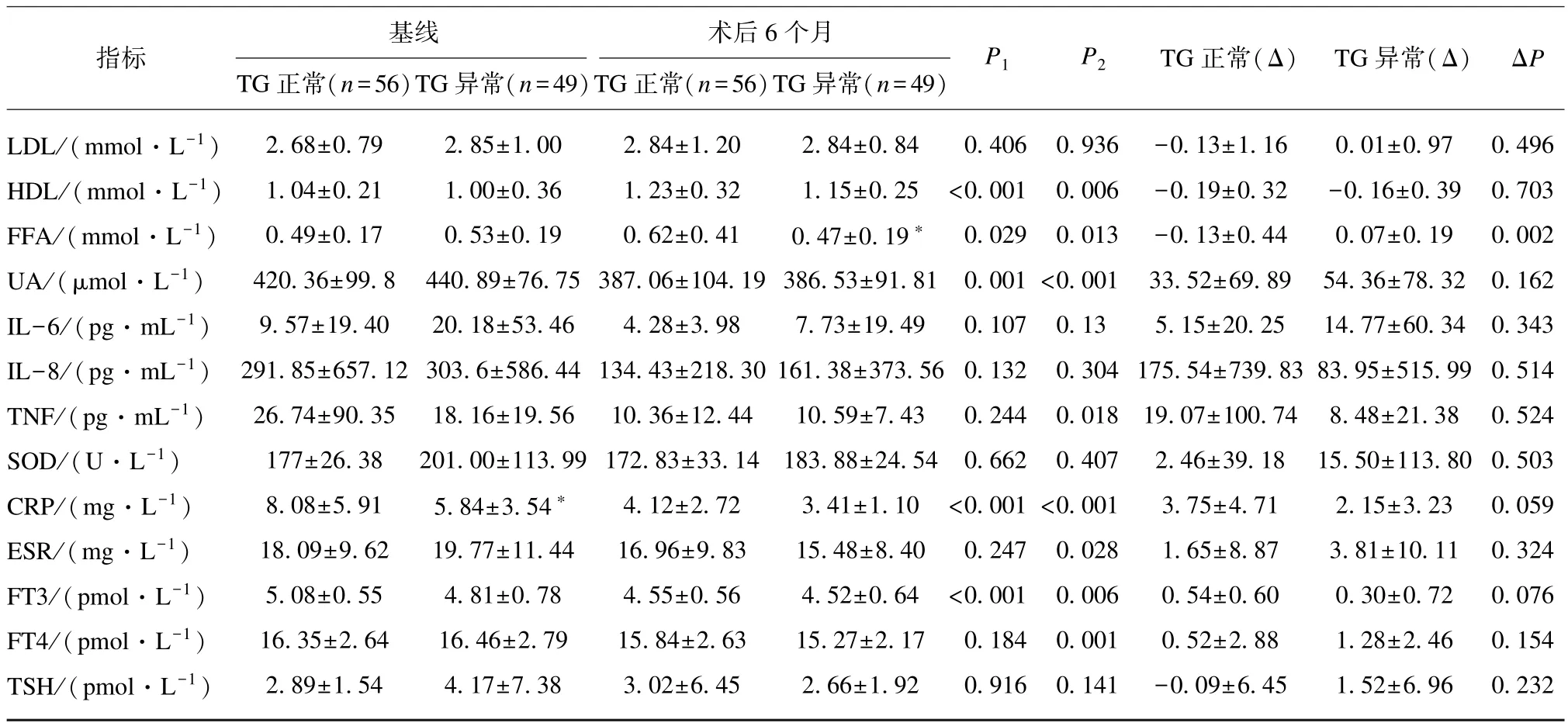
基线时,TG 正常组 FPG、2hPG、TC 低于 TG 异常组(P<0.01),两组间其余生化检测指标无统计学差异。术后6 个月,TG 正常组与TG 异常组之间在术前存在差异的指标FPG、2hPG 及TC 未发现差异(均P>0.05);术后 6 个月,TG 正常组 FFA 水平(P<0.05)比 TG 异常组高,而 TG 和 BUN 较低(P<0.01),见表2。
表2 不同三酰甘油水平组手术患者基线与术后6 个月各项生化指标比较Tab.2 Comparison of the biochemical Indicators of patients before and 6 months after surgery between different serum levels of TG groups (±s)

表2 不同三酰甘油水平组手术患者基线与术后6 个月各项生化指标比较Tab.2 Comparison of the biochemical Indicators of patients before and 6 months after surgery between different serum levels of TG groups (±s)
________术后6 个月__________________TG 正常(n=56)TG 异常(n=49)TG 正常(n=56)TG 异常(n=49)____________基线指标P1 P2 TG 正常(Δ) TG 异常(Δ) ΔP ALT/(U·L-1) 64.58±48.92 51.81±46.51 16.44±12.59 13.88±11.38 <0.001 <0.001 47.55±45.84 37.92±43.17 0.275 AST/(U·L-1) 37.91±26.25 35.45±29.53 19.92±19.17 16.20±8.42 <0.001 <0.001 17.42±26.40 19.25±24.4 0.715 rGT/(U·L-1) 45.99±32.72 56.72±40.33 16.39±9.02 20.13±18.27 <0.001 <0.001 30.7±27.55 36.9±31.22 0.323 Cr/(μmol·L-1) 60.68±9.71 66.51±20.61 62.97±10.28 65.75±15.31 0.074 0.544 -2.19±8.48 0.88±9.93 0.104 BUN/(μmol·L-1) 12.54±58.15 5.24±1.36 4.33±1.25 4.95±1.24∗ 0.31 0.427 8.52±59.38 0.15±1.26 0.319 FPG/(mmol·L-1) 5.75±1.43 7.07±2.79∗∗ 4.48±0.40 4.72±1.09 <0.001 <0.001 1.27±1.42 2.34±2.79 0.018 2hPG/(mmol·L-1) 8.97±3.63 11.87±5.08∗∗ 4.11±1.30 4.79±2.81 <0.001 <0.001 4.68±3.29 7.16±4.84 0.005 FINS/(mU·L-1) 33.53±22.73 37.38±30.34 10.79±6.51 10.79±5.45 <0.001 <0.001 22.61±20.32 26.61±28.47 0.42 FCP/(ng·ml-1) 4.65±2.23 5.30±2.89 2.63±1.72 2.63±0.77 <0.001 <0.001 2.00±2.58 2.68±2.79 0.205 HOMA⁃IR 8.93±7.23 11.49±10.93 2.13±1.37 2.35±1.56 <0.001 <0.001 6.81±6.75 9.14±10.78 0.194 HbA1c(%) 6.25±1.20 6.97±2.28 5.26±0.35 5.35±0.61 <0.001 <0.001 0.92±0.94 1.63±2.20 0.052 TC/(mmol·L-1) 4.25±0.96 4.93±1.04∗∗ 4.38±0.75 4.54±0.87 0.344 0.01 -0.11±0.86 0.39±1.03 0.008 TG/(mmol·L-1) 1.21±0.27 3.19±2.95∗∗ 0.81±0.22 1.37±1.19∗∗ <0.001 <0.001 0.4±0.31 1.82±3.22 0.003
(续表2)
比较TG 正常组与TG 异常组代谢指标术后6个月的改善情况。结果显示,两组多项代谢指标(肝功能、血糖、血脂、HOMA⁃IR 及 HbA1c、UA、CRP等)均有明显改善(P<0.05)。同时,异常组的 ΔTG(P<0.05)、ΔTC(P<0.01)、ΔFFA(P<0.01)、ΔFPG(P<0.05)及 Δ2hPG(P<0.05)比 TG 正常组的下降更为显著,见表3。

表3 控制年龄和性别后TG 正常组中ΔWC 和ΔHC 的相关性分析Tab.3 The correlation between ΔWC and ΔHC with related indicators in normal TG group after controlling age and gender
2.3 不同水平TG组WC和HC改善情况的相关性分析
TG 正常组 ΔWC 与 ΔBMI(r=0.765,P<0.001)、ΔNC(r=0.394,P=0.021)、ΔCr(r=0.442,P=0.009) 存在正相关,与 ΔTC(r=-0.449,P=0.008)、ΔHDL(r=-0.354,P=0.040)、ΔLDL(r=-0.401,P=0.019)存在负相关,与其他代谢指标差值 ( ΔFPG、 Δ2hPG、 ΔFINS、 ΔFCP、 ΔHOMA⁃IR、ΔHbA1c、ΔBUN、ΔTG) 均不存在相关性(均P>0.05)。TG 正常组 ΔHC 与 ΔBMI(r=0.661,P<0.001)存在正相关,与其他代谢指标差值均不存在相关性(均P>0.05)。多因素线性回归分析显示,在 TG 正常组中,ΔBMI、ΔCr 与 ΔWC 成正相关(P<0.05),ΔTC 与 ΔWC 成负相关(P<0.05);ΔBMI 与ΔHC 成正相关(P<0.05),见表4。
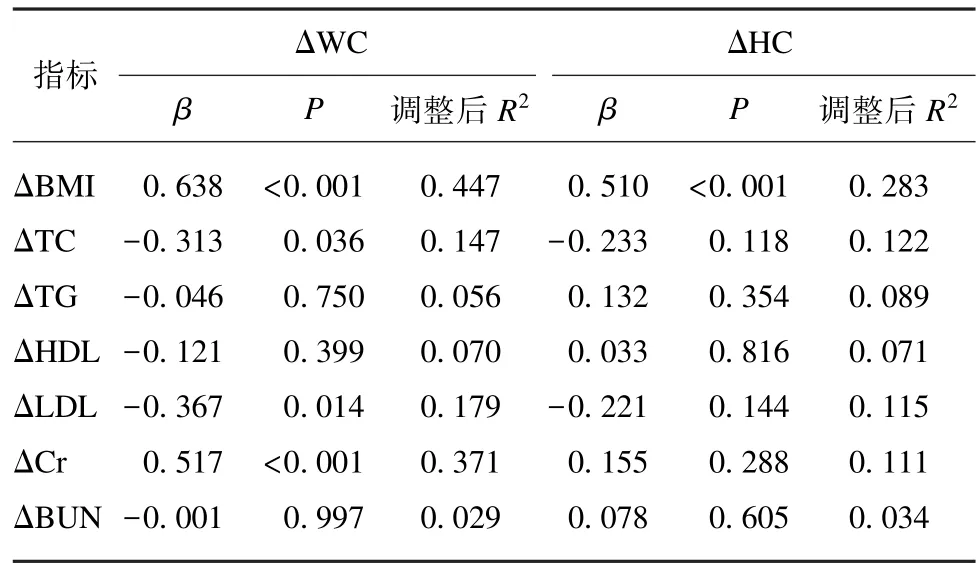
表4 调整年龄及性别后TG 正常组ΔWC 和ΔHC 的多元线性回归分析Tab.4 ΔWC and ΔHC related multivariate liner regression in normal TG group after adjusting age and gender
2.4 根据基线TG、HDL、TSH及血糖水平分
将手术患者分为正常组与异常组,比较四大类分组中正常组与异常组人体测量学指标于术后6 个月的改善情况。结果显示,TG 水平的分组中,正常组的 ΔBMI(P<0.001)、ΔWC(P<0.05)、ΔHC(P<0.01)与异常组相比,下降幅度更大;在HDL、TSH 及血糖分组中未发现两组的 ΔBMI、ΔWC 及 ΔHC 等指标有统计学差异(P>0.05),见图1。
表5 中显示,基线时,只有在TSH 分组中,正常组年龄(P<0.01)、WC(P<0.05)、HC(P<0.01)与异常组有统计学差异;其余两类分组(HDL、血糖)中,正常组与异常组的人体测量学指标(BMI、NC、WC、HC、WHR、收缩压、舒张压)均无统计学差异(均P>0.05)。

图1 在四个大类(按TG、血糖、HDL、TSH 水平分组)分组中减重效果的比较Fig.1 Comparison of weight loss effects in the four major categories(grouped by TG,blood glucose,HDL,and TSH levels)

表5 DM 组与NDM 组、HDL 正常组与HDL 异常组、TSH 正常组与TSH 异常组人体测量学的比较Tab.5 Comparison of anthropometrics indicators between DM group and NDM group,HDL normal group and HDL abnormal group,normal TSH group and abnormal TSH group
3 讨 论
MHO 和MUHO 是肥胖个体异质性的不同表型。然而,关于MHO 的确切定义尚无共识,这使得不同研究结果无可比性[9],且大多数研究将仅具有≤1 项MS 组分的患者归类为 MHO[10⁃11],这类定义值得质疑。TG 水平是肥胖患者代谢状态的重要指标,并且是 MS 诊断标准的重要组分[12⁃13]。本研究中,将基线TG 水平正常组看作代谢正常状态,TG 异常组为代谢相对异常状态,分析两组肥胖患者在接受LSG 后,代谢指标改善的差异。结果显示,术后6 个月,TG 正常组 BMI、WC、HC 比 TG 异常组改善得更显著。
腹型肥胖与代谢异常关系密切[14]。而评估腹型肥胖最常用的指标是WC,中国人群腹型肥胖的WC 切点为:男性≥90 cm、女性≥85 cm[15]。加拿大学者于2002年在心血管大会上作报告时提出了“高三酰甘油血症腰围表型”这一概念,他们认为在中年男性中,当 WC≥90 cm、TG≥2 mmol/L 时胰岛素抵抗的发生率明显升高[16],腹型肥胖同时伴有高水平TG 的危害显而易见。本研究显示,在基线时,与 TG 正常组相比,TG 异常组 FPG、2hPG、HOMA⁃IR 水平较高。这一结果也同样支持了腹型肥胖同时合并高水平TG 对机体糖代谢的影响。
目前减重手术能安全且有效控制体重的同时,更能改善肥胖患者体内血糖、血脂、甲状腺功能[17]等代谢紊乱情况[18⁃20]。本研究显示,在 LSG 术后 6个月,两组多项指标(BMI、NC、WC、HC、WHR、血压、肝功能、血糖、血脂、HOMA⁃IR 及 HbA1c、UA、CRP 等)均有显著改善。此外,TG 正常组的 ΔBMI、ΔWC、ΔHC 比 TG 异常组的改变得更显著,表明术后6 个月TG 正常的肥胖患者的减重效果比TG 异常患者更好。而将患者根据HDL,TSH 或血糖情况进行分组,正常组与异常组 ΔBMI、ΔWC、ΔHC 无显著差异。相关性分析显示,TG 正常组中 ΔWC 与ΔBMI 存在正相关,与 ΔTC 存在负相关。关于 TG 正常组患者术后BMI、WC 和HC 下降得更显著,可能原因是:高水平TG 对机体具有脂毒性,致使术前TG异常组的血糖、血脂、炎症因子等更加紊乱,因此接受LSG 后,机体要先改善和恢复原本就存的多种异常指标,再消耗多余脂肪组织;而正常组不存由高TG 引起的代谢紊乱,所以WC 的改善速度比异常组更快。本研究中,TG 异常组的 ΔTG、ΔTC、ΔFFA、ΔFPG 及Δ2hPG 比TG 正常组的下降更显著,在进行代谢性手术后异常组会获得更多血糖、血脂等方面的改善。即往研究很少通过基线代谢组分来预测减重手术的研究。而且他们的分组标准大多数是基于国家胆固醇教育计划(NCEP)成人治疗专家组 III(ATP III)对MS 的定义,将患者分为具有MHO 和MUO 代谢状态的两组[9],少数研究还纳入了 HOMA⁃IR 或慢性炎症标志物等组分[21⁃22]。Pelascini 等[10]的研究表明,代谢健康型病态肥胖(metabolically healthy morbidly obese,MHMO)患者术后24 个月仍比代谢不健康型病态肥胖(metabolically unhealthy morbidly obese,MUMO)患者有更好的代谢特征,随着时间的推移,MHMO 表型似乎是体重减轻更多的独立因素(多元回归,P=0.03)。此外,研究表明,MHO 患者减重手术后,可显著降低发生心血管疾病的风险[11,21],这对关于代谢相对正常的受试者不会从减重手术中获得更多益处的观点提出了质疑。与以往的研究不同,本研究是依据TG 水平作为唯一分组标准。但是以上研究和本研究的结论一致,代谢相对正常的患者行手术治疗,减重效果会更好。此外,Moreno⁃Castellanos 等[23]研究在低代谢风险或高代谢风险的病态肥胖妇女中腹部皮下脂肪组织对减重手术的反应机制时,发现影响减肥手术最终效果的是最初的代谢状态。所以,术前TG 水平对减重手术治疗效果具有重要的预测价值。
肥胖与慢性肾脏疾病发病率的增加有关[24⁃25],与肾小球滤过率的下降显著相关[26]。有研究显示,减肥手术可使T2DM 得到显著的持续性改善,同时也能改善或阻止肾病等微血管并发症的发生[27]。目前,肥胖的不同亚型发生肾功能损害的危险性及其机制尚不清楚。本研究结果显示,TG 正常组与TG 异常组的Cr 和BUN 在基线时是匹配的;虽然术后6 个月两组之间BUN 存在差异,但是两组Cr 无差异。而且两组之间的ΔCr 和ΔBUN 也不存在统计学差异。值得注意的是,TG 正常组的ΔWC 与ΔCr 存在正相关,线性回归分析显示在TG 正常组中随着Cr 的改善,WC 也随之缩小。推测在TG 正常的患者体内Cr 和WC 存在着某种联系,即随着肾功能的改善,WC 也随着缩小。有研究显示超重或肥胖患者肾周脂肪组织的棕色化功能减弱,同时伴有脂肪因子的表达改变[28]。由于肥胖患者在进行手术后体重下降,随着腹部脂肪的减少,肾脏周围的脂肪组织也随着减少,那么肾脏周围的内环境会发生改变,可能会影响肾脏的一系列分泌与调节的功能。导致Cr 产生这种变化趋势的具体机制有待进一步的探究。
TG 水平在肥胖患者的内分泌紊乱中扮演着重要的角色,高水平TG 的患者的糖脂代谢紊乱更严重,行LSG 后机体可能优先恢复和改善脂代谢、糖代谢、胰岛素抵抗等代谢异常状态,再进行后续的脂肪组织分解。TG 异常患者与TG 正常患者相比,不管是BMI、WC、HC,还是血糖、血脂的改善方面是不同的。术前TG 水平可作为预测LSG 短期内减重效果的指标之一。
