原位合成泡沫镍支撑的NiAl-LDH纳米片用于高效产氢反应
2020-05-13冯亮亮杜盈盈黄剑锋曹丽云
冯亮亮, 杜盈盈, 黄剑锋, 曹丽云
(陕西科技大学 材料科学与工程学院 陕西省无机材料绿色制备与功能化重点实验室, 陕西 西安 710021)
0 引言
随着全球化石燃料的快速消耗和环境污染的不断加剧,清洁且可持续能源的开发与储存俨然成为21世纪的一大挑战[1-3].应运而生的电催化分解水制氢技术是解决全球能源短缺和环境污染问题的一个突破口,因为它具有高的转换效率和环保特性,其产物氢气作为一种清洁和高能量密度的新能源,成为了开发绿色和可再生能源的首选.因此,电解水制氢被认为是一种极具前景的产生可再生氢燃料的技术之一.为了在阴极上有效地进行产氢反应(HER)并加速氢气的产生,研究者们已经进行了大量研究工作[4-6].目前,贵金属Pt基材料被公认为是电催化产氢最有效的催化剂,但其成本高和储量低的缺点极大地限制了该类催化剂的大规模应用[7,8].因此,开发廉价、地壳储量丰富、高效的非贵金属电催化剂已经成为该研究领域的热点.在过去的几年中,人们通过不懈的努力开发了一些先进的电催化产氢材料,比如,过渡金属氧化物/氢氧化物[9,10],硫族化物[11,12],磷化物[13,14]和碳化物[15]等.
在以上这些活性电催化材料中,层状双金属氢氧化物(LDH)被认为是最有潜力的电催化材料之一.其中,Ni基LDH是一类由Ni元素与另外一种或两种以上金属元素组成的层状双金属氢氧化物,结构由主层板和层间的阴离子及水分子相互交叠构成.由于其较大的比表面积,层状结构中金属元素的可调性,层间阴离子可交换性以及氧化还原态多样性特点,因而被广泛应用于电催化水分解研究[16].
据知,这类催化剂往往在碱性条件下具有优异的电催化性能,而在中性介质(pH=7)中的产氢应用却很少被报道.因此,开发高效的Ni基LDH电催化剂应用于中性介质产氢反应是非常具有科学意义的.与Fe,Co和Ni相比,Al在地球上的储量更加丰富,且价格更加便宜.更重要的是,用+3价Al取代Ni(OH)2中的部分+2价Ni而生成NiAl-LDH,不仅可以优化Ni的电子结构,而且可以借助双金属间的协同作用极有可能进一步提升样品的性能.
在本工作中,通过简单的一步水热法在泡沫镍上原位生成了一种新颖的NiAl-LDH纳米片,该电极命名为NiAl-LDH/NF.电催化测试表明,在中性条件下,最优化的NiAl-LDH/NF电极只需189 mV 的过电势就可获得10 mA/cm2的电流密度,并且可以稳定工作长达90 h.该研究证实了原位合成的NiAl-LDH/NF可以作为一种高效稳定的中性产氢电催化剂.
1 实验部分
1.1 原材料
泡沫镍(NF,面积为1×5 cm2,厚度为1.5 mm);六水合氯化铝(AlCl3·6H2O);尿素((NH2)2CO);铂碳电极(20 wt% Pt/C);乙醇.
1.2 样品的制备
(1)NiAl-LDH/NF:将0.48 g AlCl3·6H2O溶解在30 mL水中并用磁力搅拌10 min.然后,将0.18 g尿素添加到上述溶液中,继续搅拌10 min以获得前驱体溶液.随后将前驱体溶液和一块处理过的NF转移到50 mL水热釜中.密封水热釜,将其放入120 ℃烘箱中加热12 h,然后自然冷却至室温.最后,将NF从水热釜中取出,用水和乙醇分别各洗涤3次,样品标记为NiAl-LDH/NF.
(2)Ni(OH)2/NF:通过与NiAl-LDH/NF相同的合成步骤制备Ni(OH)2/NF电催化剂,只是在合成系统中不添加AlCl3·6H2O,合成的样品标记为Ni(OH)2/NF.
1.3 样品的表征
样品的物相与晶体结构由X射线衍射仪(Rigaku,D/max-2200 pc)及显微共焦拉曼光谱仪(Renishaw,Renishaw-invia)进行测定及分析.
样品的形貌利用场发射扫描电子显微镜(FESEM,Hitachi,S4800)进行分析.
样品的微观结构用透射电镜(TEM,JEM-3010)来表征.
样品的元素组成和价态用X射线光电子能谱仪(XPS,AXIS Supra)来分析.
1.4 电化学测试
所有电化学测试均在CHI 660E B17060电化学工作站(中国上海CH仪器公司)上通过三电极系统进行.在三电极系统中,NiAl-LDH/NF电极可直接用作工作电极(面积为~0.1 cm2、负载量为~3 mg/cm2),碳棒作为对电极,饱和甘汞电极(SCE)作为参比电极.线性扫描伏安曲线(LSV)的扫描速率设置为5 mV/s.中性溶液为pH=7的PBS缓冲溶液,碱性溶液为pH=14的KOH溶液.
为了进行比较,当用粉末电催化剂(20 wt% Pt/C)作为工作电极时,其制备过程如下:(1)将4 mg催化剂超声分散在100μl异丙醇中以形成均匀混合物;(2)将7.5μl上述溶液滴涂到工作面积为0.1 cm2的NF上;(3)将负载在NF上的催化剂在空气中干燥后,将2μL的0.3% Nafion异丙醇滴铸在NF上并干燥,以防止催化剂在电催化测试过程中掉落.
2 结果与讨论
2.1 样品的XRD与Raman分析
图1是Ni(OH)2/NF的XRD图谱.从图1中可以看到,Ni(OH)2/NF图谱在11.6 °、23.7 °、33.6 °和38.9 °处出现四个典型的衍射峰,分别对应于Ni( OH)2(PDF # 38-0715)的(001)、(002)、(110)和(103)晶面,由此可以说明本文制备的该样品为六方相的α-Ni(OH)2.

图1 Ni(OH)2/NF的XRD图谱
图2(a)是NiAl-LDH/NF的XRD图谱.由图2(a)可以看到,NiAl-LDH/NF的衍射峰除了较强的镍衍射峰之外(PDF#04-0850),没有其他的衍射峰出现,这种现象产生的原因是因为泡沫镍上较少的样品负载量及有较强的Ni峰.因此,进一步对该样品进行了拉曼表征.由图2(b)可以看出,在478 cm-1、546 cm-1和1 054 cm-1处出现了NiAl-LDH的拉曼特征散射峰.由此可以表明,在泡沫镍表面成功原位生成了NiAl-LDH.
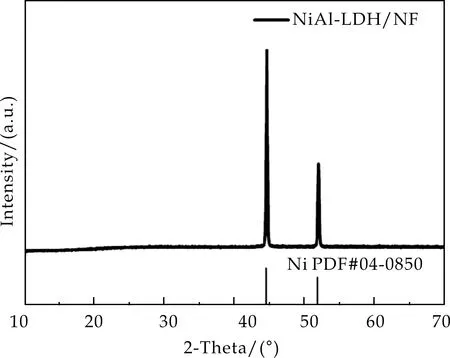
(a)XRD图谱
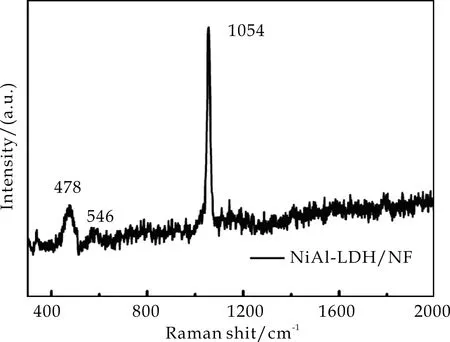
(b)Raman图谱图2 NiAl-LDH/NF的XRD图谱和Raman图谱
2.2 样品的形貌及微观结构
图3(a)是NiAl-LDH/NF的SEM图.由此图可以看出,NiAl-LDH/NF材料的微观形貌为纳米片,并且NF表面被NiAl-LDH/NF纳米片完全覆盖;此外,NiAl-LDH/NF的纳米片形貌也可以用TEM图(图3(b))来证明;在图3(c)中,两条晶面间距为0.255 nm和0.226 nm的晶格条纹分别与NiAl-LDH的(012)和(015)晶面对应,且NiAl-LDH/NF中纳米片存在部分非晶态结构;图3(d)是NiAl-LDH/NF的元素分布图.由此图可以看出,Ni、Al、O均匀的分布在纳米片的表面,由此也可以证明Ni、Al、O元素在NiAl-LDH/NF中的存在.
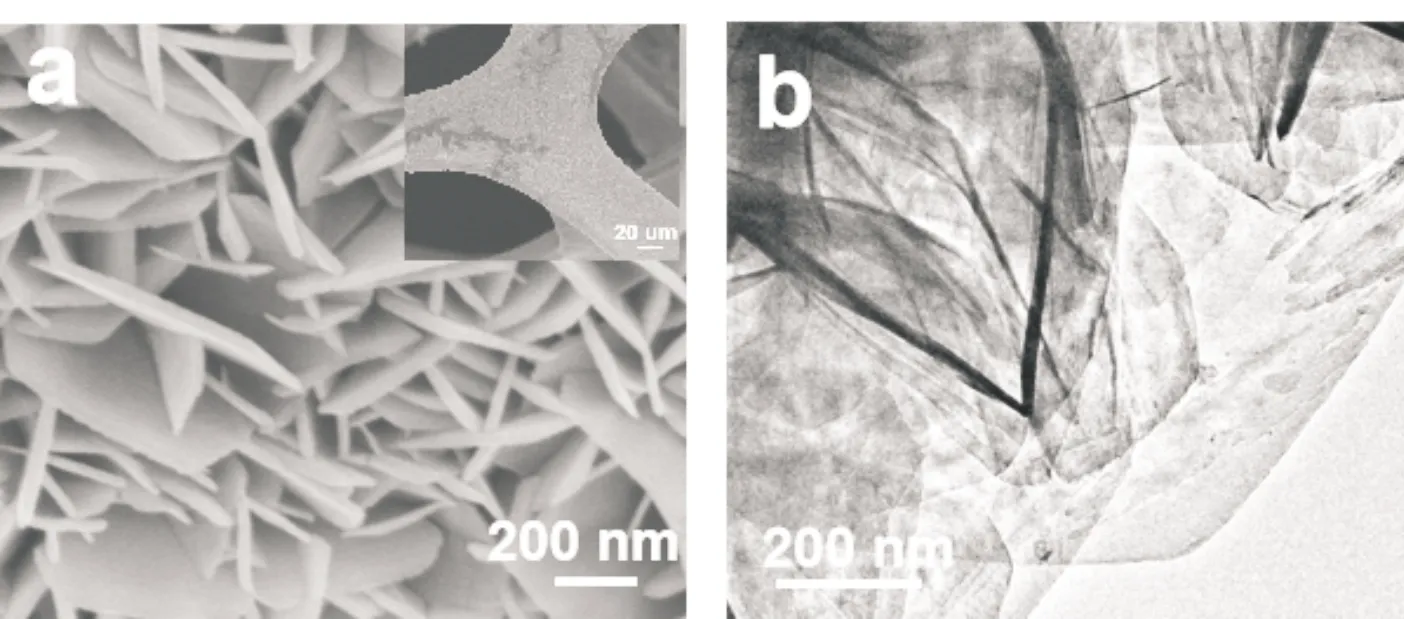
(a)SEM (b)TEM
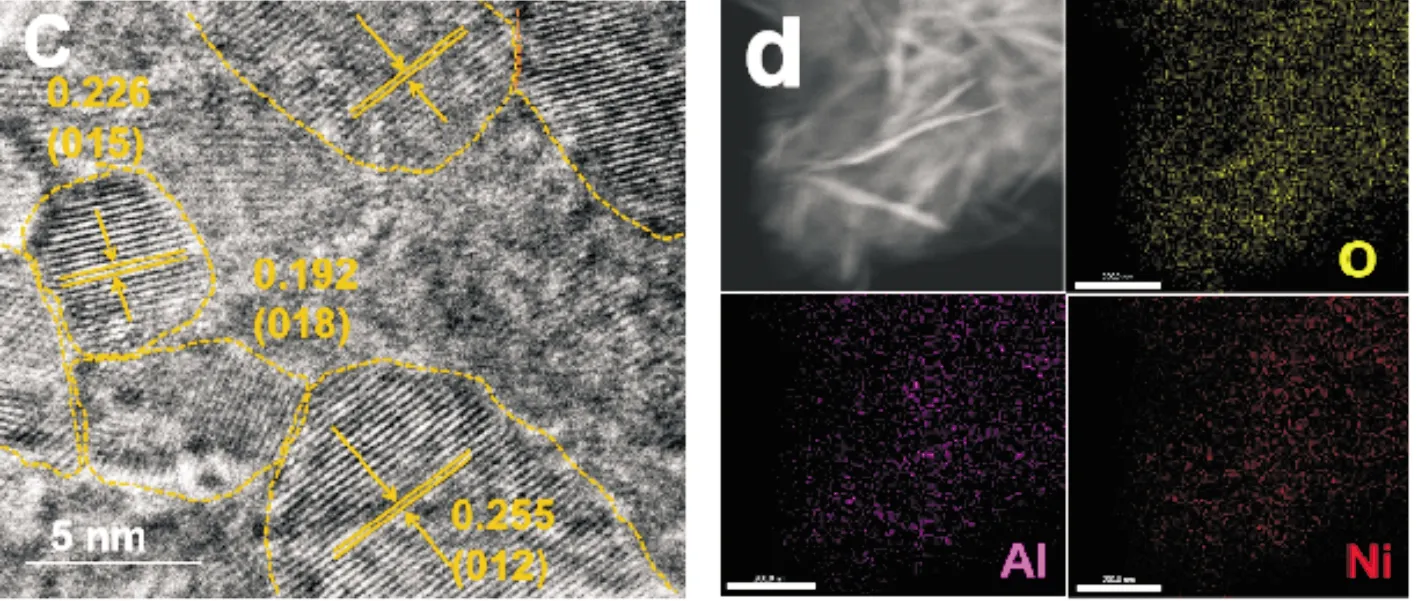
(c)HRTEM (d)Elemental mapping图3 NiAl-LDH/NF的微观形貌图
图4(a)是Ni(OH)2/NF的SEM图.由图可以看出,Ni(OH)2/NF的形貌与NiAl-LDH/NF相同,也是生长在NF上的纳米片;此外,Ni(OH)2/NF的纳米片形貌也可以用TEM图(图4(b)插图)来证明;图4(b)是Ni(OH)2/NF的TEM图,图中只能观察到一系列晶面间距为0.219 nm的晶格条纹,它对应于Ni(OH)2的(013)晶面,说明了Ni(OH)2的单晶特性.

(a)SEM (b)TEM图4 Ni(OH)2/NF的微观形貌图
因此,可以得出结论,与Ni(OH)2/NF相比,NiAl-LDH/NF的结晶性较低,存在的非晶区域可为其电催化产氢反应提供大量的催化活性位点.
为了研究Al源的加入量对NiAl-LDH/NF的形貌与电催化活性的影响,本文在不同的尿素/铝源摩尔比例下制备了三个对照样品(3∶0.5,3∶1,3∶3).通过SEM对样品进行了形貌表征,如图5所示.由图5可以看出,随着n(尿素)/n(铝源)比例的逐渐降低,即随着铝源的加入量逐渐增多,生长在NF上的NiAl-LDH纳米片密集度先增加后降低.当n(尿素)/n(铝源)为3∶2时,样品具有最高的纳米片密度;当n(尿素)/n(铝源)比例减少到3∶3时,纳米片基本粘连在一起,只能观察到少量的纳米片.

(a)3∶0.5 (b)3∶1
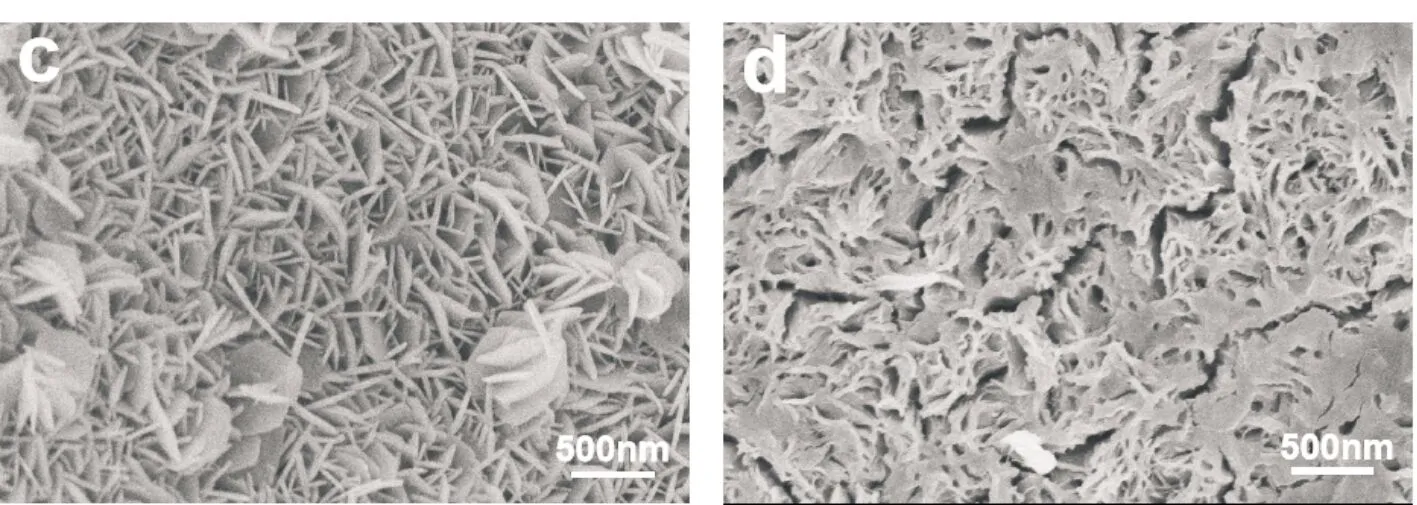
(c)3∶2 (d)3∶3图5 不同n(尿素)/n(铝源)条件下制备NiAl-LDH/NF的SEM照片
图6(a)、(b)是在中性和碱性条件下对不同比例的样品进行的电化学性能测试图.结果表明,无论是在碱性还是中性条件下,形貌最优的NiAl-LDH/NF(比例为3∶2时)具有最好的催化活性,这归功于纳米片密度最大的NiAl-LDH/NF可以暴露更多的产氢催化活性位点.
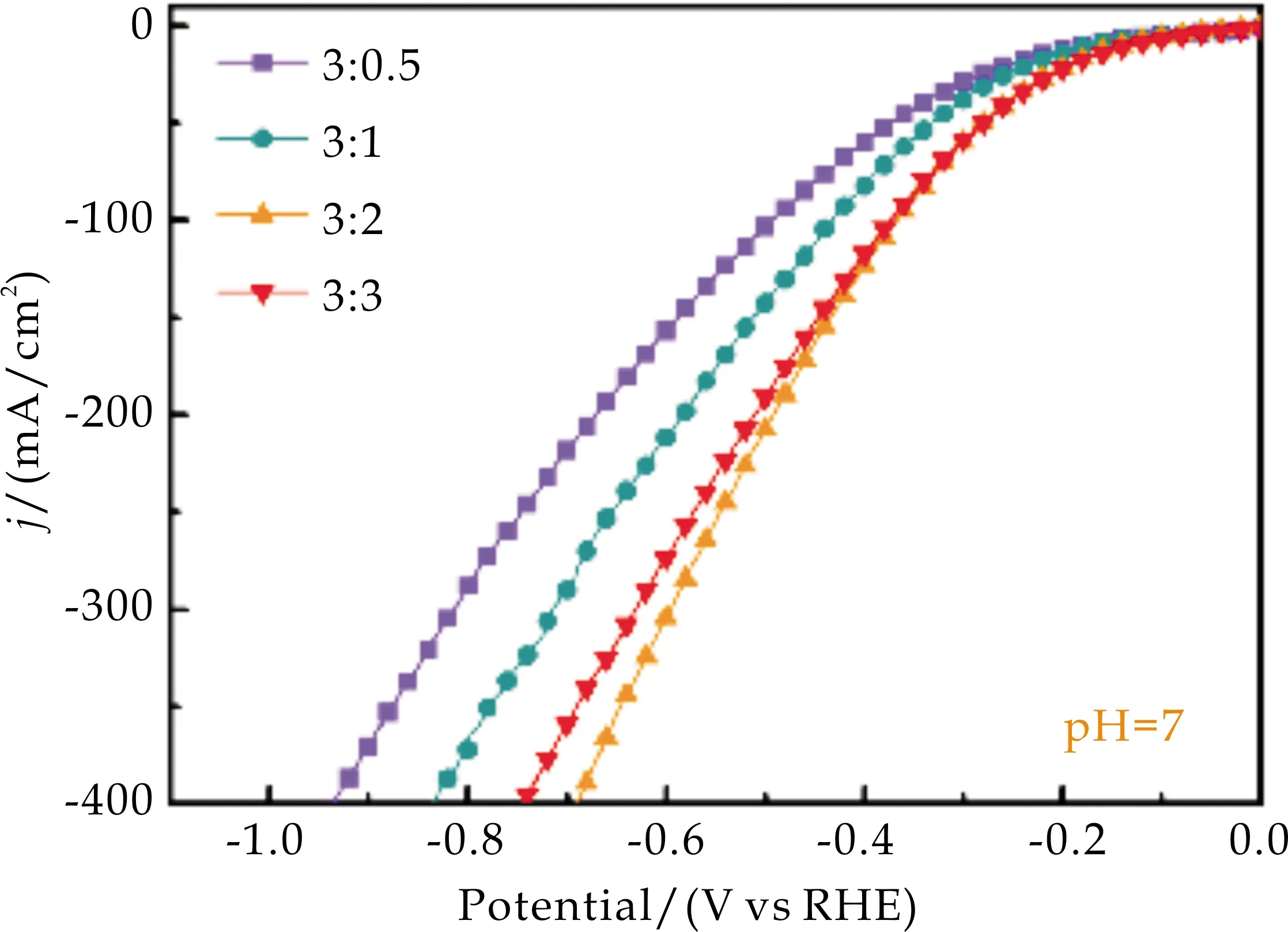
(a)中性LSV曲线
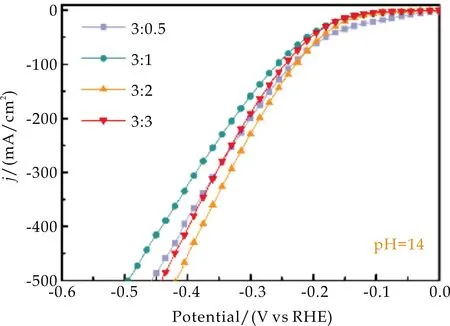
(b)碱性LSV曲线图6 不同n(尿素)/n(铝源)制备NiAl-LDH/NF的LSV曲线
2.3 样品的XPS分析
使用X射线光电子能谱(XPS),分析了样品的表面元素组成与化学态.图7(a)是NiAl-LDH/NF的XPS全谱图,由图可以看出,NiAl-LDH/NF样品中存在Ni、O和Al三种元素,值得强调的是,所有元素的光谱均根据标准的结合能为284.60 eV的C1s峰的XPS进行了校准.
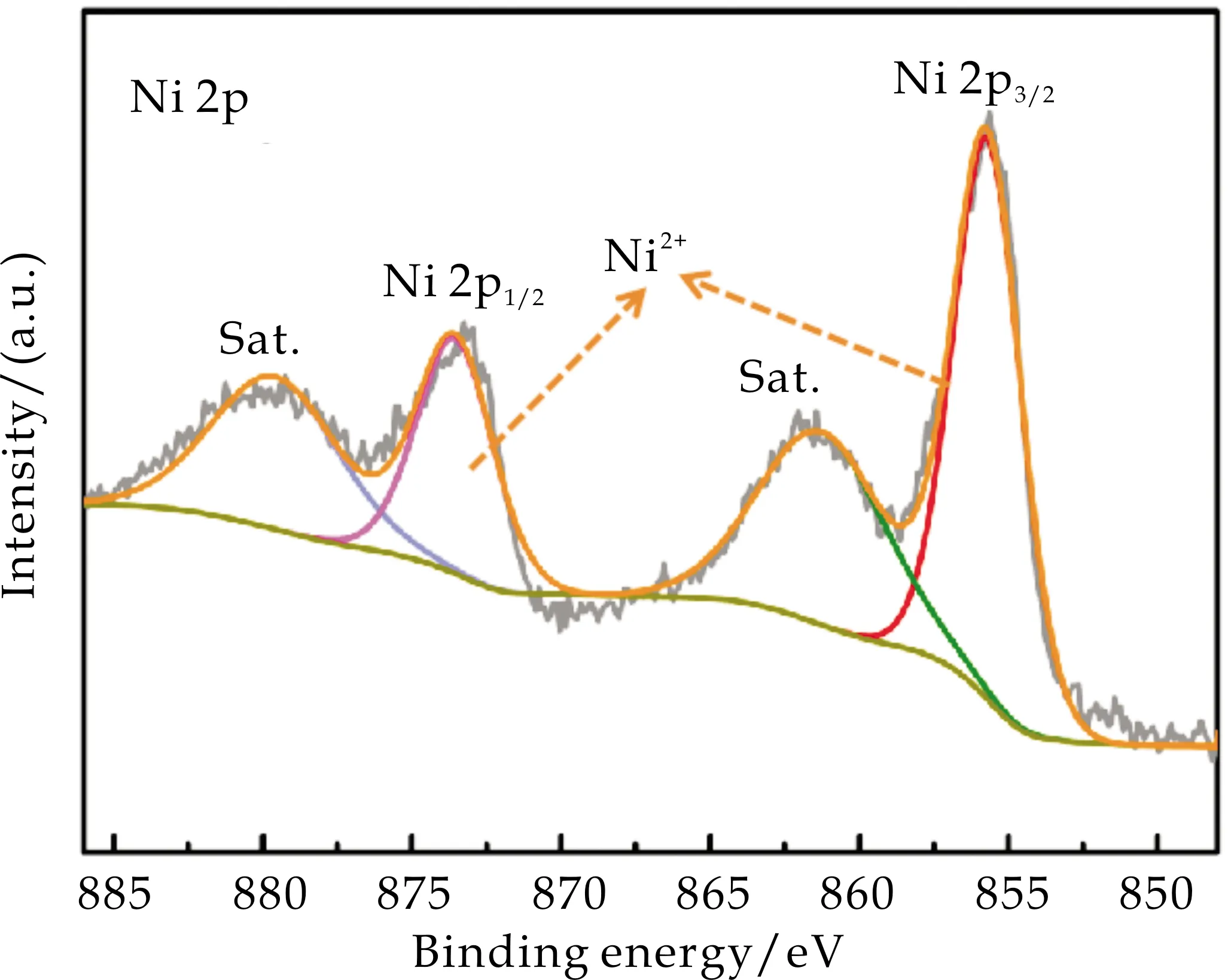
在图7(b)中NiAl-LDH/NF的Ni 2p高分辨率XPS光谱表明,在855.72 eV和873.56 eV结合能处的XPS信号分别对应于Ni2+的Ni 2p3/2和Ni 2p1/2的特征峰,而861.25 eV和879.58 eV处结合能的信号分别对应于Ni 2p3/2和Ni 2p1/2伴随的卫星峰[17].
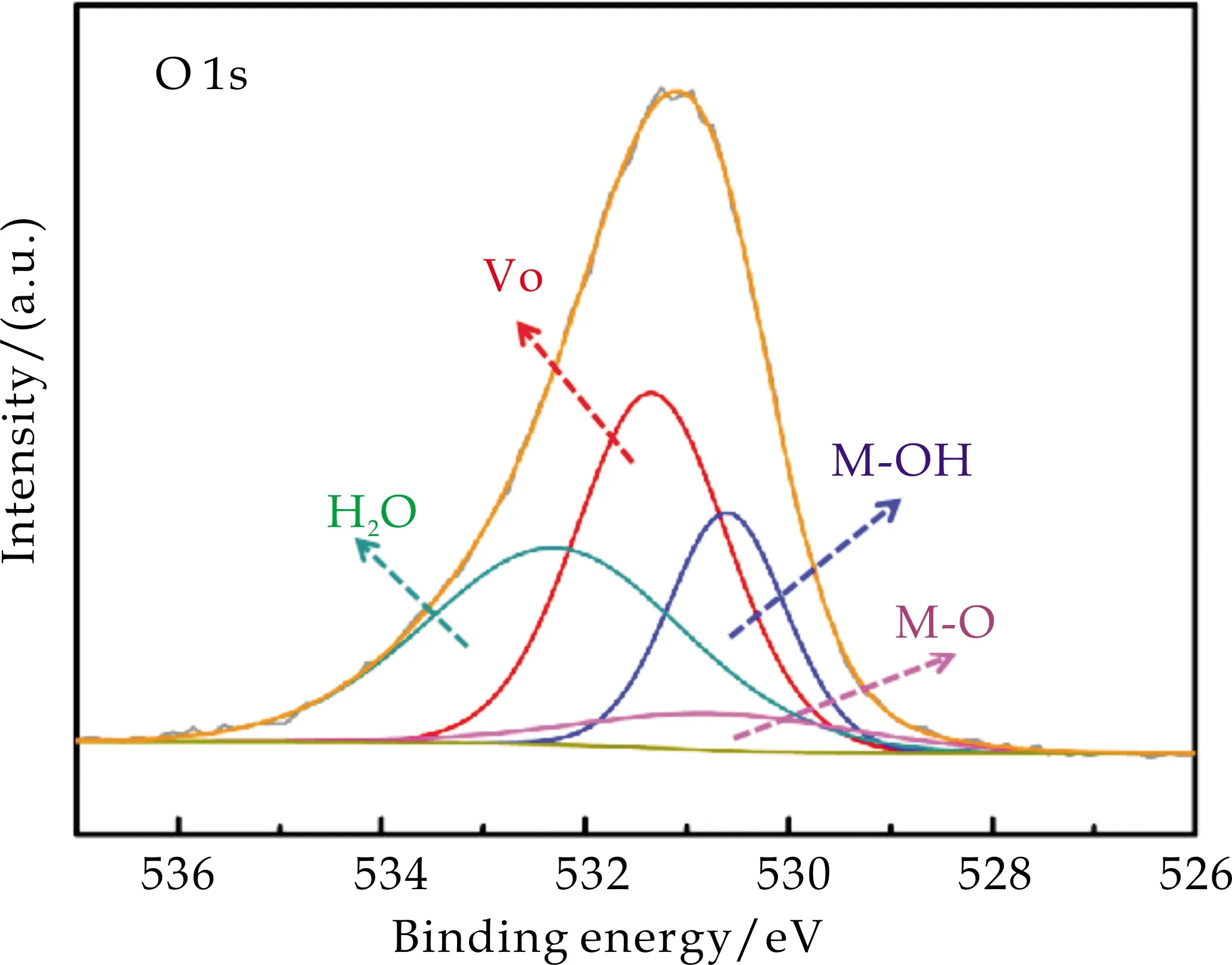
如图7(c)所示,NiAl-LDH/NF的O 1s XPS图谱可拟合为四个峰,结合能位于530.65 eV,531.25 eV,531.50 eV和532.02 eV的信号分别属于金属-氧(Ni-O/Al-O)键,氧空位(VO),金属羟基氧(Ni-OH/Al-OH)和吸附水中氧的特征峰[18].可以分析得出,氧空位(VO)的存在可以增加NiAl-LDH/NF的导电性,从而提高其电催化性能.
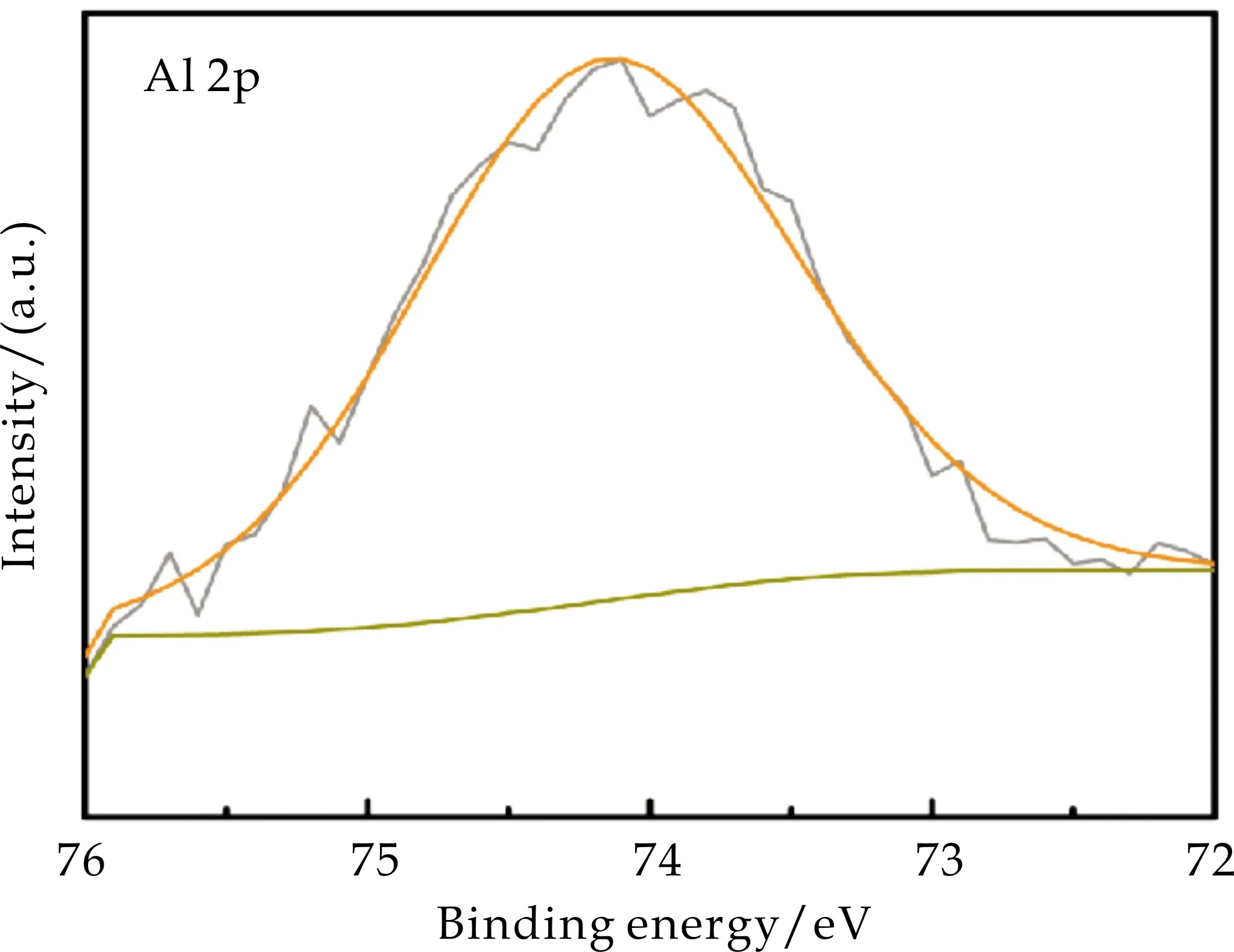
在Al 2p XPS光谱中,74.1 eV处结合能的响应信号可归因于NiAl-LDH/NF中Al3+的存在,如图7(d)所示.
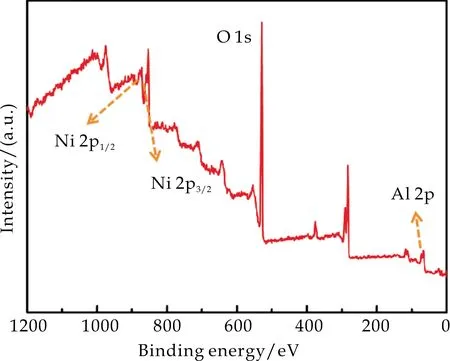
(a)XPS全谱
(b)Ni 2p XPS谱图
(c)O 1s XPS谱图
(d)Al 2p XPS谱图图7 NiAl-LDH/NF的XPS图谱
进一步地,本文研究了NiAl-LDH/NF表面对水的吸附能力.如图8(a)、(b)所示,接触角测试结果表明,与Ni(OH)2/NF相比,NiAl-LDH/NF具有很强的亲水性,这可以使其对OH-具有很好的吸附能力,进一步提升其的电催化性能.
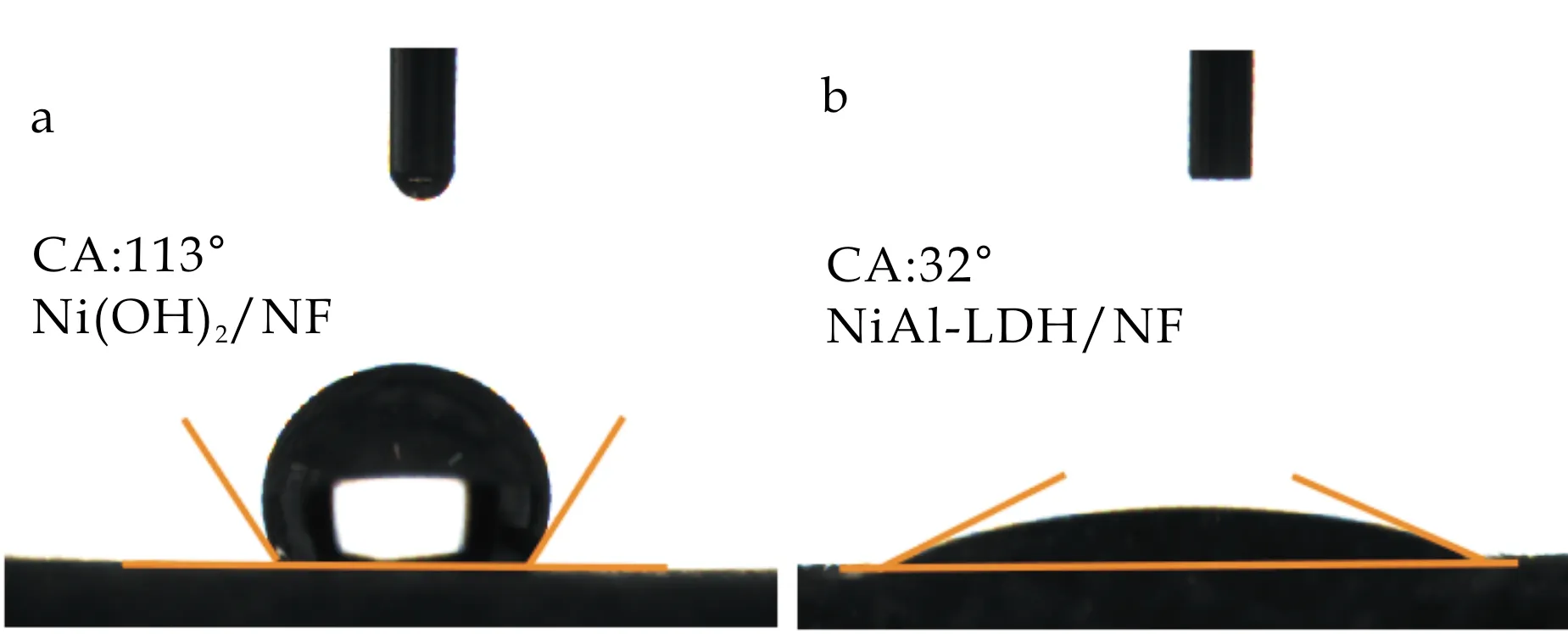
(a)Ni(OH)2/NF (b)NiAl-LDH/NF图8 NiAl-LDH/NF及Ni(OH)2/NF的吸附水测试图
2.4 样品的产氢性能分析
为了研究NiAl-LDH/NF在中性条件下的电催化性能,本文在中性条件下(pH=7)搭建了标准的三电极装置.NiAl-LDH/NF可以直接用作电催化测试的工作电极,为了进行比较,在相同的工作条件下测试了NF,Ni(OH)2/NF和20%Pt/C/NF的相应的催化性能.
如图9(a)所示,线性扫描伏安曲线显示,在中性条件下,NiAl-LDH/NF在10 mA/cm2和90 mA/cm2时的过电势分别为189 mV和304 mV,远低于Ni(OH)2/NF(250 mV和420 mV)和NF(285 mV和482 mV).当电流密度逐渐增大时,NiAl-LDH/NF纳米片电极在高电流密度下展示出优异的HER催化活性,甚至即将超过NF负载的20%Pt/C.
图9(b)显示出这些电极在中性条件下的Tafel斜率曲线.结果表明,NiAl-LDH/NF的Tafel斜率(65 mV/dec)远远小于Ni(OH)2/NF(260 mV/dec)和NF(277 mV/dec),这意味着在NiAl-LDH/NF中性条件下有较快的电催化反应动力学.
此外,在pH=14的KOH溶液中也进行了电催化性能表征,如图9(c)所示.在碱性条件下,NiAl-LDH/NF在10 mA/cm2和100 mA/cm2时的过电势分别为140 mV和218 mV,远低于Ni(OH)2/NF(220 mV和355 mV)和NF(250 mV和410 mV).
在图9(d)中,这些电极在碱性条件下的Tafel曲线显示,NiAl-LDH/NF的Tafel斜率(63 mV/dec)比Ni(OH)2/NF(126 mV/dec)和NF(125 mV/dec)小,这意味着在碱性介质中NiAl-LDH/NF有较快的电化学反应动力学.根据tafel斜率值(63 mV/dec),可以判断出Volmer步为NiAl-LDH/NF在碱性条件下的HER决速步.
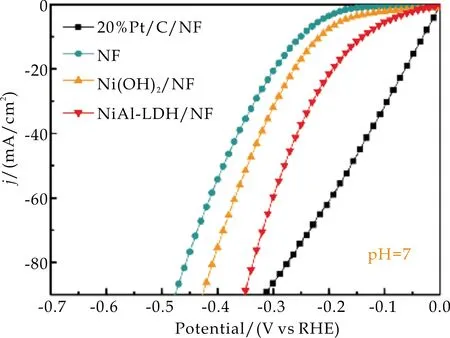
(a)中性LSV曲线
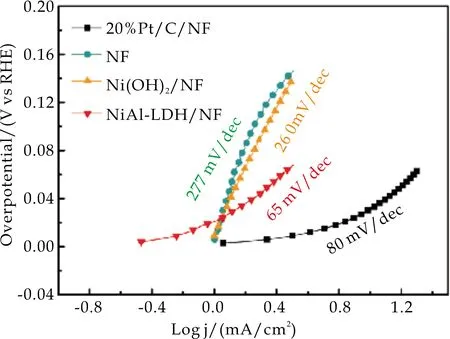
(b)中性Tafel曲线
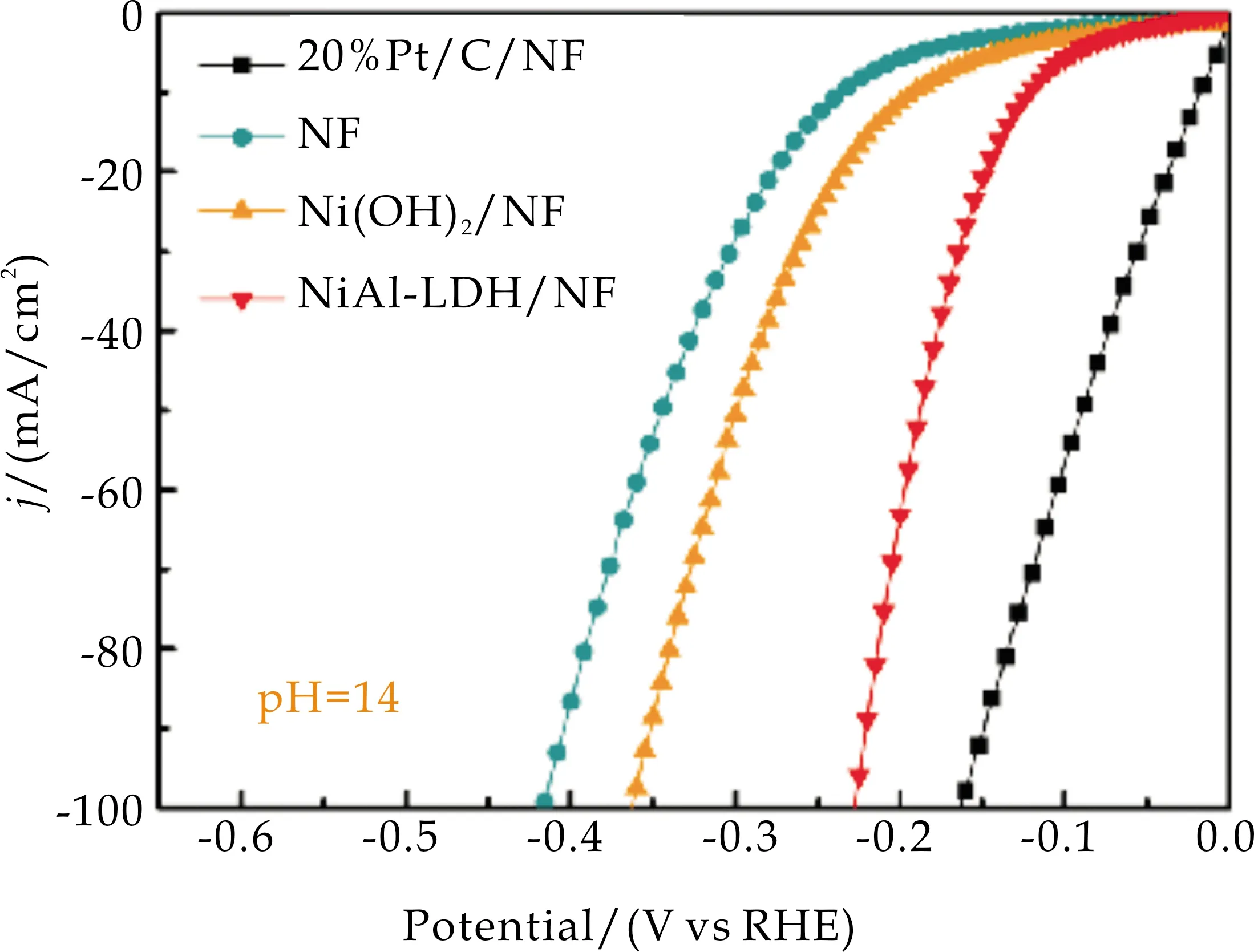
(c)碱性LSV曲线
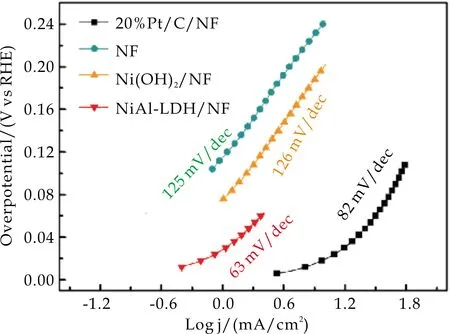
(d)碱性Tafel曲线图9 不同介质中的产氢性能测试曲线
在验证了NiAl-LDH/NF样品有突出的电催化产氢性能之后,为了进一步测定NiAl-LDH/NF的催化稳定性,对样品进行了I-T测试.由图10(a)可以看出,在中性溶液中,NiAl-LDH/NF均可稳定工作至少100 h;从图10(b)可以看出,在碱性溶液中,NiAl-LDH/NF可稳定工作约90 h,表明了该样品具有极高的催化稳定性.
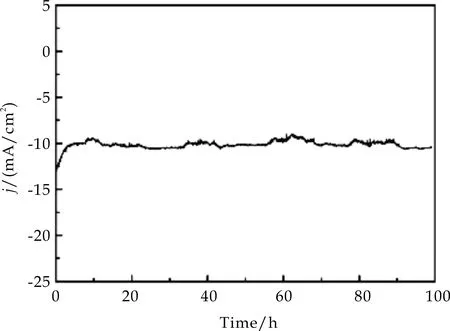
(a)中性
3 结论
本文通过简单的一步水热法在泡沫镍上原位生成了NiAl-LDH纳米片(标记为NiAl-LDH/NF).研究表明,Al源的加入量对样品的形貌与电催化性能有很大的影响.电催化测试结果表明,在中性和碱性条件下,NiAl-LDH/NF在10 mA/cm2下的过电势仅为189 mV和140 mV,且能维持约90 h的催化稳定性.本工作通过简单的一步水热法制备的NiAl-LDH/NF电极为开发和制备具有优异催化活性和持久稳定性的非贵金属电催化剂提供了思路.
