肝移植治疗胃肠胰神经内分泌瘤肝转移1例
2020-05-12钟成鹏
钟成鹏 耿 玮 夏 强
作者单位:200127 上海交通大学医学院附属仁济医院肝脏外科
胃肠胰神经内分泌肿瘤(GEP-NET)是一类发生于胃肠道或胰腺的,生长缓慢并可分泌不同生物活性胺或多肽激素的肿瘤,常见的GEP-NET包括胰高血糖素瘤、胰岛素瘤或胃泌素瘤等。根据是否产生激素相关临床症状,可分为功能性和非功能性两种[1-2]。根据美国国立癌症研究所SEER数据库显示,从2000年至2012年,GEP-NET的发病率约为3.56/10万,且逐渐升高[3]。尽管相较于同部位腺癌,GEP-NET的预后较好,但其较易发生远处转移,大大影响了患者的长期生存[4]。肝脏是GEP-NET较常见的转移部位,有研究报道65%~95%的患者于诊断时已发生肝转移[4],且由于肝转移瘤分泌功能性激素及肝占位使肝实质减少导致的肝衰竭风险[5],故肝转移者的5年生存率仅为13%~54%,而无肝转移者为75%~99%[4]。
肝切除术是目前治疗神经内分泌瘤(NET)肝转移的主要治疗方式,其能改善患者症状,延长生存期。2015年Partelli等[6]报道对于胰腺NET肝转移患者予根治性切除胰腺原发灶及肝转移灶,达到R0或R1标准,患者术后5年生存率为88%。2017年和2019年Ruzzente等[7-8]报道了意大利7家肝胆胰中心238例接受肝切除术治疗的NET肝转移患者的临床资料,其术后5年和10年生存率分别为67.1%和52.4%。而2017年Fairweather等[9]的研究则表明,肝切除术治疗NET肝转移患者的效果优于射频消融、化学治疗栓塞及系统性治疗等方法,其术后5年生存率高达90%。尽管肝切除术效果显著,然而较多患者确诊时已有肝内多发转移,失去了手术切除的机会,对于此类患者,有中心尝试通过肝移植完整切除病灶以改善预后。2011年6月1日,上海交通大学医学院附属仁济医院肝脏外科成功为1例胰腺NET肝转移患者行肝移植手术,术后患者恢复可,至随访截止时间(2019年6月7日)未发现复发等情况,现报道如下。
1 临床资料
1.1 术前资料
患者,女性,39岁,因“胰体尾切除术后4年余,发现肝占位3年”于2011年5月至上海交通大学医学院附属仁济医院肝脏外科就诊。患者于2006年12月体检时发现胰体尾占位,平日无腹痛、腹泻、发热等症状,后于当地医院行胰体尾切除术,术后病理示实性假乳头状瘤(低度恶性潜能)。2008年患者体检时B超发现肝脏左叶单发囊性占位(11×11 mm),当时诊断为肝囊肿,予随访。同年患者出现反复中上腹疼痛,呈饥饿痛,胃镜示十二指肠溃疡,经抑酸、抗幽门螺杆菌及保护胃黏膜等治疗后未见好转,疼痛加剧。2010年患者体检时B超示肝脏囊性占位增多,CT示肝脏左、右叶多发占位,呈囊性及囊实性(图1)。遂行肝占位穿刺活组织检查,病理结果示实性假乳头状瘤肝转移。患者至外院就诊,测血清胃泌素显著升高(234 pg/mL),两次病理切片会诊示:(1)胰体尾占位 (胰腺)内分泌肿瘤,囊性变,包膜个别脉管内可见瘤栓,考虑分化好的神经内分泌癌(Ki-67:2%+);(2)肝占位穿刺 转移性内分泌癌(Ki-67:5%+)。拟诊为胰腺NET肝转移(胃泌素瘤),十二指肠溃疡,胰体尾切除术后。患者接受醋酸奥曲肽微球及舒尼替尼治疗后肿瘤有所控制,未见明显增大,后因高血压、手足综合征等并发症而停用舒尼替尼。患者入本院后完善相关术前检查,影像学检查排除胰腺复发灶及其余肝外转移灶,肝功能检查基本正常(Child A级)。
1.2 肝移植术及术后管理
2011年6月1日对患者于全麻下行经典原位肝移植术,供肝来源于公民心脏死亡后捐献(DCD)。术中见上腹部黏连,无肝硬化,全肝分布大小不等的囊性及实性占位。无腹水,腹腔内其余脏器未探及异常。术中先分解粘连,断离肝周韧带以充分游离病肝,随后仔细解剖第一肝门并暴露胆总管、门静脉及肝动脉,阻断门静脉及肝上腔静脉、肝下腔静脉,离断后取出病肝。供肝植入先吻合肝上腔静脉、肝下腔静脉及门静脉,随后开放血流并行肝动脉及胆管重建,胆管重建采取端端吻合。
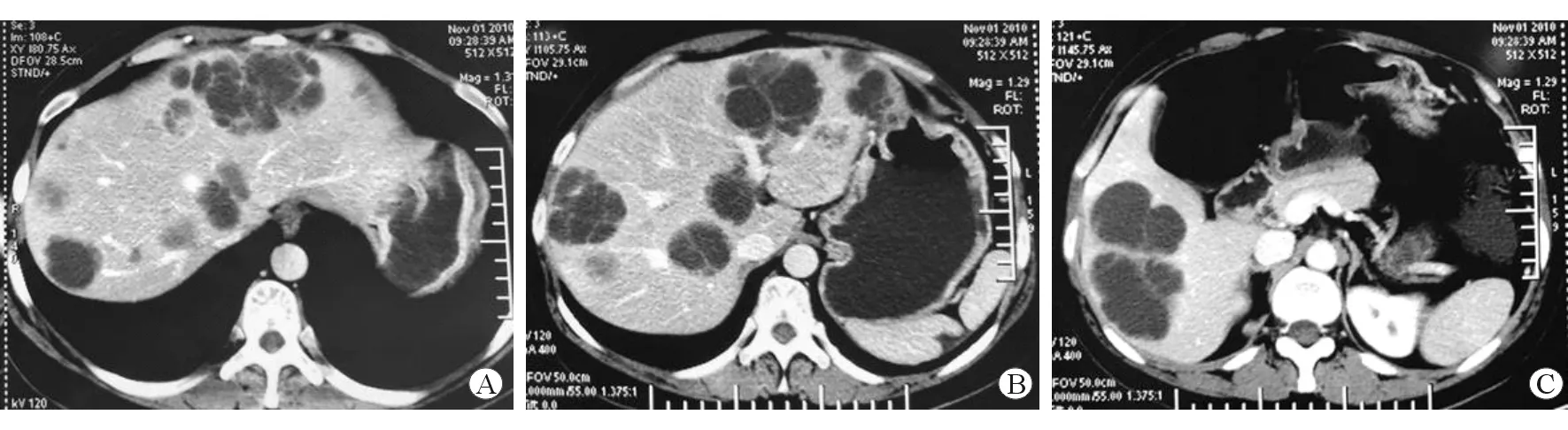
图1 患者2010年CT影像
术后予他克莫司+吗替麦考酚酯抗排异。术后1个半月,将吗替麦考酚酯改为雷帕霉素。术后密切监测患者肝功能及血药浓度,及时调整用药方案。患者原发病为肝脏转移性胃泌素瘤,且因胃泌素升高发生顽固性溃疡,术后予增加抑酸剂的剂量及应用胃黏膜保护剂。
患者出院后定期复查。术后3个月内每周1次,3个月后2周1次,6个月后每月1次,1年后每3个月1次。除血常规、肝脏生物化学检查、他克莫司水平等肝移植术后常规随访项目外,患者还需定期复查胃泌素及CT,以监控肿瘤复发。
1.3 结果
患者肝移植手术顺利完成,术后病理示:转移性胰腺NET(G2),分化较好,核分裂像约1个/10 HPF,Ki-67密集区约15%。术后患者肝功能恢复良好,于术后第19天出院。
截至2019年6月7日,随访超过8年,未见明显血管及胆管等外科并发症,发生排异1次,予调整免疫抑制剂剂量后肝功能恢复正常。术后患者仍有胃部不适症状,胃镜示胃部慢性炎性病变。随访期间患者胃泌素升高2次,但随后CT(图2)、全身PET-CT、68Ga检查及奥曲肽扫描等均未提示明显肿瘤复发征象。
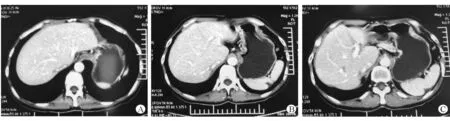
图2 患者2018年CT影像
2 讨论
胃泌素瘤是胰腺NET中常见的肿瘤,其能分泌大量胃泌素,并导致卓-艾综合征,表现为顽固性消化道溃疡,胃部灼热感,大量胃酸进入小肠还可能导致腹泻症状[2]。本病例于2006年发现胰腺原发病灶时未出现明显临床症状。2008年发现肝转移灶后,患者出现顽固性饥饿痛等十二指肠溃疡症状,经胃泌素检测及肝占位穿刺活组织检查确诊为胰腺NET肝转移(胃泌素瘤)。
肿瘤的病理结果对预后至关重要。2010年世界卫生组织(WHO)根据肿瘤核分裂像数及Ki-67标记率制定了NET的分级标准[1]。根据此标准,本病例为中级别G2,肿瘤分化程度较高。
因转移瘤分期较晚,易复发或再次发生远处转移,故肝移植一般不用于肝转移瘤的治疗。但由于NET肝转移进展缓慢,易局限于肝内,因此对于无法切除的肝内多发转移灶,许多中心积极尝试应用肝移植术完整去除肝转移灶。关于肝移植治疗NET肝转移的疗效,目前尚未见大型前瞻性随机对照试验,现有文献显示肝移植疗效尚可,术后5年生存率为47%~97%,复发率高达31.3%~56.8%[10-12]。2019年Korda等[13]报道对10例NET肝转移患者行肝移植治疗,术后5年生存率为71%,5例复发,5年无复发生存率为43%。Grąt等[14]则报道了12例接受肝移植治疗的NET肝转移患者,经随访(中位时间为7.9年)2例死亡,6例复发,术后10年生存率为78.6%。Sher等[15]的多中心研究共纳入28家中心的85例NET肝转移患者,肝移植治疗后40例死亡,术后1年、3年及5年生存率分别为83%、60%和52%,复发率为56.8%。另有研究对欧洲肝移植注册(ELTR)1982年至2009年的213例患者的数据进行分析,发现NET肝转移患者的肝移植术后5年生存率达52%。213例患者中有112例(52.6%)复发,复发患者中有86例死亡[16]。2012年Chen等[17]报道了中国大陆首例肝移植治疗胰腺NET肝转移病例,该患者原发疾病为胰腺胰岛素瘤伴脾蒂及肝脏多发转移。因患者转移灶分布于全肝,无法切除,此前仅接受了胰体尾+脾脏切除术,患者疾病进展,有顽固性低血糖发作史,遂于2006年接受肝移植术,术后恢复顺利,症状改善。术后29个月,患者随访时发现脑部新发转移灶并行手术治疗,目前患者生存期超过5年。
肝细胞癌(HCC)是肝移植的主要指征。2011年Nguyen等[18]对美国器官共享联合网络/器官获取和移植网络(UNOS/OPTN)数据库的数据进行分析,结果显示在2002年至2011年期间,NET肝转移患者移植术后5年生存率为57.8%,而HCC患者为64.4%,两者差异无统计学意义(P=0.109)。Gedaly等[19]利用UNOS数据库分析1998年至2008年肝移植治疗NET肝转移及HCC患者的疗效,得出相似结论。2016年Vilchez等[20]利用UNOS数据库比较了肝移植治疗NET肝转移患者与其他原发性肝脏恶性肿瘤患者的疗效,将研究年限扩展到2013年,结果显示NET肝转移患者的5年生存率与胆管细胞癌及混合细胞癌患者相似,低于HCC患者(39%比54%,P=0.005),NET肝转移患者的5年生存率也低于HCC患者(49%比62%),但两者的10年生存率差异无统计学意义。
大量移植中心报道证实,肝移植是治疗NET肝转移患者的安全有效的可选方式。为提高患者受益,有中心对移植条件进行了探索,米兰大学提出对NET肝转移患者行肝移植治疗的米兰选择标准:(1) 组织学确认为较低级别NET(G1~G2);(2)原发肿瘤由门脉系统引流,原发灶于移植术前已切除,肝外其余病灶于移植术前已切除;(3)转移灶累及全肝体积<50%;(4)疾病稳定或对治疗应答至少6个月;(5)年龄<60岁(相对条件)。2016年米兰大学的Mazzaferro等[21]报道了根据该标准入组的88例NET肝转移患者,其中42例行肝移植治疗,46名未行肝移植,两组在肿瘤负荷方面差异无统计学意义。经过中位时间为122个月的随访,发现移植组的5年及10年生存率均高于非移植组(97.2%和88.8%比50.9%和22.4%,P<0.001)。此外,移植组5年及10年的疾病进展率均为13.1%,明显低于非移植组(83.5% 和89%,P<0.001)。该研究结果显示肝移植能显著改善符合米兰选择标准的NET肝转移患者的预后。然而,2019年Ruzzenente等[8]报道了28例符合米兰选择标准的NET肝转移患者,肝切后5年生存率为83.3%,与文献报道的肝移植疗效无显著差异,故他们认为对于可切除的NET肝转移瘤,肝切应为首选治疗方式,而肝移植可作为不可切除肿瘤的可选治疗方案。
许多因素影响着肝移植治疗NET肝转移患者的预后,如年龄>50岁,胰腺来源肿瘤或非胃肠道来源肿瘤,Ki-67高表达,肿瘤分化程度较低,肝肿大和肿瘤累及肝脏体积>50%等[16,22-23]。肝移植的同时行胰十二指肠切除、全胃切除等较大操作也被证实不利于预后[16],因此移植前未处理原发灶或肝外灶也是肝移植的禁忌证[22],Sher等[15]的研究也佐证了这一结论,该研究通过Cox多因素回归证明肝移植时行多器官移植、胰十二指肠切除术或远端胰腺+脾+肠切除术处理原发灶及肝外病灶是预后不良的危险因素,该研究还表明大血管侵犯者预后较差。此外,Nguyen等[18]的研究发现,2002年终末期肝病模型(MELD)评分系统使用以后,应用肝移植治疗的NET肝转移患者的预后改善,该研究还发现移植时受体高总胆红素、低白蛋白水平及供体高肌酐水平均是影响预后的危险因素。Nobel等[24]也发现移植时总胆红素≤1.3 mg/dL的患者术后生存率较高。
本病例肝移植后随访至今已逾8年,未发生复发,预后较好。患者良好预后的相关因素包括:(1)移植时年龄为39岁;(2)肿瘤Ki-67表达较低,分级为G2,中等级别,分化较好;(3)原发肿瘤由门脉系统引流,且移植前已完成原发肿瘤切除;(4)应用醋酸奥曲肽微球治疗,肿瘤有所控制;(5)术前无低蛋白血症或高胆红素血症。
综上所述,肝移植是治疗不可切除NET肝转移的安全有效的方案,但移植受体应根据临床及病理特征等谨慎选择。年轻、肿瘤分化较好、分级较低、已处理原发灶及肝外转移灶、肝脏转移灶体积较小的患者可通过肝移植获得较好的预后。
