葡萄籽原花青素对大鼠视网膜缺血-再灌注损伤的保护作用△
2020-05-12孙明雷荣黄偲璇
孙明 雷荣 黄偲璇
视网膜缺血-再灌注损伤(retinal ischemia-reperfusion injury,RIRI)为眼科治疗中常见疾病,如眼外伤、视网膜中央动脉阻塞、糖尿病视网膜病变等均可引起,病情加重会出现视功能损伤,严重影响患者生活质量[1]。RIRI病理机制较复杂,其中自由基释放过多、抗氧化能力下降在RIRI的发生中占有重要作用[2]。细胞外信号调节激酶1/2(extracellular signal-regulation kinase1/2,ERK1/2)信号通路为MAPK家族中重要亚族,在调控细胞氧化应激反应中具有重要作用。近期研究显示,ERK1/2活化后可进一步激活核因子E2-相关因子2/血红素加氧酶-1(nuclear factor-E2-related factor 2/heme oxygenase-1,Nrf2/HO-1)通路,进而发挥抗氧化、抗缺血以及视网膜保护作用,因此,激活ERK/Nrf2/HO-1通路可能为视网膜损伤的一个治疗靶点[3-5]。葡萄籽原花青素(grape seed proanthocyanidin extract,GSPE)是从葡萄籽中提取的多酚类化合物,药理学研究显示其具有显著的抗氧化、抗血栓、抗凋亡等药理作用[6]。然而,GSPE对RIRI的保护作用及其机制尚不清楚。本研究制作RIRI大鼠模型,观察GSPE对RIRI大鼠视网膜的保护作用,并初步探讨GSPE可能作用机制,为GSPE临床应用提供一定的理论基础。
1 材料与方法
1.1 材料SD雄性大鼠由河南省动物实验中心提供,共120只,体质量为220~260 g、SPF级,动物许可证号:2018(豫)-0002,所有大鼠无眼病,统一在本院动物饲养中心喂养,温度为22~25 ℃,自然光源照射,维持12 h昼夜交替节律,自由饮水、摄食。本研究所有动物管理遵守医学伦理准则,经本院医院伦理委员会批准。GSPE(湖北远成科技公司,含量≥90.0%);α-硫酸锌[α-LA;上海现代哈森(商丘)药业有限公司]。HE染色试剂盒(杭州碧云天生物技术研究所);肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-6(IL-6)、iNOS检测试剂盒(上海晶抗生物工程有限公司);超氧化物歧化酶(SOD)、丙二醛(malondialdehyde,MDA)检测试剂盒(南京森贝伽生物科技有限公司);活性氧(ROS)检测试剂盒(上海莼试生物技术有限公司);TUNEL细胞凋亡检测试剂盒(德国Roche公司);免疫组织化学检测试剂盒(北京中杉金桥生物技术有限公司);兔抗鼠Nrf2、HO-1(CST公司);p-ERK1/2、ERK1/2、HRP标记羊抗鼠免疫球蛋白G(IgG)(R&D公司,美国);DSX100光学显微镜(Olmpus公司,日本);MG6000蛋白凝胶成像系统(Thmorgan公司)。
1.2 方法
1.2.1 RIRI模型制备参考文献[7]采用眼内灌注加压法制作RIRI大鼠模型,随机挑选14只大鼠作为Sham组(假手术组),其余106只大鼠用于制备RIRI模型。RIRI组大鼠腹腔注射100 g·L-1戊巴比妥钠(3 mL·kg-1),麻醉成功后固定于操作台,滴复方托吡卡胺滴眼液至瞳孔散大以预防感染,将带有生理盐水的注射器(5号小儿头皮针)经耳前巩膜边缘轻柔刺进前房,固定针头将输液瓶升高距离眼球平面约165 cm,使得眼压达60 mmHg(1 kPa=7.5 mmHg),观察到眼结膜苍白,眼底镜显示视网膜血流被阻断,表明视网膜缺血形成[7]。1 h后输液瓶高度缓慢降低至眼球水平面,拔取针头,此时视网膜颜色逐渐恢复橘红色,血流逐渐恢复正常,表明视网膜再灌注成功[7],对侧眼采取同样方法制备RIRI。造模结束后红霉素眼膏涂结膜囊内以防感染。Sham组仅进行前房穿刺,其他操作与RIRI大鼠相同。再灌注24 h后观察大鼠生命体征是否正常,角膜是否感染。剔除由于麻醉、前房穿刺、灌注不当、眼压不稳定等原因造成的大鼠死亡,其中Sham组死亡2只,存活12只;RIRI大鼠死亡46只,符合造模标准者60只。
1.2.2 实验分组与给药将造模成功的60只RIRI大鼠随机分为RIRI组(模型组)、GSPE低剂量(GSPE-L)组、GSPE中剂量(GSPE-M)组、GSPE高剂量(GSPE-H)组、α-LA组,每组12只。灌注24 h后对各组大鼠给药,GSPE低、中、高剂量组:GSPE灌胃剂量参考文献[8],分别为0.13 g·kg-1、0.25 g·kg-1、0.50 g·kg-1;α-LA组(阳性对照组)α-LA灌胃剂量参考文献[9],为100 mg·kg-1;Sham组、RIRI组灌胃等量生理盐水。
1.3 指标检测
1.3.1 样本采集各组给药1次结束后处死大鼠,收集视网膜组织及血液,血液离心后收集血清,置于-80 ℃保存;视网膜组织一部分置于40 g·L-1多聚甲醛中固定,一部分冻存-80 ℃保存。
1.3.2 视网膜组织形态学检测常规制备视网膜组织石蜡切片,烘烤后在二甲苯中脱蜡、梯度乙醇脱水处理,自来水冲洗后采用苏木素染液染色5 min,体积分数1%盐酸中分化3 s,返蓝30 min,采用伊红染液复染2 min,经梯度乙醇水合、二甲苯透明处理、中性树胶封片,在光学显微镜下观察视网膜组织形态并拍照保存,对各组大鼠视网膜厚度进行评估。
1.3.3 各组大鼠血清TNF-α、iNOS、IL-6水平检测采用ELISA试剂盒检测各组大鼠血清中TNF-α、iNOS、IL-6水平,具体参照试剂盒说明书进行操作。
1.3.4 各组大鼠血清SOD、MDA、ROS水平检测参考SOD检测试剂盒采用氮蓝四唑(NBT)显色法检测各组大鼠血清SOD活性;双抗体夹心法检测血清中MDA水平,铁离子还原法检测血清ROS水平。
1.3.5 TUNEL染色检测视网膜组织神经细胞凋亡情况将视网膜组织石蜡切片烘烤脱蜡、脱水后,添加Proteinase K工作液常温下孵育20 min,于H2O2溶液中封闭15 min,添加TUNEL工作液室温下避光孵育1 h,滴加POD转化剂避光孵育40 min,DAB显色后采用苏木素复染5 min,脱水、透明、封胶后,置于显微镜下观察并统计阳性染色的凋亡细胞数量。利用Image-J软件分析细胞凋亡率,细胞凋亡率(%)=视野内阳性染色细胞数目/细胞总数×100%。
1.3.6 免疫组织化学检测视网膜组织中Nrf2、HO-1、Caspase-3蛋白表达视网膜组织石蜡切片烘烤脱蜡、脱水后,于H2O2溶液中封闭15 min清除内源性过氧化物酶活性,在枸橼酸中修复20 min,37 ℃下添加山羊血清封闭30 min,加入Nrf2、HO-1、Caspase-3一抗(稀释浓度1300),4 ℃恒温孵育过夜,滴加二抗(15000),37 ℃孵育1 h,DAB显色反应后采用苏木素复染,清洗后脱水、透明、封胶后,置于显微镜下观察蛋白染色情况,利用Image-J软件对蛋白阳性表达率进行定量分析。
1.3.7 Western blot法检测视网膜组织中ERK1/2、p-ERK1/2蛋白表达情况采用组织裂解液裂解视网膜组织,离心后提取组织总蛋白,BCA法测定蛋白含量后,统一取20 μg蛋白行SDS-PAGE分离目的蛋白,将蛋白凝胶转移至PVDF膜上进行转膜反应,脱脂牛奶封闭后,将膜置于ERK1/2、p-ERK1/2一抗中4 ℃孵育(1500)过夜,置于二抗(15000)中孵育1 h,经ECL发光显影后,采用Image-J软件定量分析目的条带相对表达量。

2 结果
2.1 GSPE对RIRI大鼠视网膜组织形态学的影响Sham组大鼠视网膜组织中色素上皮层、神经感觉层内界膜形态完整,神经节细胞层数量较多,细胞形态正常,内丛状层(IPL)、内核层(INL)及外核层(ONL)细胞形态完整、排列紧密。RIRI组IPL、INL、ONL各层均出现视网膜高度水肿,细胞结构、形态遭到破坏,内界膜隆起、褶皱,INL层细胞排列紊乱,细胞边界模糊,空泡化严重;GSPE各组、α-LA组细胞水肿情况随剂量增加逐渐减轻,细胞排列疏松,损伤得到一定缓解。与Sham组视网膜厚度[(92.35±16.54)μm]相比,RIRI组[(161.48±10.26)μm]显著升高(P<0.05);与RIRI组相比,GSPE-L组、GSPE-M组、GSPE-H组、α-LA组视网膜厚度[(139.31±11.43)μm、(127.05±12.73)μm、(113.16±13.25)μm、(110.58±13.47)μm]显著降低,且GSPE表现出剂量依赖性(均为P<0.05)。见图1。

图1 HE染色观察各组视网膜组织形态学变化情况(×200)
2.2 GSPE对RIRI大鼠血清中炎性因子水平的影响与Sham组相比,RIRI组大鼠血清中TNF-α、IL-6、iNOS水平显著升高(均为P<0.05);与RIRI组相比,GSPE-L组、GSPE-M组、GSPE-H组、α-LA组大鼠血清中TNF-α、IL-6、iNOS水平显著降低,且GSPE表现出剂量依赖性(均为P<0.05)。见表1。
注:与Sham组比较,aP<0.05;与RIRI组比较,bP<0.05
2.3 GSPE对RIRI大鼠血清中氧化应激水平的影响与Sham组相比,RIRI组大鼠血清中SOD水平显著降低,MDA、ROS水平显著升高(均为P<0.05);与RIRI组相比,GSPE-L组、GSPE-M组、GSPE-H组、α-LA组大鼠血清中SOD水平显著升高,MDA、ROS水平显著降低,且GSPE表现出剂量依赖性(均为P<0.05)。见表2。
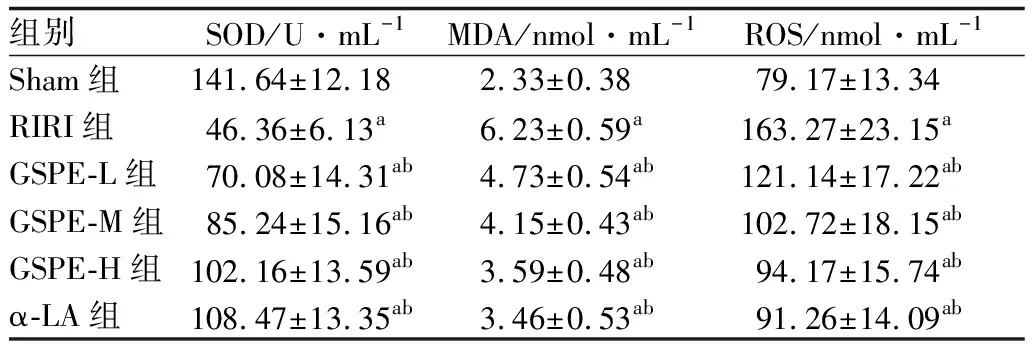
组别SOD/U·mL-1MDA/nmol·mL-1ROS/nmol·mL-1Sham组141.64±12.18 2.33±0.38 79.17±13.34 RIRI组46.36±6.13a6.23±0.59a163.27±23.15aGSPE-L组70.08±14.31ab4.73±0.54ab121.14±17.22abGSPE-M组85.24±15.16ab4.15±0.43ab102.72±18.15abGSPE-H组102.16±13.59ab3.59±0.48ab94.17±15.74abα-LA组108.47±13.35ab3.46±0.53ab91.26±14.09ab
注:与Sham组比较,aP<0.05;与RIRI组比较,bP<0.05
2.4 GSPE对RIRI大鼠视网膜神经细胞凋亡的影响与Sham组相比,RIRI组大鼠视网膜神经细胞凋亡率显著升高(P<0.05);与RIRI组相比,GSPE-L组、GSPE-M组、GSPE-H组、α-LA组大鼠视网膜神经细胞凋亡率显著降低,且GSPE表现出剂量依赖性(均为P<0.05)。见图2。

图2 TUNEL染色检测各组视网膜神经细胞凋亡情况(×200)
2.5 GSPE对RIRI大鼠视网膜组织中ERK/Nrf2/HO-1表达的影响与Sham组相比,RIRI组大鼠视网膜组织中Nrf2、HO-1阳性表达率、ERK1/2磷酸化水平显著降低(均为P<0.05);与RIRI组相比,GSPE-L组、GSPE-M组、GSPE-H组、α-LA组大鼠视网膜组织中Nrf2、HO-1阳性表达率、ERK1/2磷酸化水平显著升高,且GSPE表现出剂量依赖性(均为P<0.05)。见图3至图5和表3。

图3 免疫组织化学检测各组视网膜组织Nrf2表达情况(×200)

图4 免疫组织化学检测各组视网膜组织HO-1表达情况(×200)
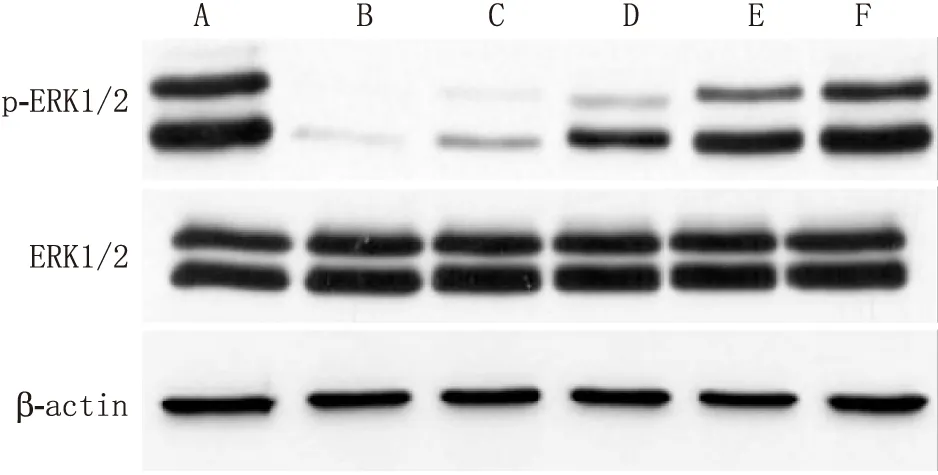
图5 Western blot检测各组视网膜组织ERK1/2表达 A:Sham组;B:RIRI组;C:GSPE-L组;D:GSPE-M组;E:GSPE-H组;F:α-LA组

组别Nrf2阳性表达率/%HO-1阳性表达率/%ERK1/2磷酸化水平Sham组52.27±8.3637.64±3.751.16±0.25RIRI组11.86±3.19a9.86±1.07a0.23±0.04aGSPE-L组29.93±4.21ab16.78±2.14ab0.41±0.05abGSPE-M组34.06±5.17ab22.54±4.65ab0.62±0.07abGSPE-H组43.12±7.23ab27.58±4.25ab0.89±0.09abα-LA组45.35±7.46ab29.78±4.88ab0.92±0.05ab
注:与Sham组比较,aP<0.05;与RIRI组比较,bP<0.05
2.6 GSPE对RIRI大鼠视网膜神经细胞Caspase-3表达的影响与Sham组视网膜组织中Caspase-3阳性表达率(9.34±1.43)%相比,RIRI组[(43.68±6.32)%]显著升高(P<0.05)。与RIRI组相比,GSPE-L组、GSPE-M组、GSPE-H组、α-LA组视网膜组织中Caspase-3阳性表达率[(32.35±5.38)%、(24.97±4.26)%、(16.24±3.15)%、(15.59±2.43)%]显著降低,且GSPE表现出剂量依赖性(均为P<0.05)。见图6。
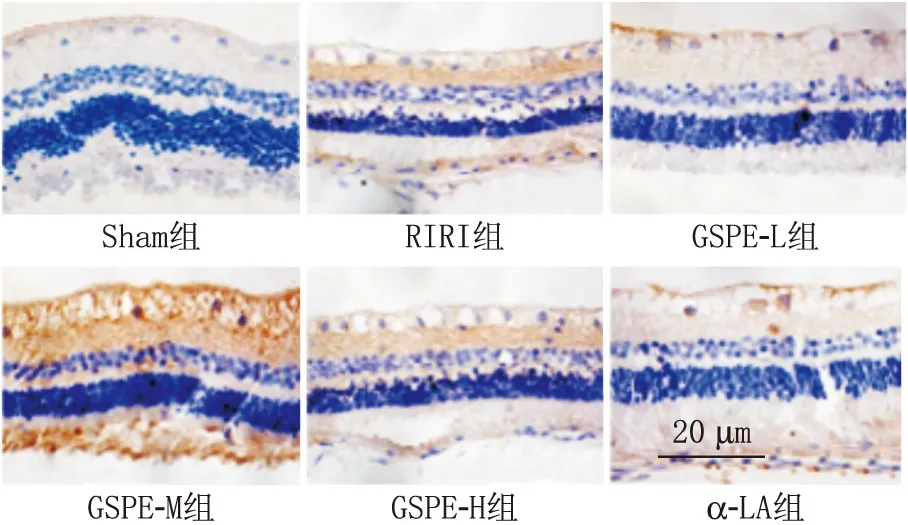
图6 免疫组织化学检测各组视网膜组织Caspase-3表达情况(×200)
3 讨论
视网膜发生缺血后及时恢复缺血是避免视功能损伤的有效措施,当缺血时间过长,再次恢复血流后反而会加剧视网膜损伤造成RIRI。RIRI动物模型的主要制作方法有线栓法、血管结扎法、视神经结扎法、激光光凝法等,前房高眼压灌注法是目前制作RIRI大鼠模型常用方法[10-11],具有难度小、眼球损伤小、可重复性好等优点。本研究采用前房高眼压灌注法制作RIRI大鼠模型,结果发现,与Sham组相比,RIRI组IPL、INL、ONL各层均出现视网膜高度水肿,细胞结构、形态遭到破坏,内界膜隆起、褶皱,INL层细胞排列紊乱,细胞边界模糊,空泡化严重等,视网膜厚度明显升高,与其他报道中视网膜组织形态学损伤趋势相符合[12],提示RIRI大鼠模型制作成功。
GSPE是从葡萄籽中分离的天然多酚类化合物,能够抑制细胞凋亡、氧化应激、炎症反应等,尤其在抗氧化、抗衰老等方面应用较广[13]。Li等[14]研究发现,GSPE对糖尿病大鼠视网膜病变具有一定的抑制作用。Sun等[15]研究表明,GSPE可通过抑制氧化应激损伤保护视网膜。本研究发现,与RIRI组相比,经GSPE干预后大鼠视网膜细胞水肿逐渐减轻,损伤得到一定缓解,视网膜厚度降低,血清中TNF-α、IL-6、iNOS水平降低,提示GSPE对RIRI大鼠视网膜组织损伤、炎症反应具有改善作用。
氧自由基在组织缺血-再灌注损伤中占有重要地位,早期自由基已经产生,随着进一步发展,自由基数量逐渐增多,导致清除剂不足,最终造成氧化损伤和细胞凋亡,这是RIRI氧化应激损伤的主要途径[16]。本研究发现,与Sham组相比,RIRI组血清中SOD水平降低,MDA、ROS水平升高,经GSPE干预后血清中SOD水平升高,MDA、ROS水平降低,提示GSPE对RIRI大鼠氧化应激反应具有一定的抑制作用。
ERK1/2信号通路在调控细胞增殖、分化以及氧化应激反应中占据重要地位。Blixt等[17]研究显示,激活ERK1/2信号通路能够缓解眼动脉缺血后血管收缩力,进而缓解视网膜损伤。Nrf2/HO-1通路为重要抗氧化应激通路之一,多项研究显示,激活Nrf2/HO-1通路能够保护视网膜功能。Wan等[18]发现,曲美他嗪通过激活Nrf2/HO-1途径保护视网膜神经节细胞免受急性青光眼的侵袭;Wang等[19]发现,花青素-3-葡萄糖苷通过激活Nrf2/HO-1途径来减弱可见光诱导的体内视网膜变性。近期研究结果显示,ERK1/2信号通路活化后能够进一步改变Nrf2构象,造成Nrf2与Keap1解离,活化的Nrf2可调控抗氧化蛋白,如HO-1、NQO1蛋白等发挥抗氧化作用[20]。Zhang等[21]研究发现,在脑缺血-再灌注损伤后,激活ERK1/2后ERK1/2发生磷酸化可进一步活化Nrf2/HO-1抗氧化通路,进而减少脑缺血损伤。细胞凋亡属于复杂性蛋白水解酶级联反应,其中Caspase-3为细胞进入程序性凋亡的特异标志物,在视神经节细胞凋亡过程中发挥重要作用[22]。然而在RIRI中未发现ERK/Nrf2/HO-1通路的相关作用,本研究发现,与Sham组相比,RIRI组大鼠视网膜神经细胞凋亡率显著升高,视网膜组织中Caspase-3阳性表达率显著升高,Nrf2、HO-1阳性表达率、ERK1/2蛋白磷酸化水平均降低,经GSPE干预后视网膜神经细胞凋亡率显著降低,Caspase-3阳性表达率显著降低,Nrf2、HO-1阳性表达率、ERK1/2蛋白磷酸化水平均升高,与α-LA组作用一致,表明ERK/Nrf2/HO-1通路在大鼠视网膜组织中处于抑制状态,参与介导RIRI的发生,GSPE可提高ERK1/2蛋白磷酸化水平,进而上调Nrf2、HO-1蛋白表达,降低凋亡蛋白Caspase-3的表达,抑制视网膜神经细胞凋亡,发挥视网膜保护作用。
综上所述,GSPE可促使ERK磷酸化并上调Nrf2、HO-1表达,减轻大鼠炎症及氧化应激损伤,抑制视网膜组织神经细胞凋亡,保护视网膜组织,为GSPE应用于RIRI治疗提供了一定依据,激活ERK/Nrf2/HO-1通路可能是其作用机制之一,然而GSPE药理机制较复杂,是否通过其他通路来发挥对RIRI的保护作用有待进一步研究。
