α-硫辛酸对青光眼模型大鼠视网膜神经节细胞的保护作用及其机制△
2020-05-12边思林刘华
边思林 刘华
青光眼是一种以眼压升高、视神经损伤和视力损害为特征的疾病[1]。眼压的病理性增高是进行性视神经损伤的主要危险因素[2]。青光眼发病机制复杂,视网膜神经节细胞(retinal ganglion cells,RGC)进行性凋亡是其病理基础[3]。目前用于治疗青光眼的最常用方法是降眼压治疗。然而,高眼压并不是青光眼的唯一危险因素。部分眼压正常的患者仍然出现了青光眼病变,另外部分青光眼患者眼压虽然降低到正常值,但视神经损伤仍在进行[4-5]。这说明治疗青光眼时对于视神经的保护同样至关重要。研究发现,原代培养的原发性开角性青光眼(primary open angle glaucoma,POAG)患者小梁网细胞线粒体功能下降,产生过量活性氧簇(ROS);说明氧化应激在青光眼的发病机制中起重要作用[6]。
α-硫辛酸是天然抗氧化剂,已广泛应用于治疗周围神经病变。研究表明,α-硫辛酸可以显著改善糖尿病周围神经病变引起的临床症状,其疗效和安全性得到普遍认可[7-9]。作为高亲脂性自由基清除剂,α-硫辛酸在水相和脂质相中具有良好的溶解性。二氢硫辛酸作为α-硫辛酸的降解产物可以进一步去除ROS,修复自由基引起的脂质过氧化,抑制细胞凋亡,减少机体损伤[10-14]。研究发现,α-硫辛酸可以抑制视网膜缺血-再灌注损伤大鼠视网膜神经细胞中 Caspase-3 蛋白的表达,抑制其凋亡[10-13]。目前,关于α-硫辛酸对青光眼视神经的保护作用及机制研究较少。本研究探讨α-硫辛酸对青光眼模型大鼠RGC的保护作用及其机制。
1 材料与方法
1.1 实验动物与分组选取SPF级雄性SD大鼠60只,均为10周龄,体质量300~350 g。取30只大鼠,选右眼为实验眼,采用烙闭表层巩膜静脉的方法制作大鼠青光眼模型。将造模成功的大鼠随机分为两组:青光眼对照组和青光眼硫辛酸组,每组各15眼。另取30只大鼠,右眼行假手术操作,术后随机分为两组:正常眼压对照组和正常眼压硫辛酸组,每组各15眼。大鼠来自锦州医科大学实验动物研究中心,养殖环境符合医学实验室动物环境设施的要求。本研究遵循《实验动物管理条例》(2017修订版)的规定。
1.2 主要仪器和试剂主要仪器包括:鼠用 Goldmann 压平眼压计、光学显微镜照相装置、裂隙灯显微镜照相装置、双目手术显微镜、分光光度仪、离心机、眼科手术显微器械、手动移液枪、超净工作台。主要试剂包括:α-硫辛酸、氯胺酮、甲苯噻嗪、100 g·L-1水合氯醛,100 g·L-1多聚甲醛溶液,丙二醛(MDA)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)测定试剂盒,ELISA试剂盒,TUNEL细胞凋亡原位检测试剂盒,免疫组织化学SP试剂盒,兔抗大鼠Caspase-3多克隆抗体。
1.3 方法
1.3.1 大鼠青光眼模型的制作通过腹膜内注射氯胺酮(25 mg·kg-1)和甲苯噻嗪(10 mg·kg-1)混合物轻微麻醉大鼠。局部应用5 g·L-1丙美卡因滴眼液进行局部麻醉。手术步骤:(1)在角膜缘后,切开球结膜,分离结膜下筋膜;(2)完全暴露巩膜上静脉,游离并抬起静脉总支;(3)夹闭并烧灼角巩膜远侧静脉;(4)近端血管扩张且远端血管消失提示烙闭成功;(5)按图1所示血管进行逐一烙闭;(6)缝合球结膜,术后涂氧氟沙星软膏。假手术步骤不进行血管烧灼,其余步骤相同。采用手持式眼压计分别在造模前和造模后第1 周末、第2周末和第3 周末测量大鼠双眼眼压。每个时间点共测量5次,取中间的3个值计算平均值。造模后3周右眼眼压小于25 mmHg(1 kPa=7.5 mmHg)时,提示模型制作失败;否则提示模型制作成功,纳入实验分组[3,15]。

图1 表层巩膜静脉及烙闭操作示意图
1.3.2 实验干预于造模后第3周末,正常眼压硫辛酸组和青光眼硫辛酸组大鼠腹腔注射α-硫辛酸150 mg·kg-1,每天1次,持续3周。正常眼压对照组和青光眼对照组腹腔注射等体积的生理盐水,每天1次,持续3周。
1.3.3 眼压监测分别于造模前、造模后第1周末、第2周末、第3周末、第4周末、第5周末、第6周末应用手持式眼压计测量并记录大鼠双眼眼压,每个时间点共测5次,取中间3个值计算平均值,应用统计学软件分析眼压变化趋势。
1.3.4 取材及标本制备造模后第6周末,给予所有大鼠腹腔注射100 g·L-1水合氯醛 0.2 L·kg-1进行麻醉,快速取颈静脉血3500 r·min-1离心20 min,取上血清,分离标记,-80 ℃冰箱保存备用。快速取出右眼,浸于FAA 固定液固定10 min,100 g ·L-1多聚甲醛固定24 h。所有眼球标本固定后,制作视网膜石蜡标本[16-17]。
1.3.5 血清氧化应激指标的检测分别用相应测试盒检测MDA和ROS含量,GSH-Px和SOD酶活性,严格按照说明书操作。每个指标重复测量5次,取平均值,7 d内完成检测。
1.3.6 RGC凋亡和Caspase-3蛋白的检测(1)TUNEL法检测RGC凋亡情况,细胞核内有棕色颗粒的细胞为阳性细胞。在200倍光学显微镜下以RGC层为观察边界,每张玻片随机选取5个视野,计数阳性细胞数和RGC总数,取平均值,计算凋亡指数。凋亡指数=凋亡细胞数/RGC总数[16-17]。(2) 免疫组织化学法检测视网膜Caspase-3 蛋白表达情况,细胞核及细胞浆呈黄色或棕黄色染色者为阳性细胞。用计算机辅助图像分析系统对染色阳性物质进行光密度测定。在200倍光学显微镜下以RGC层为观察边界,每张切片随机选取5个视野,计算平均光密度值[16-17]。
1.4 统计学分析应用Graphpad Prism6软件作图,采用SPSS 20.0统计软件分析所有数据,计量资料以均数±标准差表示,多组计量资料比较采用单因素方差分析,组间两两比较采用LSD检验。检验水准:α=0.05。
2 结果
2.1 眼压变化造模后1周,青光眼模型大鼠右眼眼压相对于左眼升高 (10.7±2.3)mmHg,并能在预定实验时间6周内保持这一水平。造模后3周末开始腹腔注射α-硫辛酸,青光眼硫辛酸组大鼠右眼眼压在造模后4周、5周、6 周与青光眼对照组比较,差异均无统计学意义(均为P>0.05);正常眼压硫辛酸组大鼠右眼眼压在造模后4周、5周、6 周与正常眼压对照组比较,差异亦均无统计学意义(均为P>0.05)。见图2。
2.2 各组血清氧化应激指标的比较MDA和ROS含量:四组间比较差异均有统计学意义(均为P<0.05),均为正常眼压硫辛酸组<正常眼压对照组<青光眼硫辛酸组<青光眼对照组(均为P<0.05)。GSH-Px及SOD酶活性:四组间比较差异均有统计学意义(均为P<0.05),均为正常眼压硫辛酸组>正常眼压对照组>青光眼硫辛酸组>青光眼对照组(均为P<0.05)。见表1。
2.3 各组RGC凋亡检测结果
2.3.1 显微镜下观察结果四组RGC层均观察到凋亡细胞。青光眼硫辛酸组和青光眼对照组的凋亡细胞数明显多于正常眼压硫辛酸组和正常眼压对照组。见图3。
2.3.2 各组RGC凋亡指数四组间RGC凋亡指数比较差异有统计学意义(F=18.383,P<0.05)。正常眼压硫辛酸组RGC 凋亡指数和正常眼压对照组差异无统计学意义(P>0.05),但均小于青光眼硫辛酸组和青光眼对照组(均为P<0.05);青光眼硫辛酸组RGC 凋亡指数小于青光眼对照组(P<0.05)。见表2。
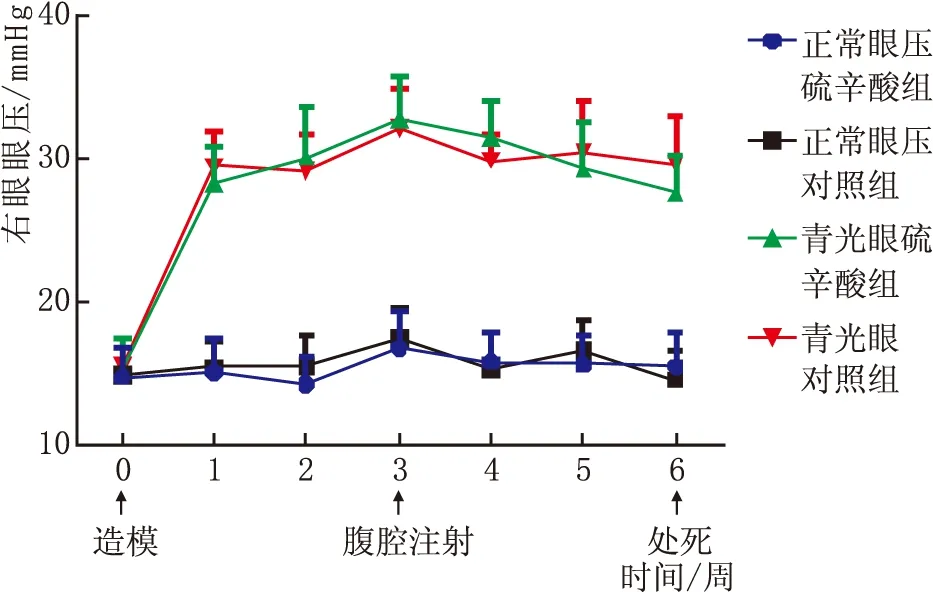
图2 四组大鼠不同时间点右眼眼压变化
表1 四组大鼠血清 MDA 、ROS含量以及GSH-Px 及SOD酶活性比较

组别眼数MDA/mmol·L-1ROS/U·mL-1GSH-Px/U·mL-1SOD/U·mL-1正常眼压硫辛酸组153.44±0.31322.38±61.788.07±1.31133.48±2.87正常眼压对照组154.47±0.36∗372.84±57.11∗7.02±0.96∗116.04±3.13∗青光眼硫辛酸组156.44±0.26∗#436.26±43.79∗#5.85±0.78∗#87.20±3.18∗#青光眼对照组158.26±0.25∗#△534.27±76.40∗#△4.72±1.26∗#△66.78±3.82∗#△F值765.52933.74625.9121234.838P值0.0000.0000.0000.000
注:与正常眼压硫辛酸组相比,*P<0.05;与正常眼压对照组相比,#P<0.05;与青光眼硫辛酸组相比,△P<0.05

图3 显微镜下显示四组RGC层均观察到凋亡细胞(×200) A:正常眼压硫辛酸组;B:正常眼压对照组;C:青光眼硫辛酸组;D:青光眼对照组。箭头示阳性细胞
2.4 各组视网膜Caspase-3蛋白表达情况
2.4.1 显微镜下观察结果四组RGC层均可见Caspase-3蛋白表达。青光眼硫辛酸组和青光眼对照组Caspase-3蛋白表达均明显高于正常眼压硫辛酸组和正常眼压对照组。见图4。

图4 显微镜下显示四组RGC层均可见Caspase-3蛋白阳性表达(×200) A:正常眼压硫辛酸组;B:正常眼压对照组;C:青光眼硫辛酸组;D:青光眼对照组。箭头示阳性细胞
2.4.2 各组视网膜Caspase-3蛋白平均光密度值四组间Caspase-3蛋白平均光密度值比较差异有统计学意义(F=182.317,P<0.05)。正常眼压硫辛酸组Caspase-3蛋白平均光密度值和正常眼压对照组差异无统计学意义(P>0.05),但均小于青光眼硫辛酸组和青光眼对照组(均为P<0.05);青光眼硫辛酸组Caspase-3蛋白平均光密度值小于青光眼对照组(P<0.05)。见表2。
表2 四组大鼠RGC 凋亡指数、视网膜Caspase-3蛋白平均光密度值

组别凋亡指数/%平均光密度值正常眼压硫辛酸组11.87±7.230.117±0.036正常眼压对照组12.24±8.19∗0.118±0.026∗青光眼硫辛酸组18.66±5.23#0.284±0.045#青光眼对照组27.74±5.78#△0.380±0.039#△F值18.383182.317P值0.0000.000
注:与正常眼压硫辛酸组相比,*P>0.05;与正常眼压对照组或正常眼压硫辛酸组相比,#P<0.05;与青光眼硫辛酸组相比,△P<0.05
3 讨论
青光眼患者视神经损伤的病理基础是RGC的进行性凋亡[3]。POAG患者小梁网发生变性时通过小梁网路径流出的房水阻力增加,引起眼压升高,最终导致RGC 凋亡[3]。小梁网功能退化和小梁网细胞丢失主要是由于氧化应激和凋亡机制启动所致[3,18-19]。研究发现,原代培养的POAG患者小梁网细胞线粒体功能下降,产生过量ROS[20]。这些病理变化最终导致眼压升高,并通过 RGC 退化机制影响整个视觉神经通路。本研究中,我们通过烧灼浅层巩膜静脉,切断表层巩膜静脉房水回流通路,使眼压增高来建立青光眼大鼠模型。实验过程中,手术组右眼相对于左眼,眼压升高 (10.7±2.3)mmHg,并能在预定实验时间6周内保持这一水平。高眼压可使氧自由基产生和清除失衡,导致ROS在视网膜细胞内大量积累,引起视网膜细胞损伤[21-22]。生命体内的氧自由基以ROS 为主,ROS 可以靶向攻击不饱和脂肪酸引起脂质发生过氧化,造成细胞膜及细胞器的损伤,细胞内 ROS 的大量积累与抗氧化酶的活性下调有关[23-25]。MDA是细胞氧化应激损伤的产物,其水平高低反映了细胞受自由基攻击和损伤的程度[26-27]。SOD、GSH-Px是存在于细胞内的抗氧化酶,具有清除氧自由基维持细胞内氧化平衡的作用,其水平可以间接反映细胞内抗氧化能力[28-29]。本研究发现,青光眼模型大鼠血清中MDA和ROS的含量较正常眼压对照组明显升高,抗过氧化物酶SOD和GSH-Px活性明显下降,且青光眼模型大鼠RGC凋亡数量明显多于正常眼压对照组,这提示机体处于氧化应激状态,并启动了RGC凋亡程序。研究发现[30-31],ROS 在诱导细胞凋亡中起关键作用,它可以触发线粒体释放蛋白激酶C,激活Caspase-3并启动凋亡。Caspase家族是哺乳动物中所有凋亡信号转导的共同通路,通常作为无活性的酶原存在于细胞质中。它的激活被认为是启动凋亡程序的特异性标志,其中Caspase-3是凋亡过程中最重要的终末执行酶[32]。我们通过免疫组织化学染色发现,青光眼模型大鼠RGC层Caspase-3蛋白表达明显多于正常眼压对照组,这提示眼压升高致使机体处于氧化应激状态,并激活Caspase-3,启动了RGC凋亡程序。
α-硫辛酸是一种水溶性和脂溶性代谢抗氧化物,活性最强的一种抗氧化剂。研究表明,α-硫辛酸可显著抑制神经细胞内脂质过氧化,提高细胞存活率,延缓细胞老化进程[33]。α-硫辛酸可以增加神经细胞的抗氧化能力,减轻线粒体氧化损伤,抑制凋亡程序的激活[34]。本研究发现,经过α-硫辛酸治疗后,青光眼硫辛酸组较青光眼对照组大鼠血清MDA和ROS含量明显降低,GSH-Px和SOD抗氧化酶活性明显升高。正常眼压硫辛酸组较正常眼压对照组大鼠血清MDA和ROS含量明显降低,GSH-Px和SOD抗氧化酶活性明显升高。这表明α-硫辛酸可以显著降低机体的氧化应激水平,提高机体的抗氧化能力。通过TUNEL 法和免疫组织化学法标记视网膜组织切片后发现,青光眼模型大鼠RGC凋亡数量和Caspase-3蛋白表达明显高于正常眼压对照组。经α-硫辛酸治疗后,青光眼硫辛酸组RGC凋亡数量和Caspase-3蛋白表达较青光眼对照组均明显减少,而正常眼压硫辛酸组较正常眼压对照组均无明显变化。然而,无论是青光眼硫辛酸组还是正常眼压硫辛酸组与相应对照组相比,眼压差异均无统计学意义。
以上结果表明,α-硫辛酸可以抑制RGC的凋亡,但不是通过降低眼压实现的,而是通过其抗氧化作用降低Caspase-3的表达实现的。
