参苓白术散与痛泻要方对溃疡性结肠炎大鼠BMSCs 向结肠黏膜组织归巢作用的影响
2020-05-12崔树婷刘喜平崔国宁李沛清曾庆涛
崔树婷,刘喜平,崔国宁,李沛清,曾庆涛
(甘肃中医药大学,甘肃 兰州 730000)
溃疡性结肠炎(ulcerative colitis,UC)是一种炎症性肠病,目前临床治疗主要采取对症治疗及缓解症状[1]。骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)是起源于中胚层的一种非造血干细胞,研究表明移植BMSCs 使其归巢至受损组织,参与组织修复与重建[2],对UC 具有一定的治疗作用[3],而中医证候存在下机体炎症反应外周血微环境对BMSCs 的归巢可产生重要影响。据此,本研究以2,4,6-三硝基苯磺酸(TNBS)/乙醇诱导建立UC 大鼠模型,观察治疗UC 的常用有效方剂参苓白术散与痛泻要方对外周血来源BMSCs 向结肠黏膜归巢的干预作用及机制,以期阐明参苓白术散与痛泻要方治疗UC 的作用机理,同时以“以方测证”探讨TNBS/乙醇诱导UC大鼠模型的中医证候特征,为进一步研究BMSCs 移植治疗UC 的机制及中医药参与BMSCs 移植治疗UC 提供参考。
1 材料
1.1 试剂与药物 参苓白术散及痛泻要方药材饮片购买于甘肃中医药大学附属医院,经甘肃中医药大学药学院景明教授鉴定符合药典规定。苏木红染液(南京建成生物科技有限公司,批号D006);伊红染液(上海碧云天生物技术有限公司,批号C0109);苏木素(南京建成生物科技有限公司,批号D005);中性树脂(上海生工生物工程有限公司,批号E675007);DMEM-F12 培养基(美国Gibco/Invitrogen 公司,批号HLM150312);胎牛血清(美国Gibco/Invitrogen 公司,批号HLC0101);胰蛋白酶(上海碧云天生物技术有限公司,批号ST505);青/链霉素溶液(上海碧云天生物技术有限公司,批号C0222);台盼蓝粉末(德国Sigma 公司,批号HZB0368);5% TNBS(德国Sigma 公司,批号S9951);淋巴细胞分离液TBD(上海研谨生物科技有限公司,批号D-5879);抗荧光淬灭剂(上海碧云天生物技术有限公司,批号P0126);兔来源多克隆SDF-1 抗体(英国Abcam 公司,批号ab183105);山羊多克隆CXCR4 抗体(英国Abcam 公司,批号ab183198)。
1.2 动物 健康SPF 级SD 雄性大鼠120 只,体质量为180~220 g,生产许可证号SCXK(军)2012-0011。饲养于温度23~25 ℃、湿度40%~60%、12 h 昼夜交替环境,大鼠摄食饮水。
1.3 仪器 MCO-15AC-SC CO2培养箱(日本三洋公司);GSWP04700 混合纤维素滤膜(0.22 μm,美国Millipore 公司);F513440-0001 不锈钢细胞筛(80~200 目,上海生工生物工程有限公司);3599 细胞培养瓶、3099 细胞培养板(美国Costar 公司);ECLIPSE Ti-s 倒置显微镜(日本Olympus公司);FV3000 激光共聚焦显微镜(美国Bio-Tek公司)。
2 方法
2.1 药物制备 依据参考文献[4],参苓白术散(炒白术、山药、茯苓、白参各15 g,白扁豆12 g,莲子肉、炒薏米各10 g,砂仁、桔梗各6 g,炙甘草9 g)与痛泻要方(炒白术、炒白芍各12 g,防风6 g,陈皮9 g),按原方比例将上述药物饮片分别浸泡30 min,煎煮2 次,第1 次加8倍水,煎煮1 h,取煎液;第2 次加6 倍水,煎煮30 min,取煎液,2 次煎液混合浓缩,按大鼠与人体服用剂量换算,参苓白术散浓缩为含原药材2.26 g/mL,痛泻要方浓缩为含原药材0.78 g/mL。
2.2 造模及给药 120 只雄性SPF 级SD 大鼠常规适应性饲养1 周后,随机抽取30 只作为空白组,剩余90 只造成UC 模型。参考文献[5]方法,将5%TNBS 与等体积50%乙醇混合共0.8 mL 的造膜剂,在石蜡油润滑下经肠管缓插8 cm 入结肠,7%水合氯醛麻醉后推注药物,再注0.5 mL空气,将大鼠头朝下倾斜45°放置1 min 等其自然清醒,1 次/周,连续5 周。在确立建模成功后随机分为空白组、模型组、参苓白术散组(生药22.6 g/kg)、痛泻要方组(生药7.8 g/kg)。参苓白术散组与痛泻要方组按照各给药剂量灌胃给药,给药体积为1 mL/100 g,空白组、模型组给予等体积生理盐水,1 次/d,连续给药28 d。
2.3 HE 染色 取全部结肠,剪取结肠黏膜组织用4% 多聚甲醛固定24 h,石蜡包埋,制成厚约为4 μm 病理切片。HE 染色观察大鼠结肠黏膜组织病理学变化,并按如下标准进行病理评分[6],无损伤记0 分;黏膜充血、水肿且无溃疡记1 分;黏膜轻度糜烂、充血、水肿且无溃疡灶,记2分;黏膜中度糜烂、充血、水肿且有一个溃疡灶,记3 分;黏膜重度糜烂、充血、水肿且多个溃疡灶,记4 分;黏膜重度糜烂、充血、水肿且至少有一个溃疡灶大于1 cm2,记5 分。
2.4 UC 模型大鼠外周血来源BMSCs 的分离培养与标记 常规手术消毒,无菌条件下切开腹腔并暴露腹主动脉,采血针内加入1 000 U 的肝素从腹主动脉采血5 mL,用等量的无血清的DMEM 培养基稀释后,加到含有5 mL Ficoll-Paque Plus 液的离心管内,用密度梯度离心法离心(2 000 r/min、20 min),吸取中间的白膜状的淋巴细胞层,加5 倍以上体积的PBS 液洗2 次后离心(1 000 r/min、10 min)。用10%胎牛血清DMEM 培养基,按照细胞浓度1×106/mL 接种在25 cm2的培养瓶中,在37 ℃、5%CO2及饱和湿度的条件下培养,48 h 后弃去培养液,PBS 冲洗3次,去除未贴壁细胞,加入培养液继续培养,每3 d 半量换液1 次,10 d 后获得生长融合的BMSCs,传代培养,取生长良好的第3 代BMSCs,加入终质量浓度40 μg/mL的DAPI 作为标记物,孵育2 h 后洗涤,收集细胞备用。
2.5 激光共聚焦 各组大鼠均在灌胃结束后经尾静脉注射约含1×106个BMSCs 混悬液1 mL。在第7、14 天麻醉动物后取每只大鼠远端长约8 cm 的结肠黏膜组织做冰冻切片,用4%多聚甲醛固定24 h,PBS 洗涤、封片,直接在激光共聚焦显微镜下观察BMSCs 的分布(明亮蓝色荧光细胞)情况,每张切片随机选3 个视野,应用image J pro plus 6.0 软件分析各组BMSCs 的平均光密度值(IOD/area)。
2.6 Western blot 取各组结肠黏膜组织在液氮中研磨,加入到1.5 mL 含有蛋白酶抑制剂RIPA 的离心管中,12 000 r/min离心5 min,取上清于-80 ℃冰箱中保存,取200 μL 以上蛋白至新的离心管中进行蛋白定量测定,然后进行电泳,浓缩胶电压80 V,30 min;分离胶电压120 V,电泳2 h。PVDF 膜通过在无水甲醇溶液中摇动激活,然后转膜1.5 h,5%脱脂奶粉封闭2 h,用封闭液将对应的一抗SDF-1(1∶1 000)、CXCR4(1∶1 000)、β-actin(1∶1 000)稀释,然后4 ℃孵育过夜。次日用封闭液将二抗稀释成一定的浓度(1∶1 000),然后温育2 h。洗涤3 次,10 min/次。发光试剂A 液和B 液在避光条件下按1∶1 等体积混合配成ECL 化学发光工作液备用,用移液器均匀地平铺到PVDF 膜正面,静置5 min 后进行曝光。采用凝胶图象处理系统(Gel-Pro-Analyzer)软件测灰度值,求蛋白质的相对表达水平。
2.7 统计学分析 采用SPSS 19.0 软件进行统计分析,数据以()表示,两组间比较采用两样本独立t检验,多组间比较采用单因素方差分析,以P≤0.05 表示差异有统计学意义。
3 结果
3.1 结肠黏膜组织病理学观察及评分 见图1~2、表1。空白组结肠组织黏膜结构清晰,黏膜完整无缺损,黏膜上皮细胞排列整齐,无炎症细胞浸润,固有层可看到毛细血管与淋巴管细胞,杯状细胞比较丰富,排列整齐,肠腺比较规则。模型组杯状细胞严重变形,结肠黏膜缺失明显,黏膜层与黏膜下层分界线消失,固有层腺体多数为不完整,杯状细胞减少,部分细胞出现坏死,结肠黏膜炎性损伤,并有大量炎性细胞浸润,符合UC 病理组织特征,表明TNBS/乙醇诱导UC 大鼠模型成功建立。经参苓白术散与痛泻要方治疗后,黏膜上皮细胞排列比较整齐,炎性细胞浸润明显减少。
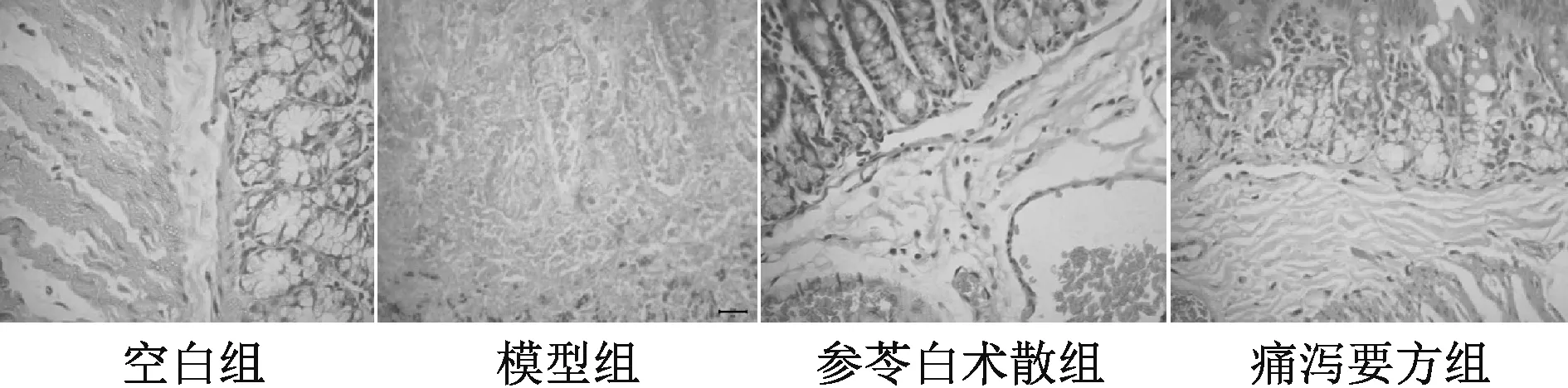
图1 第7 天各组大鼠结肠组织形态观察(HE,×400)
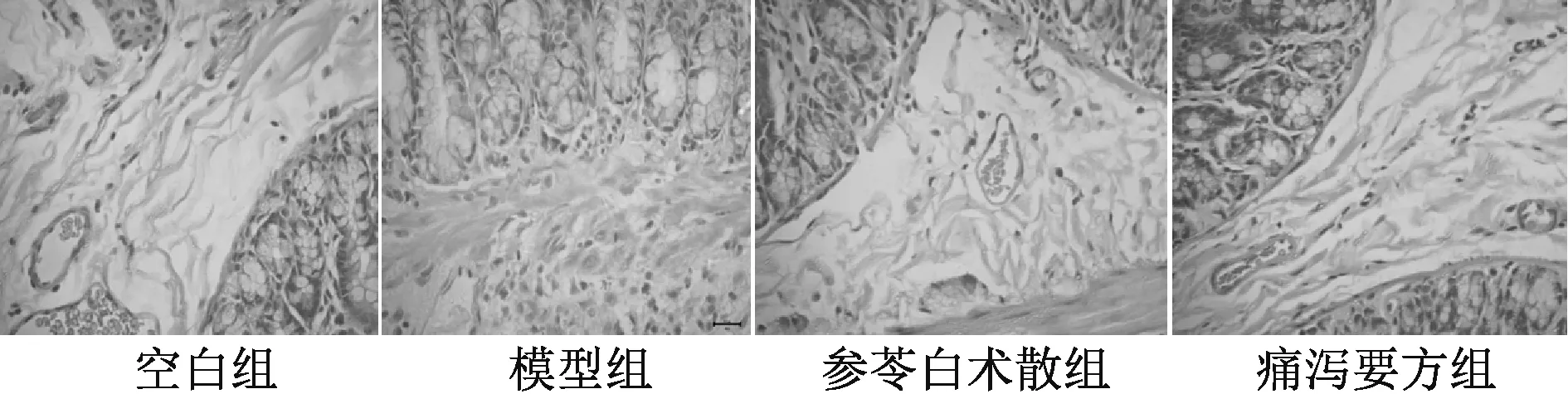
图2 第14 天各组大鼠结肠组织形态观察(HE,×400)
表1 各组大鼠结肠黏膜组织病理评分()
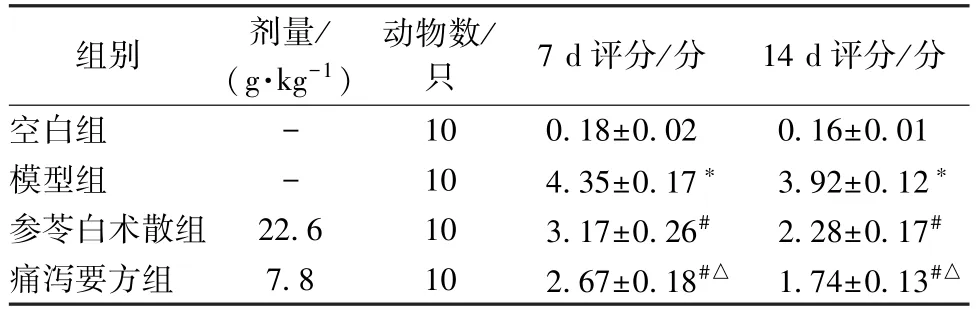
表1 各组大鼠结肠黏膜组织病理评分()
注:与空白组比较,∗P<0.05;与模型组比较,#P<0.05;与参苓白术散组比较,△P<0.05。
3.2 大鼠外周血来源BMSCs 在结肠黏膜组织的分布 见图3~4、表2。各组均可检测到DAPI 标记的大鼠外周血来源BMSCs 在结肠黏膜组织的分布,给药干预后,其归巢到结肠黏膜组织的BMSCs 的数量增多。第14 天时,与空白组比较,模型组结肠黏膜组织BMSCs 升高(P<0.05);与模型组比较,各给药组结肠黏膜组织 BMSCs 升高(P<0.05),痛泻药方组BMSCs 更高(P<0.05)。2 个时间段各组BMSCs 进行比较,发现第14 天时模型组、给药组BMSCs 升高(P<0.05)。
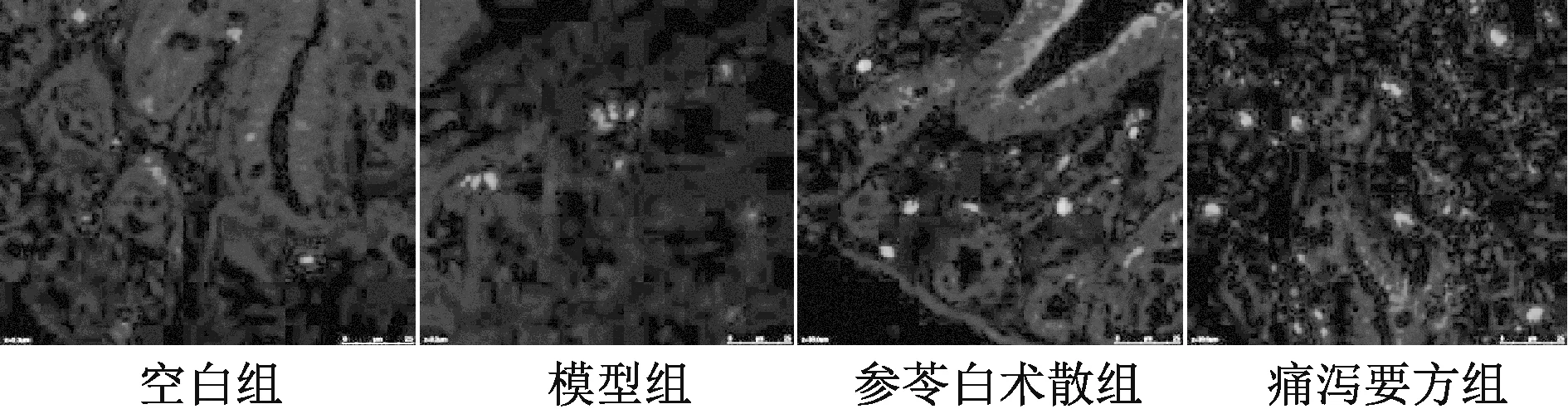
图3 第7 天用激光共聚焦检测各组BMSCs 的归巢(DAPI,×400)
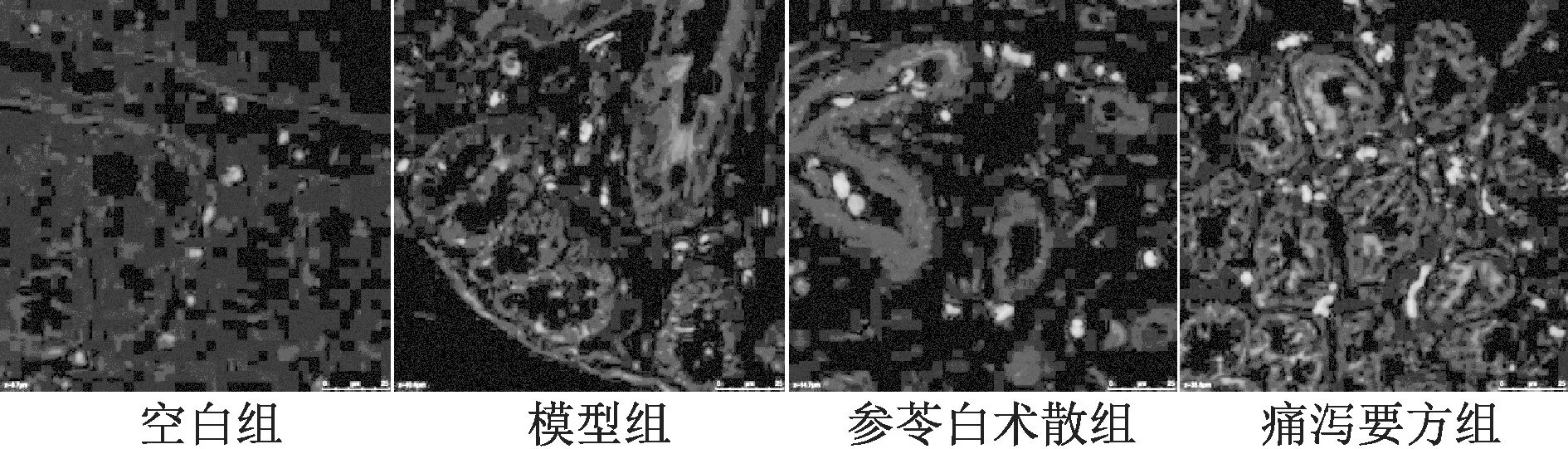
图4 第14 天用激光共聚焦检测各组BMSCs 的归巢(DAPI,×400)
3.3 大鼠结肠黏膜组织SDF-1/CXCR4 蛋白的表达 见表3、图5。与正常组比较,第7、14 天模型组大鼠结肠黏膜组织SDF-1 蛋白表达升高(P<0.05),第14 天模型组大鼠结肠黏膜组织CXCR4 蛋白表达升高(P<0.05)。与模型组比较,第7、14 天参苓白术散组及痛泻要方组大鼠结肠黏膜组织SDF-1 蛋白表达升高,第14 天CXCR4 蛋白表达升高(P<0.05);痛泻要方组明显优于参苓白术散组(P<0.05)。
表2 各组大鼠外周血来源BMSCs 在结肠黏膜组织的分布()

表2 各组大鼠外周血来源BMSCs 在结肠黏膜组织的分布()
注:与空白组比较,∗P<0.05;与模型组比较,#P<0.05;与参苓白术散组比较,△P<0.05;组内第7 天比较,▼P<0.05。
表3 各组大鼠结肠组织SDF-1 和CXCR4 蛋白的表达()
注:与空白组比较,∗P<0.05;与模型组比较,#P<0.05;与参苓白术散组比较,△P<0.05。
4 讨论
UC 是一种免疫性疾病,其病情易于反复、迁延难愈。本病发病机制不明确,当前研究从基因、炎症因子、信号通路等方面探讨UC 的发病机制取得了实质进展[7],主要和基因、遗传、环境、情志、肠黏膜屏障破坏、肠道菌群失调等因素相关[8];其发病原因主要是结肠黏膜的弥漫性损害,受损结肠黏膜的修复依赖于结肠黏膜干细胞。研究发现BMSCs 具有良好的免疫调节性和多向分化性[9],可分化为结肠黏膜干细胞,并且在特定体内微环境的干预作用下可向结肠黏膜迁移与归巢,从而参与受损结肠黏膜的修复,发挥治疗作用[10-11]。
BMSCs 的归巢与多种趋化因子介导有关。其中趋化因子CXCL12,也称之为SDF-1,参与炎症的调节[12],结合G-蛋白偶联受体CXCR4 通过多种途径介导细胞的黏附、存活、增殖和基因转录,增强细胞内的钙化,从而导致趋化性[13],SDF-1/CXCR4 轴在BMSCs 归巢到受损结肠部位过程中发挥着重要作用[14]。最近研究表明CXCR4 与SDF-1在BMSCs 中高度表达,SDF-1 与CXCR4 受体结合在调节BMSCs 的归巢过程中起重要作用[15],进一步研究发现SDF-1/CXCR4 对多种细胞具有一定的趋化能力,其参与骨形态发生蛋白2 诱导的BMSCs 的迁移[16]。在BMSCs 移植治疗急性肝衰竭的研究中发现趋化因子CXCR4 高表达可促进其归巢到受损组织[17]。也有研究发现利用慢病毒载体将CXCR4 基因转染BMSCs 来治疗UC,可增强BMSCs 的归巢及治疗UC 的疗效[18]。
UC 属中医学“泄泻”“肠僻”“大瘕泄”等范畴,多由感受湿邪,或饮食所伤,或情志不畅,或劳倦过度致脾胃虚弱,湿从内生,肝郁气滞而成。UC 证候规律研究表明[19],脾、肝是较常见的病位类证候要素,气虚、湿阻、气滞是常见的病性类证候要素,脾虚贯穿于疾病的发病始终,是其证候基础,脾虚湿阻和脾虚肝郁是UC 常见证候。参苓白术散与痛泻要方分别是治疗脾虚湿阻和脾虚肝郁的常用有效方剂。本研究从UC 模型大鼠外周血成功分离到了BMSCs,表明UC 结肠黏膜炎性损伤过程中,BMSCs 已动员加入到了外周血,与空白组比较,归巢到结肠黏膜组织的BMSCs 显著增加,参苓白术散与痛泻要方则能显著促进BMSCs 向结肠黏膜组织的归巢,痛泻要方优于参苓白术散租,二方促进BMSCs 归巢作用与提高SDF-1 和CXCR4 的表达有关,这可能是二方治疗UC 的作用机制之一。
方证相关是指特定方剂的功效和方剂内的药味及其配伍与其所对应的证候之间存在着高度的统一性和针对性。本研究以TNBS/乙醇诱导建立UC 大鼠模型,发现参苓白术散与痛泻要方都可促进该模型外周血来源BMSCs 向结肠黏膜组织的归巢,痛泻要方明显优于参苓白术散,说明本实验以TNBS/乙醇诱导建立的UC 大鼠模型倾向于中医脾虚肝郁证,这为研究UC 发病机制提供了中医证候模型参考。
