桑皮素对人宫颈癌Hela 细胞增殖与凋亡的影响
2020-05-12左亚奇高志红刘赛娜张晓丽孙转友
左亚奇,高志红,庞 策,刘赛娜,张晓丽,孙转友,甄 攀
(河北北方学院,河北 张家口 075000)
桑皮素,又名桑根皮素、桑白皮素,是一种异戊二烯基取代的黄酮类化合物。研究发现桑皮素为桑白皮的主要药用成分,常被用作对照品对桑白皮进行质量监测,具有抗 菌[1]、抗氧化[2]、降 血糖[3]及抗肿瘤[4]等多种生物活性,尤其是在抗肿瘤方面。邓洁等[5]将桑皮素作用于STAT3 磷酸化下的卵巢癌SKOV3 细胞后,发现桑皮素显著抑制SKOV3 细胞的增殖,并降低Cyclin D1 蛋白的表达;Dat 等[6]通过MTT 实验发现桑叶中提取的桑皮素对多种肿瘤细胞均有较好的抑制作用;有研究发现桑皮素是STAT3 通路中的一个有效的抑制剂,对肝癌和胰腺癌细胞具有抑制作用,另有体内外实验研究表明桑皮素对多种肿瘤细胞具有抑制作用并且对正常细胞的生长几乎没有影响[7-9]。本实验主要研究桑皮素抑制人宫颈癌Hela 细胞的增殖作用,以及初步探讨其促进Hela 细胞凋亡的作用机制。
1 材料
1.1 药物 桑皮素分离自川桑枝(采集于中国云南金平县,由中国医学科学院药物研究所马林副研究员鉴定为Morus notabilis),结构式如图1 所示。川桑树枝20 kg,粉碎,用95%乙醇浸泡,回流提取3 次,提取液合并,减压浓缩得浸膏。将浸膏溶解后以硅胶(100~200 目)拌样并干燥,分别用石油醚(PE,60~90 ℃)、二氯甲烷、乙酸乙酯和丙酮依次洗脱。二氯甲烷部分浓缩得浸膏200 g,浸膏以D101 大孔吸附树脂拌样并干燥,用乙醇水梯度洗脱(30%、80%、90%乙醇),80%乙醇部分得浸膏29 g,然后依次用硅胶(200~300 目)柱色谱(丙酮-石油醚梯度洗脱)、反相C18柱色谱(甲醇-水梯度洗脱)、葡聚糖凝胶Sephadex LH-20 柱色谱(乙醇洗脱)、制备型RP-HPLC(甲醇-水或乙腈-水洗脱)等分离纯制,得到化合物桑皮素,且含有量为1.07 mg/g,纯度为99.6%。
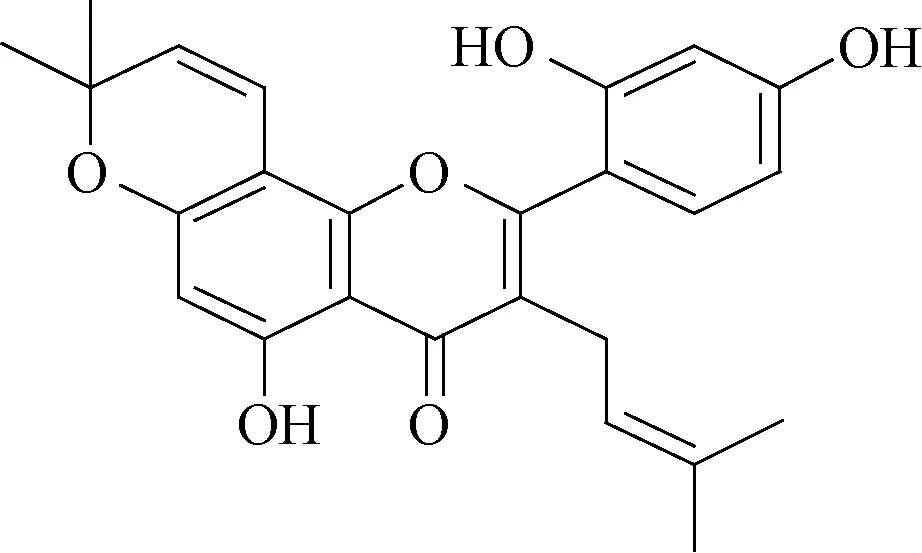
图1 桑皮素结构式Fig.1 Chemical structure of morusin
1.2 细胞株 Hela 细胞取自河北北方学院生命科学中心科技楼三楼307 室细胞库。
1.3 试剂 胎牛血清(美国Gibco 公司,批号1616496);RPMI 1640 培养基(北京索莱宝科技有限公司,批号20180511);Bax 抗体(英国Abcam公司,批号 GR239643-1);Bcl-2 抗体(英 国Abcam 公司,批号GR25072-1);Hoechst33258 染色试剂盒(北京碧云天生物技术研究所,批号102017180427);抗荧光淬灭剂(北京碧云天生物技术研究所,批号010518180509);β-actin 抗体(北京博奥森生物技术有限公司,批号AG05127919S);MTT 试剂(北京索莱宝科技有限公司,批号20180428);SDS-PAGE 凝胶试剂盒(北京索莱宝科技有限公司,批号20171113);5-氟尿嘧啶(5-FU,海旭东海普药业有限公司,批号H31020593)。
2 方法
2.1 细胞培养 Hela 细胞采用含10%胎牛血清、100 μg/mL 青霉素、100 μg/mL 链霉素的RPMI 1640 培养基,在37 ℃、5% CO2条件下的培养箱中培养,常规换液及传代培养,正常情况下细胞贴壁生长。
2.2 药物配制 精密称取桑皮素2.10 mg,加入0.05 mL 二甲基亚砜混匀震荡,使药物全部溶解,然后用RPMI 1640 培养基稀释成各用药浓度,放置于4 ℃冰箱保存,保质期10 d。实验前取1 支5-FU(10 mL/支,0.25 g),用RPMI 1640 培养基稀释配制阳性药(192 μmol/L),放置于4 ℃冰箱保存。
2.3 Hela 细胞的形态学变化观察 ①倒置显微镜观察Hela 细胞的形态,用10、15、20 μmol/L桑皮素作用Hela 细胞24 h 后,镜下观察细胞形态变化。②透射电镜观察Hela 细胞的超微结构,选取对数期生长的 Hela 细胞,经不同浓度(0、15 μmol/L)桑皮素作用24 h 后,胰酶消化2 min,离心(1 500 r/min,5 min),置于1.5 mL离心管内;2.5% 的戊二醛固定细胞,PBS 清洗3次;1%锇酸对Hela 细胞进行固定,PBS 清洗细胞3 次;丙酮梯度脱水;浸透在丙酮和包埋液(1∶1)的混合液中,于37 ℃温箱中过夜;包埋,修块,切片,电子染色,镜下观察。③扫描电镜观察Hela 细胞的超微结构,选取对数期生长的Hela 细胞,经不同浓度(0、15 μmol/L)桑皮素作用24 h后,经胰酶消化2 min,计数后进行铺板,待细胞融合度为80%~90%时,PBS 清洗3 次,5 min/次,2.5%的戊二醛固定1 h,PBS 清洗3 次,5 min/次,采用酒精梯度脱水,叔丁醇浸泡30 min,置于-20 ℃冰箱里变为固体,冷冻干燥仪进行干燥,喷金,镜下观察。
2.4 MTT 法检测桑皮素对Hela 细胞增殖抑制作用取处于对数期并生长良好的Hela 细胞,胰酶消化后,加入培养基轻轻吹打混匀单细胞悬液,均匀加入96 孔板内,常规培养24 h 后,加入桑皮素(2.5、5、7.5、10、15、20、25 μmol/L),作用24、48 h 后,终止培养。同时设置正常组、DMSO组(含0.1% DMSO 的等量培养基)及阳性对照组(5-FU,192 μmol/L),并分别设置6 个复孔。于每孔中加入10 μL MTT 试剂,培养箱中静置4 h 后用酶标仪测定 490 nm 处吸光度值 [OD(490 nm)],并计算IC50。
2.5 Hoechst 染色法观察Hela 细胞的凋亡 取处于对数期并生长良好的Hela 细胞,胰酶消化后,用细胞计数板将细胞浓度调整为5×105/mL,将盖玻片放置于6 孔板中,并每孔加入2 mL 单细胞悬液,培养24 h。次日加入桑皮素(0、10、15、20 μmol/L)作用24 h 后,终止培养。爬片完成后用PBS 清洗爬片3 次,3 min/次,丙酮室温固定20 min,PBS 清洗。暗室内滴加Hoechst 33258 染液对细胞进行染色,PBS 清洗。抗荧光淬灭剂封片,镜下观察并拍照。
2.6 Western blot 检测Hela 细胞Bax、Bcl-2 蛋白表达 收集经浓度为0、10、15、20 μmol/L 桑皮素处理24 h 及经15 μmol/L 桑皮素分别处理0、24、48 h 后的Hela 细胞,PBS 清洗,1 700 r/min离心收集细胞。加入0.5 mL 蛋白裂解液,混匀静置5 min,加1 mL 蛋白抽 提试剂,混匀静 置10 min,10 000 r/min、4 ℃高速离心15 min,保留中间蛋白膜,加1 mL 无水乙醇洗涤沉淀,10 000g、4 ℃离心3 min,去掉无水乙醇室温干燥蛋白。加入100 μL 2% SDS 溶解总蛋白,测定蛋白浓度,加入上样缓冲液蛋白煮沸,冷却后置于4 ℃冰箱保存,配制SDS 聚丙烯酰胺凝胶。每孔分别加5 μL Maker,正常组蛋白,样品蛋白,电泳1 h,转膜1 h,5%脱脂牛奶封闭1 h,PBST 洗膜3 次,10 min/次,加入一抗(1∶1 000)覆盖,4 ℃过夜;次日,PBST 清洗3 次,加入二抗(1∶5 000)覆盖,室温孵育1 h,PBST 洗膜3 次,10 min/次,滴加发光液拍照,用Quantity one 测定条带灰度值。
2.7 qRT-PCR 检测Bax、Bcl-2 mRNA 表达 消化洗涤对数期正常组和加药组细胞,2 500g离心收集细胞,PBS 清洗3 次,去上清,加1 mL RNA 抽提试剂静置5 min,加入氯仿0.2 mL,上下颠倒,室温静置2 min,于4 ℃下12 000 r/min 离心15 min,吸取上清至无酶离心管内,加等体积异丙醇,混匀后室温静置10 min,于4 ℃下10 000 r/min离心10 min,保留沉淀,加1 mL 75% 灭酶乙醇,于4 ℃下7 500 r/min 离心5 min,保留沉淀并室温干燥,加20 μL 无酶水溶解,取1 μL RNA 于NanoDrop2000 超微量分光光度计检测总RNA 浓度及纯度。根据试剂盒说明进行反转录,Bax、Bcl-2 及内参引物β-actin的引物序列及长度,见表1。对仅转录产物进行扩增,反应体系参照Yu 等[10]方法。采用2-ΔΔCt方法对mRNA 的相对转录水平进行统计分析。
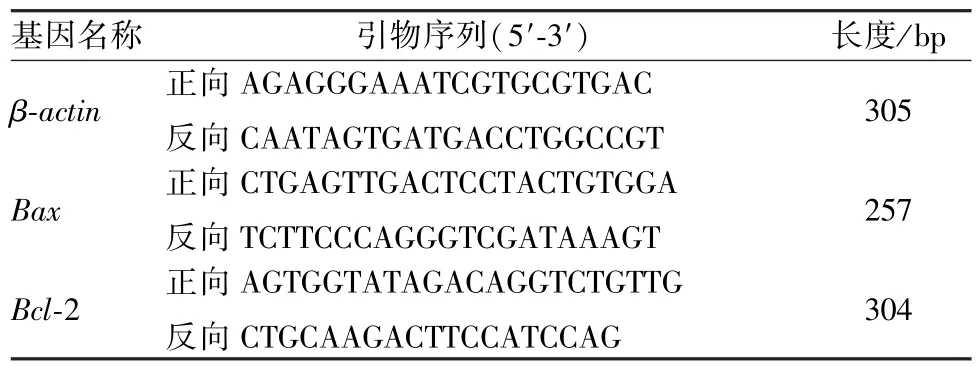
表1 引物序列Tab.1 Primer sequences
2.8 统计学分析 采用SPSS 19.0 统计分析,数据以()表示,组内比较采用配对样本t检验,多组间比较采用单因素方差分析,以P≤0.05 表示差异具有统计学意义。
3 结果
3.1 桑皮素对Hela 细胞形态学的影响
3.1.1 倒置显微镜观察 桑皮素(0、10、15、20 μmol/L)处理Hela 细胞24 h,倒置显微镜观察发现细胞状态由正常的六棱形逐渐皱缩变圆,细胞贴壁率降低,且有细胞穿孔现象,并且随着桑皮素浓度的增高,该现象越明显,见图2。
3.1.2 透射电镜观察 用透射电镜观察0、15 μmol/L桑皮素组细胞超微结构,发现15 μmol/L桑皮素组细胞膜不完整,染色质高度盘绕,细胞器结构不完整,形成许多气穴现象的空泡结构,见图3。
3.1.3 扫描电镜观察 用扫描电镜观察0、15 μmol/L桑皮素组细胞超微结构,发现15 μmol/L桑皮素组细胞膜皱缩,细丝状突起断裂,表面呈不规则的块状,见图4。
3.2 MTT 法检测Hela 细胞增殖 与DMSO 对照组比较,不同浓度桑皮素(2.5、5、7.5、10、15、20、25 μmol/L)处理Hela 细胞24、48 h,均能抑制Hela 细胞增殖(P<0.05),且呈浓度依赖性;其中桑皮素处理Hela 细胞24 h,IC50=17.2 μmol/L,见表2。
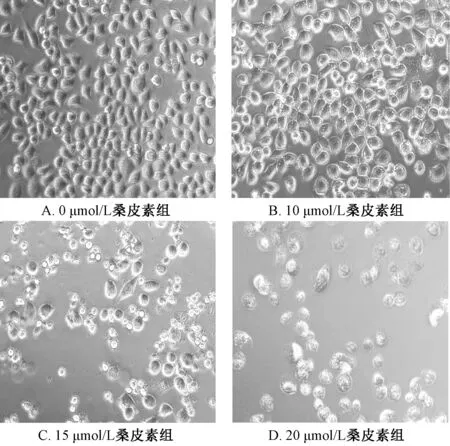
图2 不同浓度桑皮素对Hela 细胞形态的影响(×200)Fig.2 Effects of different concentrations of morusin on the morphology of Hela cells(×200)
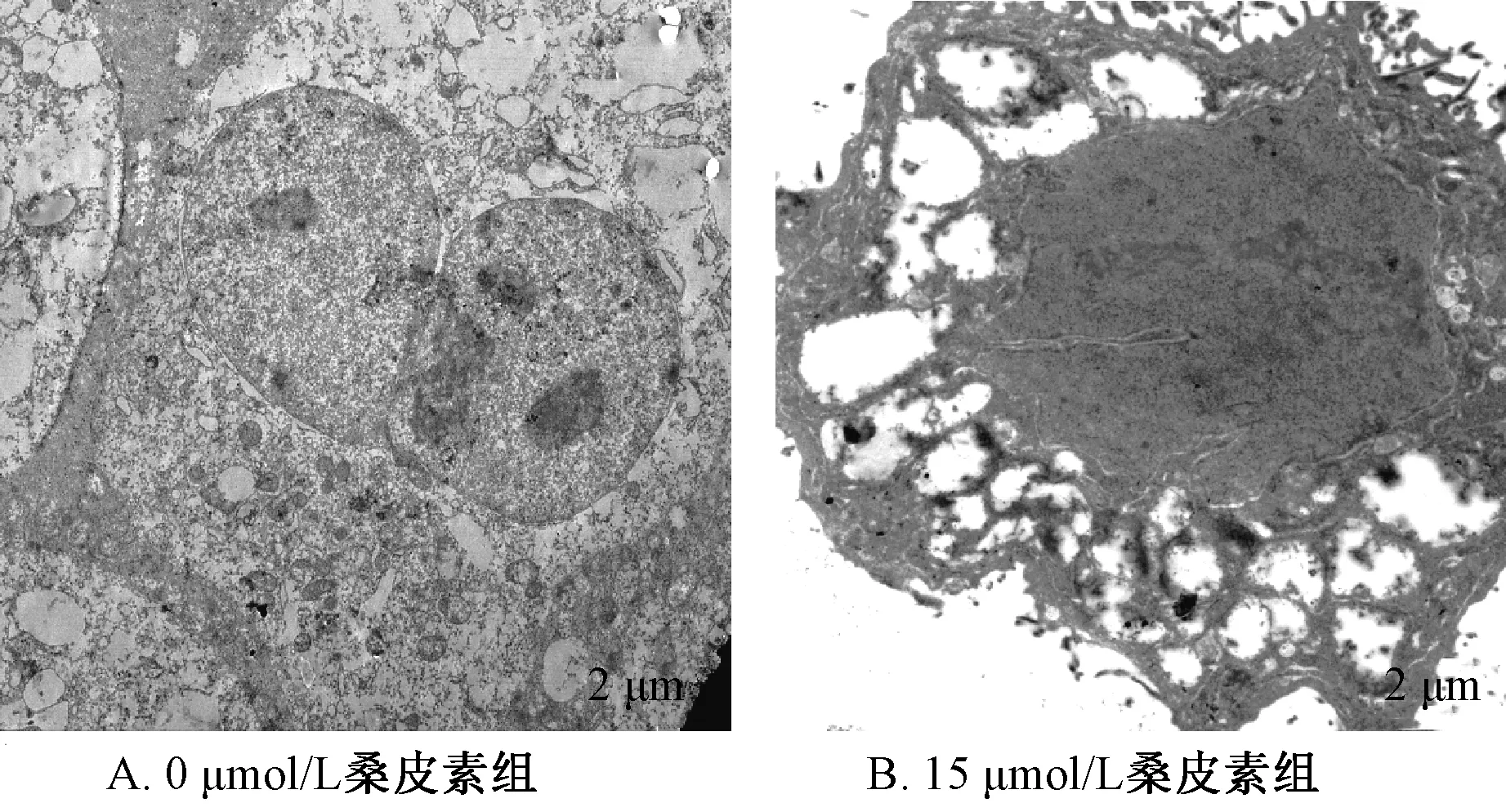
图3 桑皮素对Hela 细胞超微结构的影响(透射电镜)Fig.3 Effect of morusin on the microstructure of Hela cells(TEM)
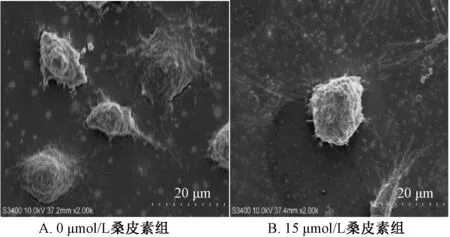
图4 桑皮素对Hela 细胞显微结构的影响(扫描电镜)Fig.4 Effect of morusin on the microstructure of Hela cells(SEM)
3.3 Hoechst 单染检测Hela 细胞凋亡 不同浓度桑皮素(0、10、15、20 μmol/L)处理Hela 细胞24 h 后,经Hoechst33258 染色,镜下观察发现正常组细胞呈椭圆形和正常蓝色;10 μmol/L桑皮素组细胞个别染色加深,染色质固缩,细胞核呈致密浓染;15 μmol/L桑皮素组浓染细胞数量明显增多,多数细胞核边缘变钝;20 μmol/L桑皮素组有部分细胞核出现破碎的现象,见图5。
表2 桑皮素对Hela 细胞的抑制作用(,n=6)Tab.2 Inhibition of Hela by morusin(,n=6)
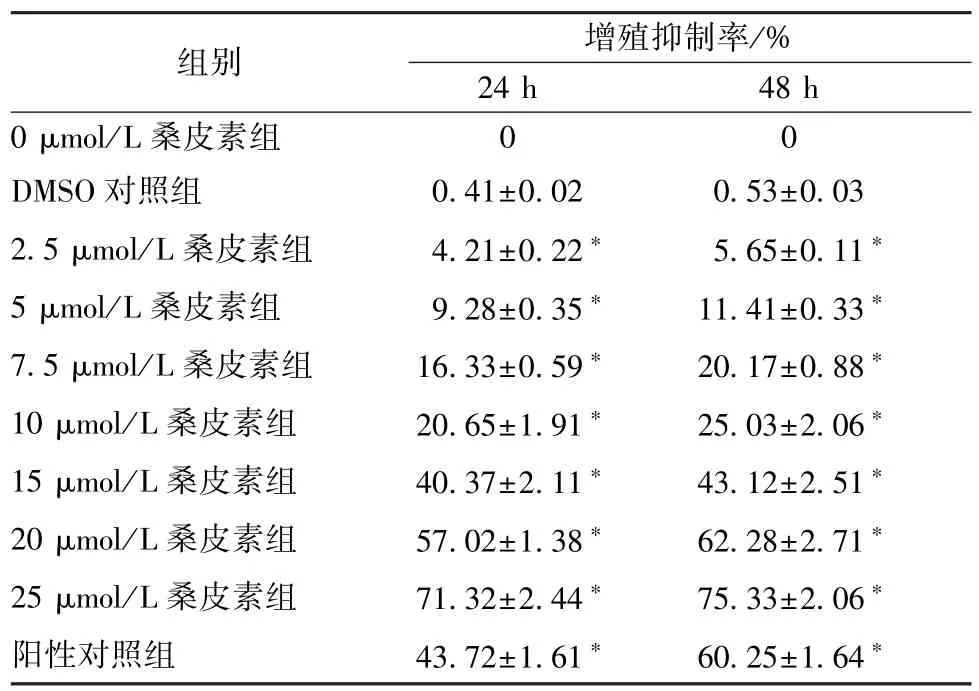
表2 桑皮素对Hela 细胞的抑制作用(,n=6)Tab.2 Inhibition of Hela by morusin(,n=6)
注:与同一时间DMSO 对照组比较,∗P<0.05。
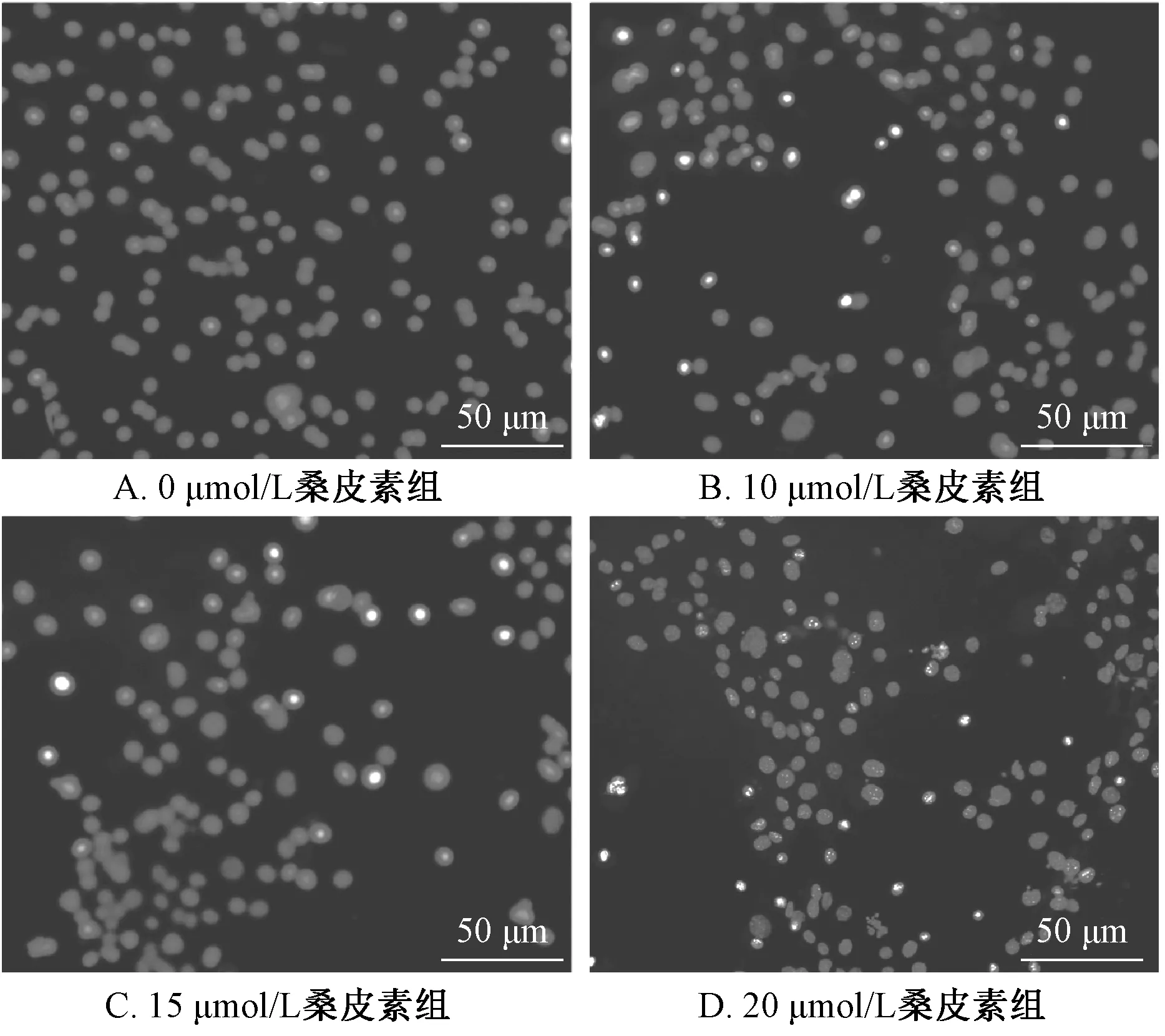
图5 不同浓度桑皮素对Hela 细胞早期凋亡的影响Fig.5 Effects of different concentrations of morusin on early apoptosis of Hela cells
3.4 Western blot 检测Hela 细胞凋亡相关蛋白的表达 不同浓度桑皮素(10、15、20 μmol/L)处理Hela 细胞24 h,与0 μmol/L 桑皮素比较,桑皮素(10、15、20 μmol/L)能显著抑制Hela 细胞中Bcl-2 蛋白表达,促进Bax 蛋白表达(P<0.05);15 μmol/L桑皮素作用Hela 细胞24、48 h,Hela 细胞中Bcl-2 蛋白下调,Bax 蛋白表达上调(P<0.05)。见表3~4、图6。
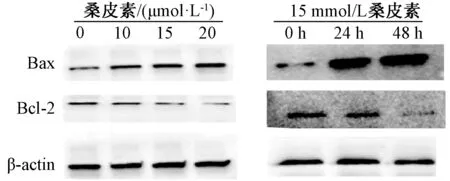
图6 Western blot 检测桑皮素作用Hela 细胞后Bcl-2、Bax 蛋白表达Fig.6 Protein expressions of Bcl-2 and Bax in Hela cells treated with morusin by Western blot
表3 不同浓度桑皮素对Bcl-2、Bax 蛋白表达的影响(,n=3)Tab.3 Effects of different concentrations of morusin on the expressions of Bcl-2 and Bax proteins(,n=3)
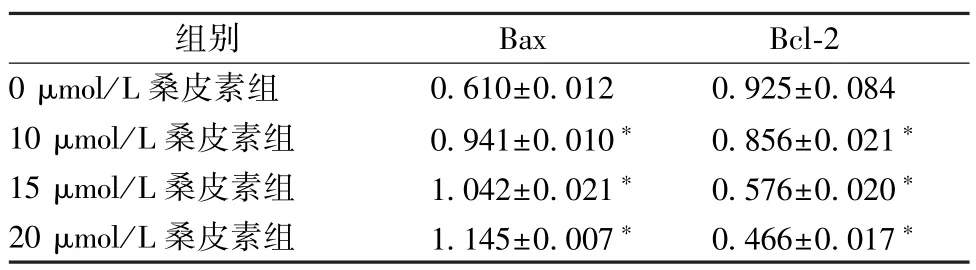
表3 不同浓度桑皮素对Bcl-2、Bax 蛋白表达的影响(,n=3)Tab.3 Effects of different concentrations of morusin on the expressions of Bcl-2 and Bax proteins(,n=3)
注:与0 μmol/L 桑皮素组比较,∗P<0.05。
表4 15 μmol/L 桑皮素处理Hela 细胞不同时间对Bcl-2、Bax 蛋白表达的影响(,n=3)Tab.4 Effects of 15 μmol/L morusin treatment to Hela cells at different times on the expression of Bcl-2 and Bax proteins(,n=3)
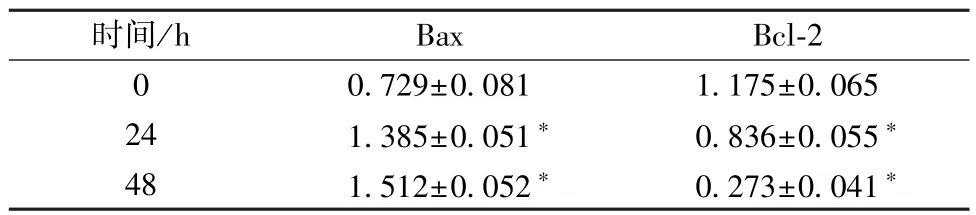
表4 15 μmol/L 桑皮素处理Hela 细胞不同时间对Bcl-2、Bax 蛋白表达的影响(,n=3)Tab.4 Effects of 15 μmol/L morusin treatment to Hela cells at different times on the expression of Bcl-2 and Bax proteins(,n=3)
注:与0 h 比较,∗P<0.05。
3.5 qRT-PCR 检测Hela 细胞Bcl-2、BaxmRNA 表达 不同浓度桑皮素(0、10、15、20 μmol/L)处理Hela 细胞24 h,与0 μmol/L 桑皮素比较,桑皮素(10、15、20 μmol/L)上调BaxmRNA 表达,下调Bcl-2 mRNA 表达(P<0.05),见表5。
表5 不同浓度桑皮素对Bcl-2、 Bax mRNA 表达的影响(,n=3)Tab.5 Effects of different concentrations of morusin on the expressions of Bcl-2 and Bax mRNA(,n=3)
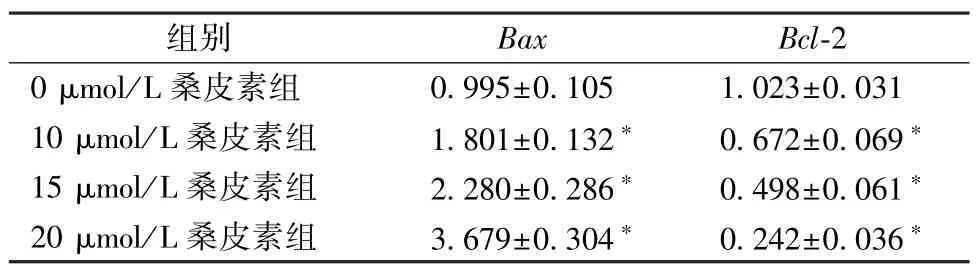
表5 不同浓度桑皮素对Bcl-2、 Bax mRNA 表达的影响(,n=3)Tab.5 Effects of different concentrations of morusin on the expressions of Bcl-2 and Bax mRNA(,n=3)
注:与0 μmol/L 桑皮素组比较,∗P<0.05。
4 讨论
宫颈癌是世界上常见的恶性肿瘤之一,较多发生在欧洲和非洲,临床诊治中宫颈癌的早期症状不甚明显,患者多数表现为中晚期,而且预后效果不好[11]。目前在宫颈癌的常规治疗中,常常以早中期的外科手术治疗为主,同时以中晚期的放疗和化疗为辅助手段[12]。但是宫颈癌大都早期不易发现,而放化疗在治疗的同时对机体又有一定程度的损伤并增加了患者的痛苦。
黄酮类化合物广泛存在于药用植物中,不同的黄酮类化合物都表现出不同的抗肿瘤效果,并且有部分已被用于癌症的治疗中[13]。其中有些黄酮类化合物(如蛇葡萄素)被用于前列腺癌的防治研究并获得不错的效果[14]。异戊二烯基黄酮作为黄酮化合物的一种,具有抑菌、消炎、抗氧化等作用[15]。
桑皮素是从桑树根皮或者枝皮中提取分离得到的,广泛存在于桑树的各个部位中,特别是在桑树的根皮中含有量最高,枝皮中的含有量次之[16-17]。国内外的学者对其做了大量研究,发现桑皮素的药理作用十分丰富,具有抑菌、抗炎及抗病毒等作用,并且具有一定的细胞毒性,对多种癌细胞均有抑制作用[18]。
本实验MTT 结果表明,桑皮素作用Hela 细胞24 h 后,IC50=17.2 μmol/L,且随着桑皮素浓度的提高,效果越明显。镜下观察发现正常组的细胞状态良好呈六棱形,桑皮素组细胞皱缩变圆,贴壁细胞数量相对减少,明显可以看到细胞穿孔的现象,并且随着桑皮素浓度的增高,细胞变化越明显。透射电镜结果显示,15 μmol/L 桑皮素组细胞膜不完整,染色质固缩,细胞器结构损坏,出现许多气穴现象的空泡结构。扫描电镜结果显示,15 μmol/L桑皮素组细胞膜皱缩,细丝状突起断裂,表面呈不规则的块状。
桑皮素作用于癌细胞的重要靶点,抑制肿瘤细胞的生长并诱导其凋亡,最终使癌细胞走向死亡[19]。本实验通过利用Hoechst 单染检测Hela 细胞凋亡,明显地看到随着桑皮素作用浓度升高,核染色逐渐加深,高浓度桑皮素作用下,细胞核裂解。
细胞凋亡与相关基因的表达有关,药物可以通过调控一个或多个基因来诱导癌细胞的凋亡或者坏死。Bcl-2 蛋白家族成员可以通过调控线粒体途径影响细胞凋亡。Bcl-2 家族包括诱导凋亡的蛋白(Bax、Bak、Bid、Bim)以及抑 制凋亡 的蛋白(Bcl-2、Bcl-xL)。当细胞发生凋亡时,Bax 与Bak发生寡聚化,从胞质聚集到线粒体的外膜上,与膜上电压作用打开阴离子通路,使线粒体内的细胞色素C 等凋亡因子等释放到细胞质基质中,引起细胞死亡[20]。
为了验证桑皮素促进Hela 细胞凋亡的分子机制,本实验利用Western blot 和qRT-PCR 实验观察Hela 细胞中Bax、Bcl-2 mRNA 和蛋白的表达。结果表明,桑皮素可能通过促进Bax和抑制Bcl-2 mRNA 和蛋白的表达来诱导宫颈癌Hela 细胞的凋亡,但是其作用机理尚不清楚,仍需要做进一步的研究。综上所述,桑皮素通过升高Bax 因子的表达和降低Bcl-2 因子的表达,从而诱导Hela 细胞发生凋亡。
