基于心脏磁共振探讨左束支传导阻滞对扩张型心肌病患者心脏功能的影响
2020-05-12李陶宇邢军辉邢钰李凌
李陶宇,邢军辉,邢钰,李凌
(郑州大学第一附属医院 心血管内科,河南 郑州 450052)
扩张型心肌病(dilated cardiomyopathy,DCM)约占心肌病的90%,是心肌病中最常见的类型,是全球范围内引起心力衰竭和心脏移植的最常见疾病[1]。其病理表现为受累心肌细胞变性、心肌间质纤维化,累及心脏传导系统时则可发生多种传导阻滞。研究显示,室内传导阻滞可作为DCM患者心源性死亡的强烈独立预测因子[2]。二维超声心动图作为目前最广泛用于评价DCM心脏功能的无创影像工具,易受心肌收缩力及操作者经验的影响,尤其是合并室内传导阻滞时局部心肌收缩不协调,测量值波动较大。随着磁共振技术的普及,心脏磁共振(cardiac magnetic resonance,CMR)可准确评估心脏的结构、功能及纤维化病变,特别是3.0 T磁共振成像具有较高的空间分辨率和良好的可重复性,已成为心脏功能参数测量的“金标准”。本研究基于3.0 T CMR回顾性分析首次入住郑州大学第一附属医院的DCM患者的心脏结构和心功能,探讨左束支传导阻滞(left bundle branch block,LBBB)对DCM的影响。
1 资料与方法
1.1 一般资料回顾性分析2018年1月至2019年2月首次于郑州大学第一附属医院心内科住院并最终诊断为DCM的139例患者,按常规12导联心电图结果分为室内传导正常组(93例)、左前分支传导阻滞(left anterior fascicular block,LAFB)组(17例)、完全性左束支传导阻滞(complete left bundle branch block,CLBBB)组(29例)。DCM诊断标准均符合2018年中华医学会心血管病学分会制定的中国扩张型心肌病诊断和治疗指南[3]。CLBBB的诊断按照Strauss提出的标准[4]。LAFB定义为:电轴左偏大于-45°,Ⅰ导联和avL导联呈qR型或qRs型,Ⅱ、Ⅲ、avF导联呈rS型,SⅢ>SⅡ,QRS波时限<110 ms。本研究中未发现左后分支传导阻滞病例。纳入标准:首次住院并确诊为DCM,且院内可获得可靠的12导联常规心电图及3.0 T CMR的患者。排除标准:(1)非窦性心律者;(2)磁共振检查禁忌或不能配合磁共振检查者;(3)由电解质异常或药物引起QRS波增宽者;(4)已植入心脏永久或临时起搏器者;(5)医学资料缺失者。
1.2 检查方法
1.2.1标准心电图检查 患者院内接受标准12导联心电图检查,测量有效时间>20 s,获得清晰心电图图像后上传至工作站,由两名经验丰富的心电图医生分别独立分析,意见不同时经讨论达成一致。
1.2.2血液生化指标检测 入院后次日采集静脉血2 mL,检测血红蛋白、血钾、白蛋白水平及肾小球滤过率。
1.2.3心脏彩超检查 采用GE Vivid E95彩色多普勒超声诊断仪对患者进行心脏彩超检查,采用M5S心脏探头,探头频率为2.5~3.5 MHz,探测深度为15~17 cm。患者均采取左侧卧位,平静呼吸。将探头置于胸骨旁左心室长轴、心尖四腔心等心脏常规切面,对患者的左右心室内径、左心房内径、室间隔、左心室后壁厚度等进行常规扫查,并测量患者各项心功能指标,包括左心室舒张末期容积(left ventricular end diastolic volume,LVEDV)、左心室收缩末期容积(left ventricular end systolic volume,LVESV)、左心室舒张末期内径(left ventricular end diastolic diameter,LVEDD),记录左心室射血分数(left ventricular ejection fraction,LVEF)。
1.2.4CMR检查 所有患者屏气状态下接受18通道相控线圈的3.0 T磁共振扫描。扫描方法:在自由稳态快速梯度回波序列上(True FISP)从心尖至心底连续成像,获得二腔心及四腔心电影序列,TR 3.2 ms,TE 1.4 ms,翻转角65°,层厚6 mm,层距1.2 mm,同时获得LVEF、LVESV、LVEDV和左心室心肌质量(left ventricular mass,LVM)。以上心功能参数除LVEF外,均通过除以体表面积标准化处理得到对应指数(LVESVI、LVEDVI、LVMI)。延迟强化扫描使用Gd-DTPA对比剂,采用高压注射器经肘静脉推注,推注速度为3 mL·s-1,后用20 mL生理盐水跟注。采用相位敏感翻转恢复序列(PSIR),对比剂注射10~20 min后逐层采集短轴层面,TR 643 ms,TE 2 ms,翻转角20°,层厚6 mm。核磁共振心肌延迟强化(late gadolinium enhancement,LGE)定义为异常心肌组织信号组织≥6倍正常心肌信号强度的标准差,且延伸至局部心室插入区之外。由两名经验丰富医生分别独立分析图像,意见不同时经讨论达成一致。
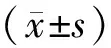
2 结果
2.1 一般资料CLBBB组男性比例低于室内传导正常组和LAFB组,年龄大于室内传导正常组,差异有统计学意义(均P<0.016 7)。各组血红蛋白、血钾、白蛋白、肾小球滤过率水平及高血压、糖尿病比例比较,差异无统计学意义(均P>0.05)。见表1。
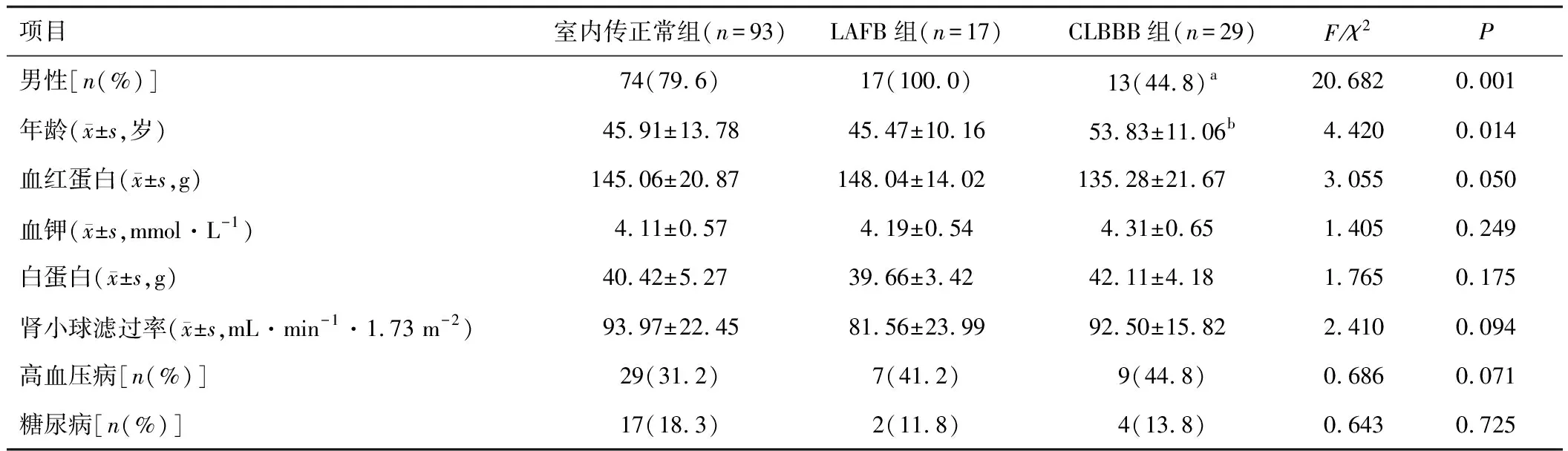
表1 室内传导正常组、LAFB组、CLBBB组一般资料比较
注:与室内传导正常组和LAFB组比较,aP<0.016 7;与室内传导正常组比较,bP<0.016 7;LAFB—左前分支传导阻滞;CLBBB—完全性左束支传导阻滞。
2.2 超声心动图和CMR检查各组经心脏彩超测得的LVEDV、LVESV、LVEDD及LVEF比较,差异无统计学意义(均P>0.05)。CLBBB组和LAFB组经CMR测得的LVEF均低于室内传导正常组,LGE检出率均高于室内传导正常组,且LAFB组LGE检出率高于CLBBB组,CLBBB组LVESVI大于室内传导正常组,差异有统计学意义(均P<0.016 7)。3组测得的LVEDVI及LVMI比较,差异无统计学意义(均P>0.05)。见表2。

表2 室内传导正常组、LAFB组、CLBBB组心功能比较
注:与室内传导正常组比较,aP<0.016 7;与CLBBB组比较,bP<0.016 7;LAFB—左前分支传导阻滞;CLBBB—完全性左束支传导阻滞;LVEDV—左心室舒张末期容积; LVESV—左心室收缩末期容积;LVEDD—左心室舒张末期内径;LVEF—左心室射血分数;LVEDVI—左心室舒张末期容积指数;LVESVI—左心室收缩末期容积指数;LVMI—左心室心肌质量指数;LGE—延迟强化。
3 讨论
DCM的心肌纤维化病变累及左束支及其分支时即可表现为LBBB,约占DCM患者的30%[5]。CMR所获得的左心室结构及功能参数与心脏功能受损程度呈正相关,在心功能的改变中以LVESD和LVEF诊断价值最高[1]。LGE技术可无创识别心肌纤维化,是目前评估心肌纤维化和瘢痕的“金标准”,其对DCM患者的治疗和预后有决定性影响。本研究中LBBB占33.1%,当病变累及左束支主干或同时累及左束支各分支时表现为CLBBB。本研究结果显示,CLBBB患者较一般DCM患者LVESVI和年龄更大,LGE检出率更高;当病变仅累及左前分支时表现为LAFB,本研究显示LAFB患者也较一般DCM患者LVEF更低,LGE检出率更高。
CLBBB为DCM患者最常见的室内传导阻滞形式,发生率高于其他室内传导阻滞类型,并可作为心脏再同步化治疗的重要参考。Derval等[6]用心内电解剖标测系统研究证实了CLBBB独特的心室内激动顺序及潜在的室间隔矛盾运动,致使左心室有效排血量减少,心力衰竭加重。这种异常激活会导致心肌重塑,心脏功能下降,对已患结构性心脏疾病患者可能有害[7]。因此,CLBBB的存在可于疾病早期引起左心室收缩与舒张不协调,表现为LVESV异常、LVEF下降,超声检查易漏诊。与CLBBB不同,LAFB心室大部分在120 ms内除极,QRS复合波不增宽。既往研究指出LAFB可作为多种心脏疾病有价值的临床线索,并可能与心房颤动、心力衰竭与死亡率相关[8],但其合并DCM时常被视为良性改变,治疗中多采用与心室内传导正常的个体一致的方案[9]。但本研究提示LAFB的DCM患者LVEF较室内传导正常者低,原因可能是左前分支细长、单血流供应的解剖学特性,在弥漫性心肌病变如DCM中更易累及,DCM合并LAFB提示纤维化的广泛进展,病程较晚,患者因各种诱因入院时心功能受损严重。
目前关于LGE在DCM中的发生率还无统一认识。既往研究显示其发生率为33%~56%,普遍认为DCM患者一旦出现LGE,则提示预后不良[10-11]。本研究发现CLBBB组 LGE发生率较室内传导正常组高,且LAFB组均发现LGE。原因可能是:左前分支在弥漫性心肌病变中易受累,合并LAFB的DCM患者心肌纤维化广泛,病程相对较晚;合并CLBBB的DCM患者心室收缩不协调及室间隔的矛盾运动引起心脏结构发生重塑,心肌细胞广泛受损。这也提示合并CLBBB或LAFB的DCM患者都应较室内传导正常的DCM患者更加积极的接受治疗。本研究利用LGE定性评估心肌细胞的纤维化病变,但其成像技术原理在一定程度上限制了其在弥漫性心肌病变中的应用,仍需通过T1弛豫时间图及细胞外间质容积分数等新型心肌纤维化定量技术来进一步研究。
综上所述,合并LBBB的DCM患者心脏功能受损更重,心肌纤维化病变更广泛,且相对于常规心脏彩超,CMR能更好地反应LBBB对DCM患者心脏结构、心功能的影响,从而指导临床治疗。
