基于纳米材料改良酶联免疫吸附法的研究进展
2020-05-11张光胤邓放明石星波
张光胤 - 鲁 迨 邓放明 - 赵 倩 石星波 -
(1.食品科学与生物技术湖南省重点实验室,湖南 长沙 410128;2.湖南农业大学食品科学技术学院,湖南 长沙 410128)
酶联免疫吸附(ELISA)是一种基于抗原与抗体的特异性相结合,以及酶催化反应建立的方法,通过酶与抗体或抗原偶联形成酶偶联物,当抗原与抗体特异结合时,酶偶联物催化无色底物分子转化为易于检测的产物(例如有色产物)[1]。通过底物信号的变化可以判断免疫反应是否发生,进而分析目标物(抗原、抗体)的浓度[2]。由于操作简便,检测成本低,高速通量且可以目测预判等优点,ELISA已成为临床诊断、食品质量控制和环境监测等领域公认的标准方法[3]。但这种传统的ELISA检测性能在很大程度上取决于酶的催化活性和负载量。而传统的生物酶耐热性差、保质期短、容易失活等,并且酶负载量有限,导致其检测稳定性与灵敏度较差[4]。
近年来,具有特殊的光、电、磁以及催化性质的新型纳米材料的成功合成为开发新型ELISA法带来了新的机遇。目前,关于改良型ELISA的研究较多[5-6],如利用金纳米颗粒(AuNPs)作为比色信号底物与金纳米棒(AuNRs)酶载体的改良型ELISA。但是,随着基于纳米材料构建的改良型ELISA的迅速发展,相关综述总结其进展尚未见报道。
文章拟聚焦基于纳米材料构建的改良型ELISA,总结其在信号检测模式(如比色法、荧光法、电化学和光热传感)方面的研究进展,对其发展方向以及所面临的挑战进行展望与分析,为ELISA在生物分子检测方面提供新思路。
1 改良型比色ELISA
1.1 基于纳米材料改良信号输出比色ELISA
传统酶底物的颜色响应能力可以满足高浓度目标物的检测需求,但不适用于痕量目标物的高灵敏度检测。纳米材料特殊的光、电、磁以及催化性质,使其可以作为信号底物的替代物,以改善肉眼的视觉感知,适合超灵敏检测。
由于具有较大的摩尔消光系数和很强的局部表面等离子体共振(LSPR)效应,AuNPs可以作为信号底物。其信号的产生主要基于AuNPs的聚集及原位生长。表面修饰的抗体、核酸以及化学配体可以触发金纳米颗粒的聚集。Jiang等[7]构建了辣根过氧化物酶(HRP)介导的碘化物催化的级联反应,以调节AuNPs的分散/聚集。由图1可知,在过氧化氢(H2O2)存在下,通过在抗体上修饰的HRP将碘化物氧化为碘单质,从而发生半胱氨酸诱导的金纳米粒子聚集,使溶液由红色变为蓝色。与基于3,3′,5,5′-四甲基联苯胺(TMB)的ELISA相比,这种级联反应可使肉眼读出的灵敏度提高20倍。此外,Huang等[8]通过氧化氢酶(CAT)调节H2O2浓度介导的AuNPs生长开发的改良型ELISA对赭曲霉毒素A(OTA)表现出极高的灵敏度,检测限为5×10-20g/mL,比常规ELISA(10-11g/mL)低8个数量级。
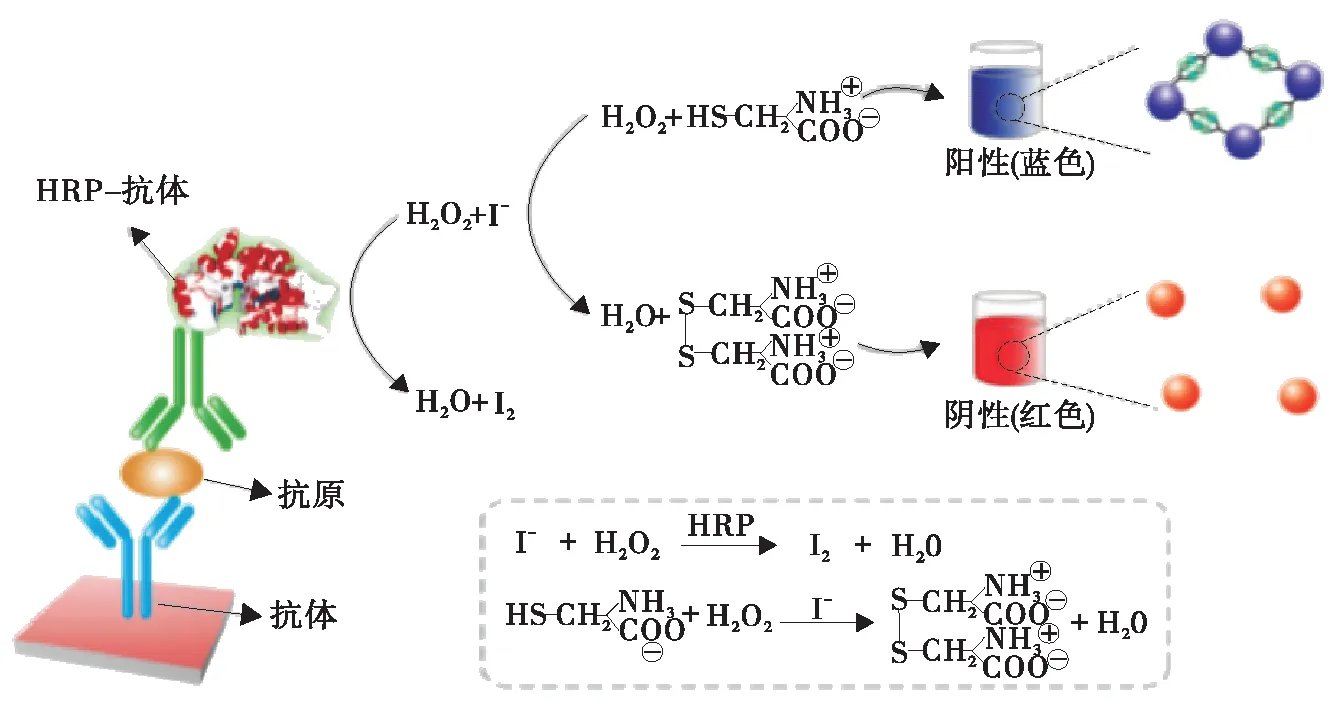
图1 基于HRP介导的AuNPs可视ELISA示意图[7]
与球形AuNPs相比,AuNRs对周围电介质环境的变化反应更加灵敏,且具有更好的呈色性能[9-10]。研究[11]表明,一些氧化剂从AuNRs的末端开始刻蚀,使AuNRs出现不同长宽比以呈现不同的颜色。根据这一现象,AuNRs作为信号输出底物广受研究者的青睐[12]。Ma等[13]利用Fe2+离子充当催化剂,催化H2O2歧化以产生羟基自由基(·OH),进而刻蚀AuNRs,开发了一种用于检测甲胎蛋白(AFP)的改良型ELISA。利用固定在96孔板表面的单克隆抗体捕获抗原(靶分子/蛋白质),过氧化氢酶标记的多克隆抗体与抗原结合,在平板表面形成“抗体—抗原—第二抗体”夹心复合物[图2(a)]。附着在板表面的过氧化氢酶起催化剂作用,催化H2O2分解为水和氧气。在没有AFP的情况下,Fe2+催化H2O2歧化产生·OH刻蚀AuNRs使溶液的颜色为黄色,随着AFP浓度的增加,溶液颜色逐渐由黄色变为无色,再变为粉色、绿色、橙色[图2(b)]。AFP的可视检查动态范围为0~120 ng/mL,可视检测限为5.0 ng/mL。
由于其良好的光学性能,AuNPs、AuNRs、金纳米星(AuNS)[14]、金纳米双锥体(Au NBP)[15]、银纳米颗粒(AgNPs)[16]、三角银纳米棱镜(AgNPR)[17]被作为信号底物以改良比色ELISA。这类纳米材料用于显色底物,其颜色信号输出丰富改善了比色ELISA的可视检测能力和检测灵敏度。
1.2 基于纳米酶的改良型比色ELISA
纳米酶具有易于制备,坚固耐用,稳定性好,可调节催化特性,增强夹心比色法的检测灵敏度和效率等多种优势。这些基于纳米酶的夹心比色法不仅可以检测蛋白质,还有检测其他生物分子的潜在应用空间。基于纳米酶的过氧化物酶活性,Huang等[18]以金纳米簇(AuNCs)作为纳米酶,以AuNPs作为显色底物,设计了一种用于T3甲状腺激素检测的改良型ELISA(图3)。利用AuNCs催化H2O2分解,在HAuCl4存在的情况下,得到不同颜色的AuNPs。该传感器拥有超高的灵敏度,实现了T3甲状腺激素的痕量检测,检测限为2.0×10-15mg/mL。此类改良型ELISA不但简化了系统,还降低了成本,利于实际应用。

图2 基于AuNRs构建的改良型ELISA示意图[13]
Figure 2 Schematic diagram of improved ELISA based on AuNRs
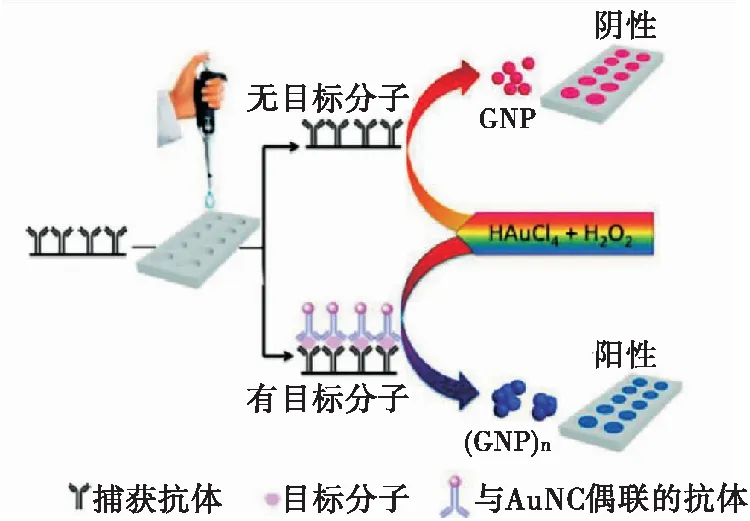
图3 T3甲状腺激素检测示意图[18]
Figure 3 Schematic diagram of T3 thyroid hormone detection
此外,基于AgNPs的比色传感器具有更高的消光系数和更低的价格等优势[19-20],已被广泛用于生物分子的比色测定。Chen等[21]利用3D-MnO2-PEG纳米花和4-巯基苯甲酸与三聚氰胺改性的银纳米颗粒(4-MBA-MA-AgNPs)设计了一种改良型ELISA,用于检测肠道病毒71型(EV71)(图4)。采用3D-MnO2-PEG代替酶,并修饰抗体;捕获目标物后,利用VC还原3D-MnO2-PEG,释放Mn2+;加入4-MBA-MA-AgNPs,通过Mn2+聚集AgNPs,溶液颜色和紫外—可见光谱发生变化,通过还原反应释放Mn2+以提高检测灵敏度。
2 改良型荧光ELISA
Albert等[22-23]提出了荧光免疫概念,并应用于肺炎球菌的检测。近年来,基于新型荧光纳米材料的改良型ELISA和荧光免疫测定(FELISA)引起了研究人员的广泛关注。由于量子点(QD)特有的光学特性、高光稳定性以及尺寸和形状可调等优点,引起了研究人员对提高FELISA灵敏度的关注[24-26]。Xu等[27]基于CAT调控的CdTe QD荧光转换,开发了一种竞争型FELISA,用于检测伏马毒素B1(FB1)(图5)。巯基丙酸修饰的CdTe量子点(MPA-QD)的荧光被H2O2淬灭,CAT作为竞争性抗原的载体,调节H2O2的浓度实现对目标物的检测。若体系中不存在FB1,CdTe QD的荧光被H2O2猝灭;若样品中存在FB1,则体系中存在CAT,H2O2被分解,CdTe QD的荧光不会被猝灭。检测限为0.33 ng/mL,为基于HRP的传统ELISA的1/15。
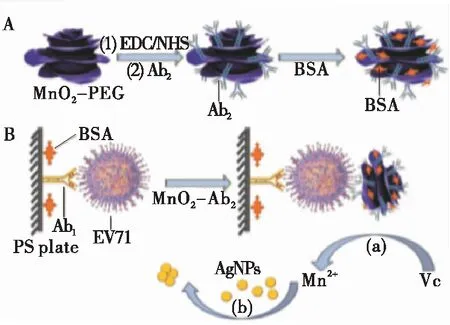
图4 EV71的免疫测定示意图[21]
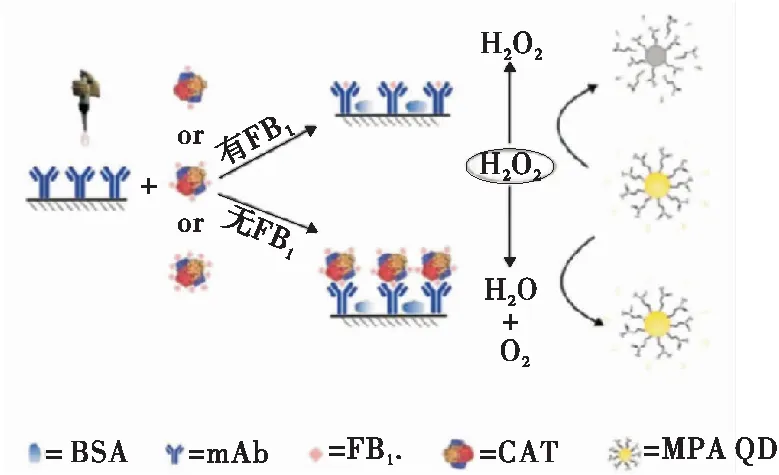
图5 ELISA检测FB1示意图[27]
作为新兴材料,碳点(CDs)具有易于合成、成本低、无毒和良好的生物相容性等优点,其荧光特性和过氧化物酶特性被广泛用于免疫测定[28-31]。Dong等[32]利用CDs的荧光特性和MnO2NSs的淬灭特性,建立了一种新型的FELISA。该方法中荧光CDs和MnO2NSs通过静电吸附结合,由于CDs和MnO2NSs之间的荧光能量转移(FRET),CDs的荧光被淬灭。碱性磷酸酶(ALP)催化抗坏血酸2-磷酸酯(AAP)水解产生的AA可将MnO2NSs还原为Mn2+,释放CDs。基于这种荧光“开启”机制,FELISA实现了金刚烷胺的检测,检测限达0.035 ng/mL。此外,利用CDs的荧光特性与过氧化物酶特性,开发了一种结合荧光与比色的改良型ELISA法用于检测AFP[29](图6)。将CDs与抗AFP抗体(Ab2)通过戊二醛胺—胺偶联,当AFP存在时,加入Ab2后形成夹心复合物。基于CDs的荧光特性,夹心免疫复合物的荧光强度与AFP浓度呈正相关,检测范围为0~350 ng/mL,R2为0.995。而传统免疫分析使用HRP的R2为0.964,荧光素异硫氰酸酯(FITC)的R2为0.973,表明CDs具有很大的潜力,可用于免疫分析的生物标记。
Tan等[33]将Pd-Ir纳米立方体作为纳米酶及CDs信号读出底物有机结合,开发了检测心肌肌钙蛋白I(cTnI)的FELISA(图7)。在H2O2存在的情况下,纳米酶催化邻苯二胺(OPD)转化为其氧化物(Ox-OPD),在400 nm激发波长下,570 nm处有发射峰,Ox-OPD可吸附于CDs表面上,猝灭CDs的荧光。在cTnI存在的情况下,Ox-OPD在570 nm处的荧光峰增加,同时CDs在450 nm处的荧光峰减少,从而形成比例荧光信号用于cTnI的定量,FELISA的检测限为0.31 pg/mL。同理,Zhu等[34]利用Au@Pt纳米材料作为OPD氧化的纳米酶,Ox-OPD的颜色变化实现了比色检测,而双发射峰的荧光变化实现了cTnI的荧光检测。因此,纳米酶和纳米底物共同构建的FELISA可为生物分子检测提供准确、灵敏的免疫测定。
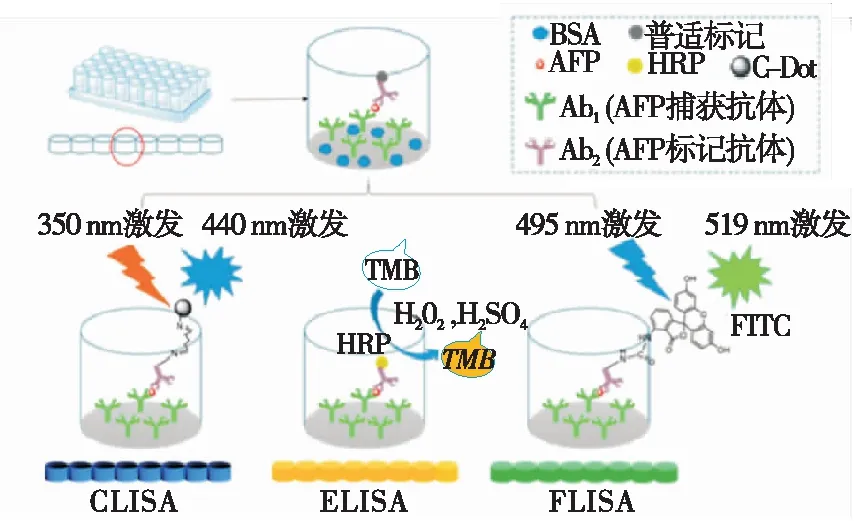
图6 免疫吸附示意图[29]
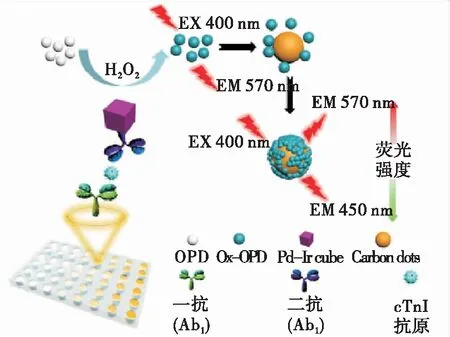
图7 基于Pd-Ir纳米酶与CDs的荧光免疫测定示意图[33]
Figure 7 Schematic diagram of fluorescent immunoassay based on Pd-Ir nanozyme and CDs
3 其他改良型ELISA
近年来,除比色法和荧光法外,还探索了其他方法来改良ELISA,如电化学免疫测定(ECLISA)、光热效应技术(PTE)、表面增强拉曼散射技术(SERS)和化学发光免疫测定(CLIA)。这些技术与ELISA结合可得到更加灵敏和便捷的方法,满足痕量检测与降低成本的要求。
3.1 基于电化学免疫分析的改良型ELISA
作为快速现场检测中最有前途的方法,电化学免疫测定法既具有电化学传感器价格低廉、携带方便、灵敏度高,又具有免疫分析工具便于操作和高选择性,弥补了传统ELISA灵敏度不足、背景高和成本高的缺陷[35-37]。纳米级PbS胶体(PbS CSs)被成功应用于新型ECL ELISA的构建,实现了人附睾蛋白4(HE4)的超灵敏检测[38]。将修饰了抗体的富勒烯—壳聚糖(C60-Chit)纳米复合物固定于玻璃碳电极(GCE),扩大了Pb2+的检测灵敏度;夹层结构形成后,可从PbS CSs释放的Pb2+侧面反映HE4的浓度,其检测限为3.4 fg/mL。Knopp等[39-41]开发了一种基于气体的非接触式电化学生物传感器,实现了传感器的重复使用,还提高了精度、稳定性和可重复性。将氢(H2)和钯(Pd)纳米材料结合,构建了基于气体的电化学生物传感器,H2与Pd反应形成PdHx,增加Pd电阻。氧气的干扰是传感器的固有局限性,为了减轻氧对灵敏度的影响,Knopp等[42]构建了一种改良的ELISA传感平台。以包裹在Pd纳米线表面的沸石咪唑盐骨架(ZIFs-67)作为检测探针,与抗AFP抗体偶联用于AFP检测,由于氧不能透过ZIFs-67,其检测限达0.04 ng/mL[43]。
3.2 基于光热效应的改良型ELISA
近年来,光热纳米材料的光热效应(PTEs)是改良型ELISA的研究热点之一[44-45],以光热纳米材料为基础已开发了使用普通温度计对目标进行定量读取的光热免疫测定法(PTIA)[46]。同时,使用温度计作为信号读出系统的改良型ELISA也得到了广泛发展,如将Fe3O4NP锚定在功能化的氧化石墨烯上并偶联DNA制备成检测探针,无目标物PSA时,DNA与PSA适配体之间的杂交反应捕获信号探针,Fe3O4NP转化为普鲁士蓝纳米颗粒(PB),通过808 nm激光辐照将生物信号转化为热信号,实现PSA定量检测,检测限为0.31 ng/mL[47]。Jiao等[48]利用Au@Pt纳米枝晶介导的多模信号输出,开发了一种改良型ELISA。基于其过氧化物酶活性实现了比色及荧光信号读出,同时因Au@Pt较强的光热效应,实现了808 nm照射下的热信号读出,完成了cTnI的定量免疫分析
3.3 基于表面增强拉曼散射的改良型ELISA
基于表面增强拉曼散射(SERS)的技术具有抗光漂白、较少的背景干扰、高灵敏度以及较好的稳定性[49]。这些优势使SERS在生物学分析中具有潜在的应用前景[50-53]。近年来,Yang等[54]将SERS技术与ELISA结合,开发了一种改良型ELISA检测PSA。该方法利用Cu2-xSySe1-y纳米颗粒作为纳米酶,催化C≡C—PEG2CH2CH2NH2和N3—PEG3—CH2CH2NH2的点击化学反应,有效避免了光漂白以及背景对结果的影响。Su等[55]利用结合了AuNPs的共价有机骨架(COF)复合材料作为纳米酶,催化4-硝基苯硫酚(4-NTP)还原转化为4-氨基硫酚(4-ATP),构建了一种新型SERS-ELISA。在NaBH4存在的情况下,新产生的4-ATP与AuNS触发了拉曼信号“开启”实现了β-乳球蛋白的高灵敏检测,其检测限达0.01 ng/mL。
3.4 基于化学发光免疫分析的改良型ELISA
化学发光免疫测定(CLIA)是基于底物吸收化学反应产生的能量转化为化学发光的方法[56-57]。由于其背景干扰小,能有效避免背景光和光漂白,具有高灵敏度和宽线性范围的优点,已广泛应用于生物传感器和生物医学检测领域[58-59]。Yang等[60]利用亲和素化的磁纳米颗粒(SA-MNP)开发了一种CLIA方法。在兔免疫球蛋白(rIgG)存在的情况下,加入K4Fe(CN)6使磁颗粒表面生成PB,提高了PB过氧化物酶样活性,使鲁米诺的CL信号增强,且CL强度与rIgG的浓度呈正相关,其检测限分别为0.28 ng/mL,0.044 pmol。
4 总结与展望
文章简要分析了传统ELISA作为检测手段的局限性,重点总结了近年来基于纳米材料开发的改良型ELISA方法。其中,以贵金属纳米材料(如金纳米颗粒、金纳米棒、银纳米颗粒等)作为底物输出多色信号的策略已在很大程度上提高了比色ELISA的肉眼检测能力和检测灵敏度。以纳米酶替代传统生物酶为特点的新型ELISA不仅弥补了传统ELISA中酶的耐热性差、保质期短、容易失活的缺陷,也为提高测定灵敏度和稳定性,缩短测定时间等方面提供了解决思路,且检测策略相对简单、价格便宜,展现出了较大的应用前景。
虽然各种改良型ELISA在临床医学、环境测量和食品行业中广泛应用,但对改良型ELISA的研究还存在以下不足:
(1)纳米底物的引入很大程度上提高了比色ELISA的检测灵敏度,但对于分析物浓度的微小变化导致的色度变化还难以区分。因此,提高纳米底物对微小浓度变化的响应能力,制备出响应性能更佳,选择性更好的纳米底物,将是未来一个重要的研究方向。
(2)基于荧光的ELISA已被广泛应用于改良型ELISA,且具有较高的灵敏度,但在如何克服其他基质背景干扰,荧光探针的光漂白现象,以及荧光涨落及淬灭现象方面需进一步开发研究。
(3)新兴的信号(电化学信号、光热效应、表面增强拉曼和化学发光)有足够的稳定性、准确性、较高的灵敏度以及低背景信号的优点,但其策略相对复杂,需要特定的设备与专业人员的操作,不能满足现场快速检测的要求。若能与智能手机,便携式、高分辨率检测器结合使用,有望实现便携式信号读取,进而满足现场即时检测需求。
