3种藜麦发芽过程中生物活性物质及其抗氧化活性的变化规律
2020-05-11陈益胜舒蓝萍徐学明陈宗振洪婷婷黄彩虹陈启飞金亚美
陈益胜 - 舒蓝萍 - 徐学明 -1, 陈宗振 - 洪婷婷 - 黄彩虹 - 卫 晓 陈启飞 - 金亚美 -
(1.江南大学食品科学国家重点实验室,江苏 无锡 214122;2.江南大学食品学院,江苏 无锡 214122;3.连云港麦泽福食品有限公司,江苏 连云港 251111)
藜麦(ChenopodiumquinoaWilld.)属藜科,双子叶植物。其种子呈扁平圆形状,直径约1.5~4.0 mm。根据藜麦种子天然色素(花青素或原花青素)种类和含量的不同,可分为白色、红色和黑色3种类型。藜麦的各种营养成分全面且均衡,是目前已知的唯一一种能独立供给人类正常营养需要的谷物;藜麦不含麸质和类麸质蛋白[1],不会引起过敏;因其富含皂苷、黄酮、蜕皮激素、γ-氨基丁酸等生物活性物质,常期食用可提高免疫力、降低患慢性疾病(心血管疾病、糖尿病、癌症等)的风险[2]。为了宣传藜麦的优点和重要性,联合国粮农组织将2013年定为“国际藜麦年”[3]。藜麦不仅营养价值高且能在土壤盐碱、酸性、干旱等各种胁迫条件下生长[4],特别适宜中国西北高原地区的农业环境。
发芽处理已成为谷物精深加工的一种重要手段。发芽是指种子吸水至一定程度,种子内淀粉酶和蛋白酶等内原酶被激活,淀粉、纤维和蛋白质等被水解成小分子,种子的物理和生化特性发生显著变化的生理生化过程[5]。发芽在提高谷物营养价值、改善理化特性的同时,降低了种子的抗营养因子含量[6]。目前,发芽作为一种加工手段已很好地应用于糙米且取得了一定的成果,如发芽糙米面包[7]、糙米饭[8]等。此外,课题组[9]前期研究表明,发芽还可以显著提高薏米中γ-氨基丁酸、谷维素和VE等重要生物活性物质的含量。冯焕琴等[10]研究了藜麦中的生物活性物质含量,但藜麦发芽过程中生物活性物质含量的变化尚未见报道。试验拟以红、黑、白3种主要藜麦的种子为原料,通过测定不同发芽时间段藜麦种子中的γ-氨基丁酸、表儿茶素、表没食子儿茶素没食子酸酯、皂苷、总酚含量,以及发芽期间藜麦种子的抗氧化性,研究其萌发过程中营养物质和理化性质的动态变化,旨在促进藜麦产品精深加工发展,提高其产品的经济价值。
1 材料与方法
1.1 材料与仪器
秘鲁黑藜麦、红藜麦、白藜麦:市售;
DPPH、γ-氨基丁酸、齐墩果酸、表儿茶素、表没食子儿茶素没食子酸酯:分析纯,美国Sigma公司;
福林酚、没食子酸:分析纯,百灵威试剂公司;
恒温恒湿箱:LHS-80HC-1型,上海一恒科学仪器有限公司;
冻干机:77530-30L型,照生有限公司;
高速粉碎机:600Y型,永康市铂欧五金制品有限公司;
氨基酸自动分析仪:835-50型,日本日立公司;
旋蒸仪:RE-52型,上海亚荣生化仪器厂;
高效液相色谱:Agilent 1100型,美国安捷伦公司;
紫外—可见分光光度计:TU-1900型,北京普析通用仪器有限公司。
1.2 试验方法
选择籽粒饱满、无霉烂和病虫害的完整的黑、红、白藜麦种子,在0.1%的NaClO溶液中浸泡30 min,用去离子水洗涤3次后,于25 ℃遮光条件下浸泡12 h,将浸泡后的藜麦种子置于培养皿上,于温度25 ℃、湿度90%的恒温恒湿箱中避光发芽。分别在发芽的0,12,24,36,48,60,72 h取样,样品冻干、粉碎、过筛后储存于-20 ℃环境中备用。
1.3 检测方法
1.3.1γ-氨基丁酸(GABA)的测定 参照文献[11]。
1.3.2 表儿茶素的测定 准确称取2.0 g发芽藜麦于100 mL锥形瓶中,加入50 mL 75%甲醇,室温下超声提取40 min,4 000 r/min离心10 min,收集上清液过0.45 μm微孔滤膜,定容于50 mL容量瓶中。采用HPLC系统对表儿茶素含量进行分析,HPLC系统选用C18柱,检测波长280 nm,柱温30 ℃,流动相为乙腈—0.5%乙酸,进样量10 μL。
1.3.3 表没食子儿茶素没食子酸酯的测定 准确称取2.0 g发芽藜麦于100 mL锥形瓶中,加入50 mL 75%甲醇,室温下超声提取40 min,4 000 r/min离心10 min,收集上清液过0.45 μm微孔滤膜,定容于50 mL容量瓶中。采用HPLC系统对表没食子儿茶素没食子酸酯含量进行分析,HPLC系统选用C18(250 mm×4.6 mm,5 μm)柱,流动相为甲醇∶水∶乙酸=23∶75∶2,流速1.0 mL/min,检测波长276 nm,柱温24 ℃,进样量10 μL。
1.3.4 皂苷的测定 参照文献[12]。
1.3.5 总酚含量的测定 参照文献[13]。
1.3.6 体外抗氧化性的测定
(1)DPPH自由基清除能力:将200 μL适当稀释的样品加入到3.8 mL 60 μmol/L DPPH溶液中,室温下黑暗处反应60 min,于517 nm处测定吸光值。以甲醇溶液代替样品作空白对照,按式(1)计算DPPH自由基清除率。
(1)
式中:
R——DPPH自由基清除率,%;
A——样品与DPPH溶液反应后的吸光值;
B——空白对照(甲醇溶液)与DPPH反应后的吸光值;
(2)铁离子还原能力(FRAP):参照文献[14]。
1.4 数据处理
所有试验重复3次,采用SPSS 20.0软件进行数据统计方差分析,结果以(均值±SD)表示。采用LSD法对试验结果进行显著性分析,P<0.05时表明存在显著性差异。
2 结果与分析
2.1 γ-氨基丁酸含量的变化
γ-氨基丁酸(GABA)是一种广泛存在于动物和植物中的非蛋白氨基酸,是动物体内不可或缺的抑制性神经递质[15]。研究[16]表明,GABA在调节血压、减轻焦虑、延缓记忆力衰退等方面有一定的促进作用。发芽是富集GABA的重要手段之一,杨天等[17]研究发现发芽可使花生的GABA含量增加14.99倍;张颖等[18]研究发现通过金属离子胁迫萌发富集的小米糙米中的GABA含量可高达24.71 mg/100 g。由图1可知,当发芽时间为0~48 h时,黑藜麦和红藜麦的GABA含量均随发芽时间的延长而增加,其中黑藜麦的GABA含量在发芽第48 h时达最大值,为未发芽时的7.10倍;当发芽时间为60 h时,红藜麦的GABA含量相较于第48 h时有所下降,但在发芽第72 h时达最大值157.4 mg/100 g,为未发芽时的6.47倍;当发芽时间为0~48 h时,白藜麦的GABA含量有所降低,可能是GABA转氨酶的酶活强于GABA合成的限速酶谷氨酸脱羧酶的酶活,但在发芽第60 h时大幅度增加,在发芽第72 h时达最大值,为未发芽时的6.40倍。发芽使得3个品种藜麦的GABA含量均有大幅度的增加,可能是由萌芽激活了谷氨酸脱羧酶引起的[19]。
2.2 表儿茶素含量的变化
表儿茶素是存在于植物中的含有多羟基的天然多酚物质,多羟基结构使其具有优越的抗氧化能力[20]、抗炎作用[21]和抗肿瘤[22]等功能。由表1可知,未发芽藜麦中的表儿茶素含量为2.81~6.31 mg/100 g,发芽处理使藜麦中的表儿茶素含量增加,最高可达26.36 mg/100 g。黑藜麦的表儿茶素含量随发芽时间的延长先增加后减少,在发芽第48 h时达最大值(26.36 mg/100 g),为未发芽时的7.11倍;红藜麦的表儿茶素含量随发芽时间的延长先减少再增加,在发芽第12 h时达最大值(17.77 mg/100 g);白藜麦的表儿茶素含量随发芽时间的延长先减少后增加,在发芽第60 h时达最大值(14.68 mg/100 g),为未发芽时的1.32倍。表儿茶素含量变化主要由CH4、CHI、PAL等主要代谢酶的酶活在萌芽过程中的变化所引起[23]。
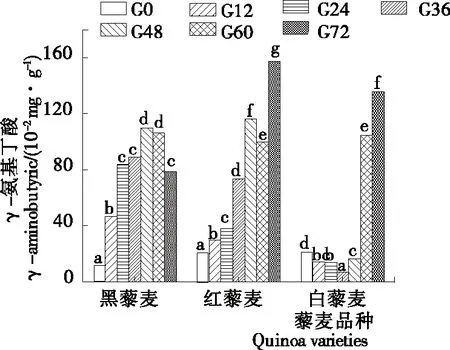
字母不同表示差异显著(P<0.05)
Figure 1 The content ofγ-aminobutyric acid changed during the germination of quinoa
表1 藜麦发芽过程中表儿茶素含量的变化†
Table 1 The content of epicatechin changed during the germination of quinoa mg/100 g
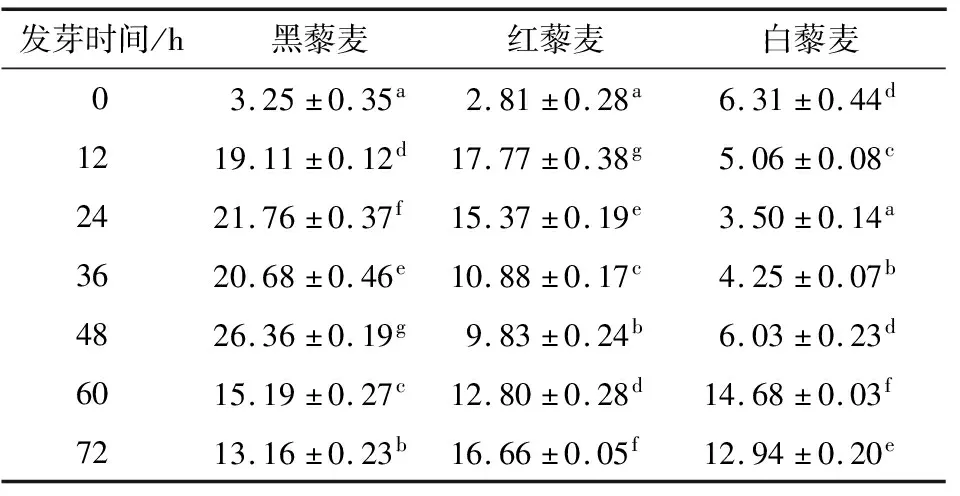
发芽时间/h黑藜麦红藜麦白藜麦03.25±0.35a2.81±0.28a6.31±0.44d1219.11±0.12d17.77±0.38g5.06±0.08c2421.76±0.37f15.37±0.19e3.50±0.14a3620.68±0.46e10.88±0.17c4.25±0.07b4826.36±0.19g9.83±0.24b6.03±0.23d6015.19±0.27c12.80±0.28d14.68±0.03f7213.16±0.23b16.66±0.05f12.94±0.20e
† 同行字母不同表示差异显著(P<0.05)。
2.3 表没食子儿茶素没食子酸酯含量的变化
袁悦等[24]发现没食子酸脂(EGCG)能延缓肌原纤维蛋白的变性和降解程度,延缓鱼糜氧化变质程度,有望成为一种新型的鱼糜抗冻剂;李洋等[25]发现不同浓度EGCG处理对黄瓜种子萌发、主根伸长及侧根的发生具有一定的浓度效应。由图2可知,未发芽的黑、红、白3种藜麦间EGCG含量差异不大。红藜麦的EGCG含量随发芽时间的延长而不断升高,在发芽第72 h时达最大值17.14 mg/100 g。黑藜麦的EGCG含量随发芽时间的延长先降低后增加,在发芽第48 h时达最大值23.81 mg/100 g。白藜麦的EGCG含量变化与黑藜麦的类似,呈先降低后增加的变化趋势,白藜麦的EGCG含量在发芽第72 h时达最大值17.61 mg/100 g。植物代谢中,EGCG的上一级代谢产物为表没食子儿茶素[26],因此可通过测定藜麦萌发过程中表没食子儿茶素含量以及表没食子儿茶素转化成EGCG反应中限速酶酶活的变化,探究藜麦发芽过程中EGCG含量变化的机理。
2.4 皂苷含量的变化
藜麦皂苷主要以三萜皂苷形式存在于种皮中,其含量为0.14%~2.30%。藜麦皂苷主要为齐墩果酸型、常春藤型、商陆酸型等[27]。由图3可知,3种藜麦的初试皂苷含量为4.3~5.1 mg/g,与黄金等[28]的研究结果(5.56 mg/g)基本一致。黑藜麦与红藜麦的皂苷含量均随发芽时间的延长而增加,白藜麦的皂苷含量变化波动但较不显著。黑藜麦的皂苷含量随发芽时间的延长而增加,在发芽第72 h时达最大值(13.44 mg/g),比未发芽时的增加了204.76%;红藜麦的皂苷含量除发芽第24 h与第12 h相比有所降低外整体呈上升趋势,在发芽第60 h时达最大值(8.96 mg/g),比未发芽时的增加了106.23%;白藜麦的皂苷含量变化整体呈先降低后增加趋势,在第36 h时达最低值(3.73 mg/g),在第72 h时达最大值(5.72 mg/g),比未发芽时的增加了11.39%。藜麦发芽过程中皂苷含量的增加,可能是不同酶系统的合成和激活促进了皂苷的生成,也可能是种子结构的弱化增强了溶剂提取过程[29]。
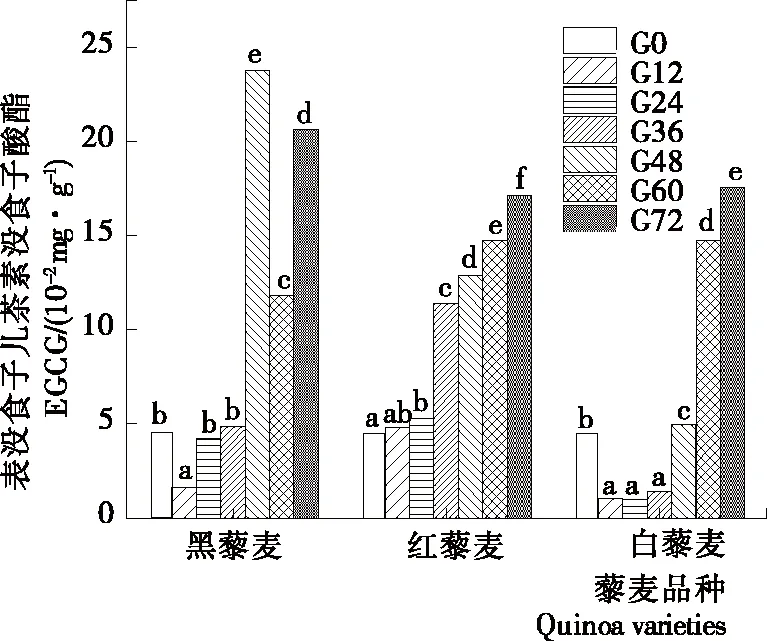
字母不同表示差异显著(P<0.05)
Figure 2 The content of epigallocatechin gallate changed during the germination of quinoa
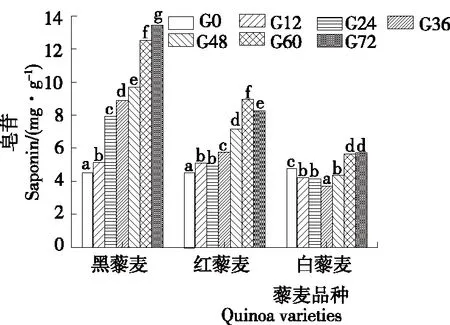
字母不同表示差异显著(P<0.05)
Figure 3 Changes of saponins content during germination of quinoa
2.5 总酚含量的变化
由图4可知,黑藜麦、红藜麦、白藜麦的总酚含量变化大体一致,均随发芽时间的延长而增加。黑藜麦的总酚含量在发芽过程中增加较均匀;红藜麦的总酚含量发芽前60 h增加幅度较小,在发芽第72 h时迅速增加;白藜麦的总酚含量虽然也呈递增趋势但整体变化幅度不大。未发芽时,藜麦的总酚含量为1.2~1.4 mg GAE/g,三者总酚含量均在发芽第72 h时达最大值,分别比未发芽时增加了2.37,2.32,1.06倍。韩雅盟等[30]研究发现深色藜麦的酚类物质及其抗氧化活性更高,且认为藜麦发芽过程中总酚含量增加是苯丙氨酸转氨酶和细胞壁过氧化物酶等酶活性增加所引起的。
2.6 抗氧化活性的变化
2.6.1 DPPH自由基清除能力 由图5可知,3种藜麦的初试DPPH自由基清除能力存在一定差异,其中最低的为白藜麦(33.04%),黑、红藜麦的DPPH自由基清除率较高,分别为47.71%,51.40%。黑藜麦的DPPH自由基清除能力随发芽时间的延长而递增,在第72 h时达最大值(88.04%),比未发芽时增加了84.53%;红藜麦发芽前60 h时的DPPH自由基清除能力变化无明显差异,在发芽第72 h时大幅度增加至92.61%;白藜麦的DPPH自由基清除能力在发芽前36 h随发芽时间的延长而降低,在第36 h时达最低值,在第60 h时达最大值(40.48%),比未发芽时增加了22.48%。综上,发芽处理可提高谷物的DPPH自由基清除能力,不同颜色藜麦的增幅存在一定差异,与发芽可以增加藜麦的总酚含量有所关联。藜麦的皂苷、表儿茶素、表没食子儿茶素没食子酸酯等含有羟基物质的含量在发芽过程中有所增加,因此藜麦清除DPPH自由基的能力有所增加。
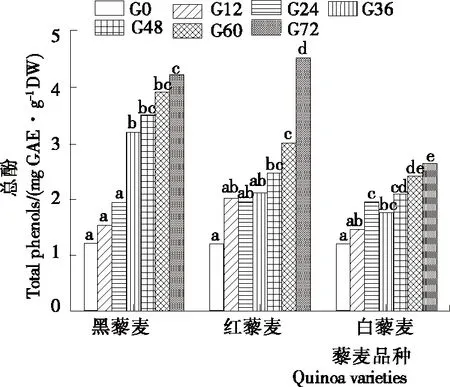
字母不同表示差异显著(P<0.05)
Figure 4 Changes in total phenolic content during germination of quinoa
2.6.2 铁离子还原能力(FRAP) 由图6可知,3种藜麦的铁离子还原能力随发芽时间的延长有不同程度的提高,表明发芽能提高藜麦的抗氧化性。红藜麦的铁离子还原能力在发芽第60 h时达最大值,比未发芽时增加了3.35倍;白藜麦的铁离子还原能力在发芽第72 h时达最大值,比未发芽时增加了1.16倍;黑藜麦的铁离子还原能力在发芽第72 h时达最大值,比未发芽时增加了2.62倍。吴凤凤等[31]研究发现,与未发芽糙米相比,各阶段的发芽糙米甲醇提取物的还原能力皆有不同程度的提高,与试验结果类似。
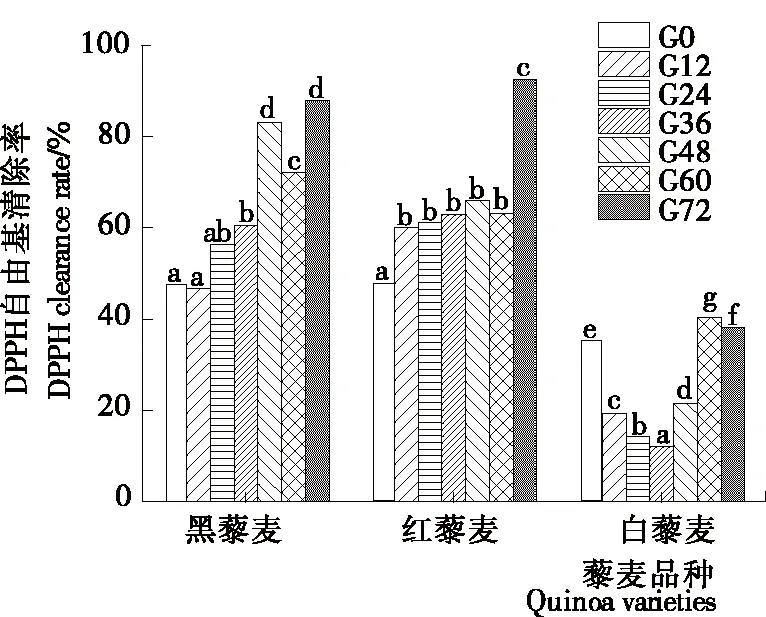
字母不同表示差异显著(P<0.05)
Figure 5 Changes of DPPH clearance rate during the germination of quinoa
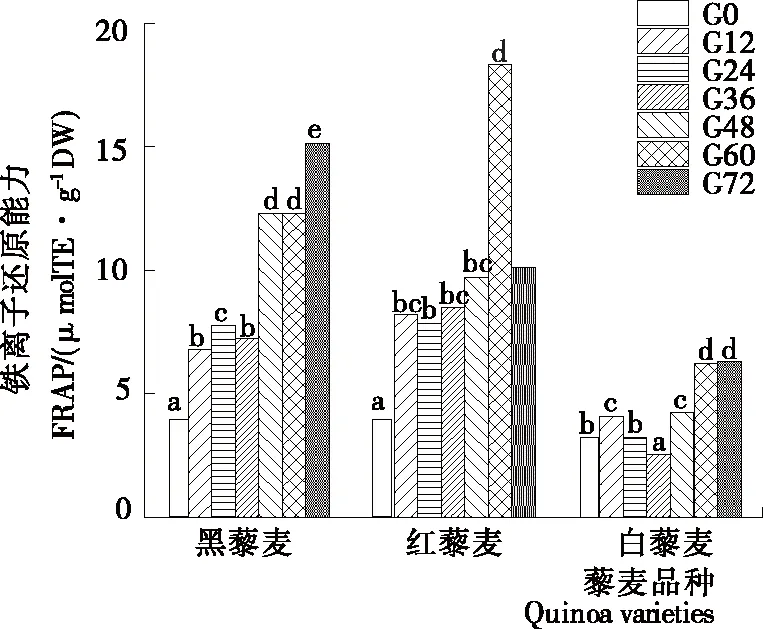
字母不同表示差异显著(P<0.05)
3 结论
黑、红、白3色藜麦经发芽处理后,生物活性成分(γ-氨基丁酸、皂苷、表儿茶素、表没食子儿茶素没食子酸酯和总多酚)含量和体外抗氧化活性(DPPH自由基清除率和铁离子还原能力)均有不同程度的提高,其中白藜麦的变化幅度均小于黑藜麦和红藜麦的。黑藜麦和红藜麦各指标的变化趋势较一致,均随发芽时间的延长而递增。白藜麦发芽过程中各指标含量基本上随发芽时间的延长先降低后升高,升高幅度不大。黑、红、白3种藜麦的最佳发芽终止时间分别为48,72,72 h。后续可探索不同温度与湿度对藜麦发芽的影响,缩短检测的间隔时间,以期找到发芽过程中各种生物活性成分变化的机理。
