穿心莲内酯对大鼠腹腔粘连的抑制作用及其可能机制
2020-05-09周继法
瞿 慧 周继法
(南京中医药大学附属医院药剂科,江苏省南京市 210029,电子邮箱:qurong2011@163.com)
术后腹腔粘连是临床上常见且难以解决的问题。随着腹部疾病发病率的升高和腹腔再手术患者的增多,术后腹腔粘连的发生率越来越高,轻度腹腔粘连发生率可高达80%[1-2]。腹腔粘连不仅会引起腹痛、肠梗阻等并发症,还会增加出血的风险[3-4]。目前,有多种物理方法可用于治疗腹腔粘连,如各种生物相容性材料的使用可以减少粘连的发生,但这些材料的使用方法和技巧要求较高,而且这些物理方法也并不能完全解决粘连问题,且由于缺乏对早期粘连发生机制的了解,目前尚无理想的药物治疗腹腔粘连,因此腹腔粘连的治疗仍是临床难题之一。迫切需要探索有效的药物治疗方法。
通常,腹腔粘连由炎症、腹膜损伤、组织缺血或外来物质的存在引起,其主要病理特征为腹膜间皮细胞脱落、胶原纤维紊乱、纤维蛋白形成和降解不平衡、细胞外基质沉积等[5-7]。研究表明,炎症是腹腔粘连的重要诱发因素,一系列炎性因子可导致腹膜间皮细胞纤溶酶原活性降低[8]。此外,腹膜间皮细胞受损后会产生纤溶酶原激活物抑制物,从而抑制纤溶酶原及永久纤粘连蛋白的形成[9]。各种细胞因子,包括转化生长因子β1(transforming growth factor β1,TGF-β1)、纤连蛋白、结缔组织生长因子(connective tissue growth factor,CTGF),都参与调控纤维蛋白沉积和降解之间的平衡。因此,目前针对腹腔粘连的研究主要集中于炎症因子在病理过程中的作用,以及细胞因子在纤维蛋白沉积和降解中的作用[10-12]。大量体内外实验表明,从草本植物中提取的天然成分可有效地降低腹腔粘连程度[13]。在中医方面,穿心莲内酯(andrographolide,Ad)主要用于减轻内热、解毒、缓解疼痛、减轻炎症反应。由于目前很多含有穿心莲的复方主要用于治疗术后炎症,因此推断其也可用于治疗肠粘连[14],但具体机制尚不清楚。本研究通过建立大鼠腹腔粘连模型,探讨Ad预防腹腔粘连形成的效果及其可能机制。
1材料和方法
1.1 实验动物 60只雄性SD大鼠,月龄10~11个月,体重240~260 g,购自南京医科大学实验动物中心,生产许可证号:SCXK-苏 2014-0001。所有大鼠饲养在23℃~27℃,12 h光、12 h暗循环的环境中。所有的实验操作都在实验动物使用与管理委员会的规定下进行。
1.2 主要实验药品、试剂与仪器 所有化学试剂均为分析纯。Ad(纯度>98.0%)购自美国Sigma公司(批号:365645);白细胞介素(interleukin,IL)-1β、肿瘤坏死因子(tumor necrosis factor,TNF)-α 以及TGF-β1酶联免疫吸附检测试剂盒均购自美国Abcam公司(批号分别为:ab100768、ab46070、ab119558);CTGF 酶联免疫吸附检测试剂盒购自中国优尔生科公司(批号:E90010Ra),IL-18酶联免疫吸附检测试剂盒购自美国GenwayBio公司(批号:GWB-ZZD136)。磷酸化Smad2/3(phosphorylated Smad2/3,p-Smad2/3)抗体(兔抗人多克隆IgG抗体)、Smad2/3抗体(兔抗人多克隆IgG抗体)、Ⅰ型胶原(collagen type Ⅰ,Col-Ⅰ)蛋白兔抗人多克隆单抗IgG抗体、抗兔二抗均购自美国Abcam公司(批号分别为:ab63399、ab63672、ab34710、ab150077),Smad7抗体(兔抗人多克隆单抗IgG抗体)购自英国PL实验室(批号:PL0305198);化学发光剂试剂盒购自加拿大Amersham Biosciences公司(批号:G524000)。XR1离心机、CE-400细胞培养箱和MultiskanTMGO微孔分光光度计均购自美国赛默菲舍尔公司,JXH生物安全柜购自中国苏净公司。
1.3 大鼠腹腔粘连模型的制备及给药方法 所有大鼠在实验前一晚禁食。按照体重将大鼠进行简单随机分组,包括正常对照组、模型组、地塞米松组以及Ad低、中、高剂量组,每组10只。手术操作在无菌环境中进行。麻醉采用氯胺酮(30 mg/kg)和甲苯噻嗪(15 mg/kg)腹腔注射。所有大鼠暴露腹部,剃毛,然后做一2 cm正中切口进腹;用干纱布磨损盲肠浆膜,形成2.5~3.0 cm的创面[15],手术过程不超过20 min。所有动物在术后48 h按照以下方法给药:正常对照组及模型组均腹腔注射生理盐水4 mL/kg,地塞米松组腹腔注射地塞米松10 mg/kg,Ad低、中、高剂量组分别给予20、 40 、80 mg/kg Ad灌胃,1次/d,共给药10 d。
1.4 粘连程度分级 给药结束当天,快速处死所有大鼠并切开腹部,按照Nair等[16]制定的方法对腹腔粘连的严重程度进行分级。腹腔粘连分为0~4级:0级为完全无粘连;1级为内脏间或内脏与腹壁间存在1条粘连带;2级为内脏间或内脏与腹壁间存在2条粘连带;3级为存在2条以上粘连带,但内脏未直接粘连到腹壁;4级为内脏直接粘连到腹壁,不论粘连带多少。在不了解大鼠的分组和处理方法的情况下,由其他人员对粘连的严重程度进行2次独立的评估,2次评估结果不一致时进行第3次评估,最终根据3次评估结果综合判定。
1.5 酶联免疫吸附法检测IL-1β、 IL-18、TNF-α、TGF-β1和CTGF水平 给药结束当天,先腹腔注射生理盐水2 mL,按摩大鼠腹部5 min后用针管吸取液体1 mL,并收集下腔静脉血约0.5 mL,1 200 r/min离心20 min,提取血清并于-80℃保存。用酶联免疫吸附检测试剂盒检测血清IL-1β、 IL-18、TNF-α水平以及腹腔液中TGF-β1和CTGF水平。
1.6 大鼠腹膜间皮细胞的分离和提纯 另取50只无腹腔疾病的SD雄性大鼠进行乙醚麻醉,然后腹腔注射0.25%胰蛋白酶1~2 mL。2 h后尽可能多地收集腹腔液,1 000 r/min离心30 min,收集大鼠腹膜间皮细胞(rat peritoneal mesothelial cell,RPMC)。通过检测角蛋白和波形蛋白进行鉴定,纯度达到90%以上。然后在含有10% 胎牛血清的杜氏改良伊格尔培养基(Dulbecco′s modified Eagle medium,DMEM)培养基中混悬细胞。
1.7 TGF-β1诱导RPMC纤维化 按5×105个/mL的浓度将RPMC接种于6孔板中,待细胞长至70%~80%时,改为无血清DMEM高糖培养24 h,然后将RPMC分为对照组、模型组、模型+不同浓度Ad组进行实验:对照组继续以无血清DMEM高糖培养基培养24 h,模型组加入TGF-β1(终浓度为5 μg /L)培养24 h,模型+不同浓度Ad组加入TGF-β1(终浓度为5 μg /L)和Ad(终浓度为 10、20、40 μmol/L )培养24 h。
1.8 检测RPMC中Col-Ⅰ蛋白、p-Smad2/3、Smad2/3、Smad7蛋白的表达 使用RIPA裂解液在冰上裂解各组细胞,细胞裂解后以1 000 r/min离心10 min。取上清液,用二喹啉甲酸法进行蛋白定量。用10% 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离蛋白,并将其转移到聚偏氟乙烯膜上,5%脱脂奶粉室温封闭2 h,加入一抗Col-Ⅰ(1 ∶1 000)、p-Smad2/3(1 ∶500)、Smad2/3(1 ∶500)、Smad7(1 ∶1 000) ,4℃过夜孵育,然后加入辣根过氧化物酶标记的二抗(1 ∶500)室温下孵育2 h。以β肌动蛋白(β-actin)为内参。使用Image-Pro Plus 6.0软件进行结果分析。其中,p-Smad2/3水平通过计算磷酸化蛋白吸光度/非磷酸蛋白吸光度的比值来定量。
1.9 统计学分析 采用SPSS 11.0软件进行统计分析。计量资料以(x±s)表示,组间比较采用方差分析,两两比较采用LSD-t检验;计数资料以例数表示,等级资料比较采用Kruskal-WallisH检验,两两比较采用拓展t检验。以P<0.05为差异具有统计学意义。
2 结 果
2.1 6组大鼠腹腔粘连程度比较 6组大鼠腹腔粘连程度分级比较,差异有统计学意义(H=28.511,P<0.001)。其中其他组粘连程度均重于正常对照组,地塞米松组与Ad中、高剂量组的粘连程度均轻于模型组,所有剂量Ad组的粘连程度均重于地塞米松组(均P<0.05)。见表1。
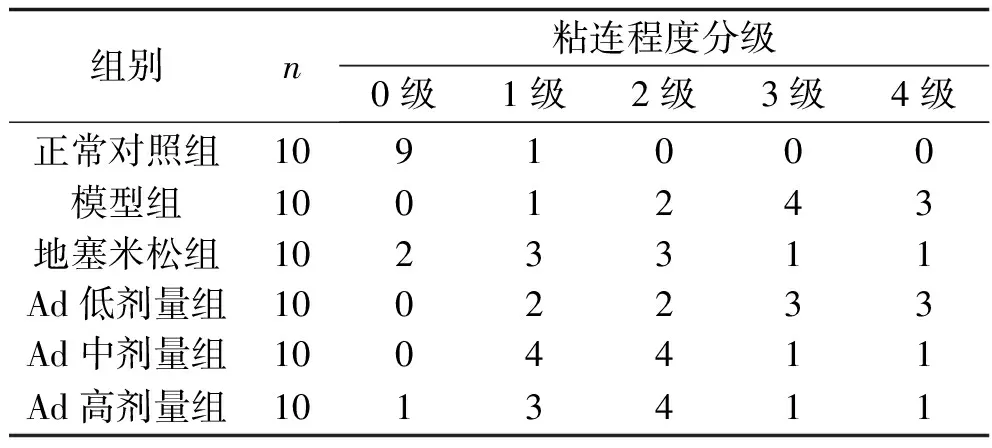
表1 6组大鼠腹腔粘连程度
2.2 6组大鼠血清IL-1β、IL-18和TNF-α水平比较 (1)正常对照组的血清IL-1β水平均低于其他组(均P<0.05),模型组、Ad低剂量组、Ad中剂量组、Ad高剂量组、地塞米松组的血清IL-1β水平依次降低(均P<0.05)。(2)正常对照组的血清TNF-α及IL-18水平均低于其他组;模型组的血清TNF-α及IL-18水平均高于地塞米松组(均P<0.05),但模型组的IL-18水平与各剂量Ad组比较,差异均无统计学意义(均P>0.05);Ad低剂量组的血清TNF-α水平以及Ad各剂量组的IL-18水平均高于地塞米松组(均P<0.05),Ad中剂量组、Ad高剂量组的TNF-α水平均低于Ad低剂量组(均P<0.05),但Ad各剂量组间的IL-18水平差异无统计学意义(P>0.05)。见表2。

表2 6组大鼠血清IL-1β、TNF-α和 IL-18水平比较(x±s,ng/L)
注:与正常对照组相比,*P<0.05;与模型组相比,#P<0.05;与地塞米松组相比,ΔP<0.05;与Ad低剂量组相比,▲P<0.05;与Ad中剂量组相比,■P<0.05。
2.3 6组大鼠腹腔液中TGF-β1和CTGF水平比较 (1)与正常对照组相比,模型组、Ad低剂量组、Ad中剂量组的腹腔液TGF-β1水平均升高(均P<0.05);各Ad剂量组、地塞米松组的腹腔液TGF-β1水平均低于模型组(均P<0.05);地塞米松组、Ad低剂量组、Ad中剂量组、Ad高剂量组的腹腔液TGF-β1水平差异均无统计学意义(均P>0.05)。(2)正常对照组的腹腔液CTGF水平均低于其他组(均P<0.05);与模型组相比,地塞米松组及Ad中、高剂量组的腹腔液CTGF水平均降低(均P<0.05);Ad低剂量组、Ad中剂量组、Ad高剂量组的CTGF水平依次降低,且Ad组低剂量组、Ad中剂量组均高于地塞米松组(均P<0.05)。见表3。

表3 6组大鼠腹膜液 TGF-β1和CTGF表达水平比较(x±s,ng/L)
注:与正常对照组相比,*P<0.05;与模型组相比,#P<0.05;与地塞米松组相比,△P<0.05;与 Ad低剂量组相比,▲P<0.05;与Ad中剂量组相比,■P<0.05。
2.4 5组大鼠RPMC中的Col-Ⅰ蛋白表达水平、Smad7和Smad2/3磷酸化水平比较 (1)与对照组相比,其他组的Col-Ⅰ蛋白相对表达水平均增加(均P<0.05)。模型组、模型+10 μmol/L Ad组、模型+40 μmol/L Ad组、模型+20 μmol/L Ad组的Col-Ⅰ蛋白相对表达水平依次降低(均P<0.05)。(2) 与对照组相比,其他组的p-Smad2/3与Smad2/3比值均增加(均P<0.05);与模型组比较,模型+10 μmol/L Ad组p-Smad2/3与Smad2/3比值升高、模型+20 μmol/L Ad组p-Smad2/3与Smad2/3比值降低(P<0.05);模型+10 μmol/L Ad组、模型+40 μmol/L Ad组、模型+20 μmol/L Ad组的p-Smad2/3与Smad2/3比值依次降低(均P<0.05)。(3) 与对照组相比,模型+不同浓度Ad组的Smad7相对表达水平均升高(均P<0.05);模型组、模型+10 μmol/L Ad组、模型+20 μmol/L Ad组、模型+40 μmol/L Ad组的Smad7相对表达水平依次升高(均P<0.05) 。见表4和图1。
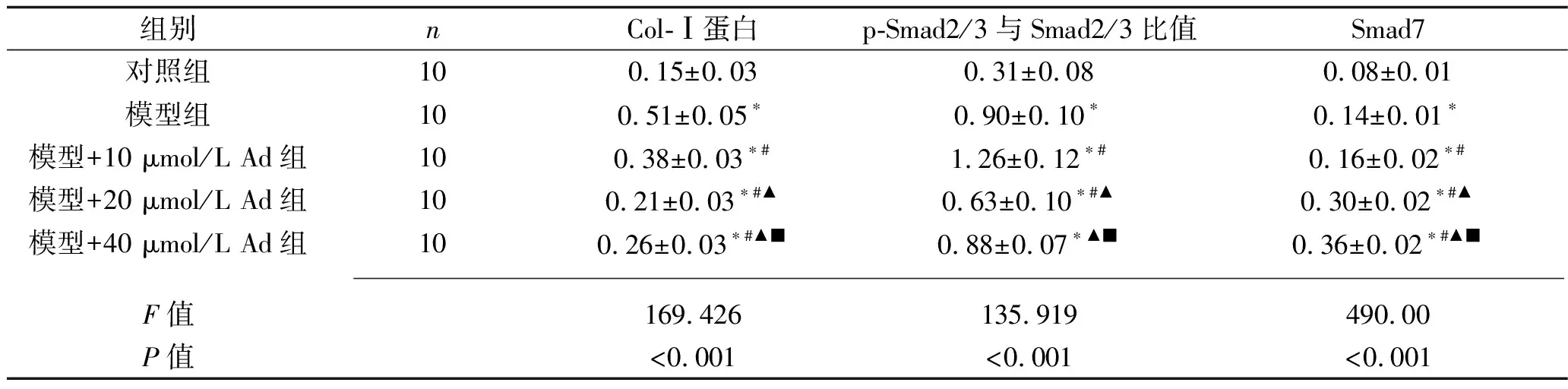
表4 5组细胞的Col-Ⅰ蛋白表达水平、Smad7和p-Smad2/3与Smad2/3比值比较(x±s)
注:与正常对照组相比,*P<0.01;与模型组相比,#P<0.05;与模型+10 μmol/L Ad组相比,▲P<0.05;与模型+20 μmol/L Ad组相比,■P<0.05。

图1 5组细胞Col-Ⅰ、p-Smad2/3、Smad2/3、Smad7的表达情况
注:1、2、3、4、5分别代表正常对照组、模型组、模型+10 μmol/L Ad组、模型+20 μmol/L Ad组、模型+40 μmol/L Ad组。
3 讨 论
本研究中,术后12 d,模型组的大鼠出现不同程度的腹腔粘连,大部分为3~4级,表明造模成功。一系列细胞因子,如IL-1β、IL-18和TNF-α等参与了炎症过程,他们的表达水平与腹腔粘连程度显著相关[17-18],在腹腔粘连的形成中起着重要作用[19-22]。本研究中,术后12 d,模型组血清IL-1β、IL-18与TNF-α水平均高于对照组(均P<0.05),这表明腹膜损伤可触发炎症反应[23]。此外,用药结束后Ad中、高剂量组的粘连程度均轻于模型组(P<0.05),提示中高剂量的Ad有减轻腹腔粘连形成的作用;各剂量Ad组血清IL-1β和TNF-α水平均较模型组降低,且Ad中剂量组、Ad高剂量组血清TNF-α水平均低于Ad低剂量组,Ad低剂量组、Ad中剂量组、Ad高剂量组血清IL-1β水平依次降低(均P<0.05),这表明Ad可抑制炎症因子的表达,从而发挥抗腹腔粘连的作用,且高剂量Ad的抗炎作用更强。IL-18是一种重要的炎症细胞因子,在炎症反应和免疫应答中起重要作用[24]。然而,本研究中,Ad各剂量组间IL-18水平差异无统计学(均P>0.05),提示Ad并没有影响IL-18水平。
CTGF是TGF-β1的下游因子,能促进纤维蛋白细胞外基质产生和抑制细胞外基质降解[25-26],使细胞外基质积聚,最终导致腹膜纤维化和腹腔粘连。本研究结果显示,模型组腹腔液TGF-β1和CTGF水平均高于正常对照组(均P<0.05);而Ad各剂量组的TGF-β1水平、Ad中剂量组和高剂量组的CTGF水平均低于模型组,且Ad低剂量组、Ad中剂量组、Ad高剂量组的CTGF水平依次降低(均P<0.05),这提示Ad可抑制腹腔粘连大鼠腹腔液中TGF-β1的表达,并可剂量依赖性地降低CTGF含量。
为了探讨抗纤维化的潜在机制,我们用雄性大鼠(与雌性大鼠相比更少产生腹腔疾病)为实验对象, 提取其RPMC,建立TGF-β1诱导的纤维化细胞模型,并检测细胞中相关蛋白的表达情况。Col-Ⅰ作为细胞外基质的重要组成成分,其蛋白表达量是评估腹腔粘连发生的直观指标和依据[27]。本研究中,模型+不同浓度Ad组的Col-Ⅰ蛋白表达水平均低于模型组,且模型+10 μmol/L Ad组、模型+40 μmol/L Ad组、模型+20 μmol/L Ad组的蛋白表达水平依次降低(均P<0.05),提示Ad可有效地降低腹腔粘连大鼠Col-Ⅰ蛋白的表达,其中20 μmol/L Ad的效果最好。TGF-β1在细胞信号转导过程中具有复杂的调节作用。首先,它能诱导丝裂原活化蛋白激酶的磷酸化。此外,Smad信号通路激活后可直接导致细胞外基质成分的合成,并促进纤维化的发生。一旦Smad2/3通路被激活,会导致腹膜纤维化的发生和发展。然而,Smad7是一种抑制性Smad因子,可以负性调节Smad2/3通路激活的负反馈机制[28-31]。本研究结果显示,与模型组比较,模型+20 μmol/L Ad组的p-Smad2/3与Smad2/3比值降低,模型+20 μmol/L Ad组、模型+40 μmol/L Ad组的Smad7相对表达水平均升高(均P<0.05),即Ad可提高Smad7的表达并抑制Smad2/3的磷酸化。这提示Ad或可通过调节RPMC中的Smad信号通路来抑制粘连形成。
虽然在本研究中Ad各剂量组大鼠腹腔粘连程度均较地塞米松组严重(均P<0.05),提示Ad对大鼠腹腔粘连的抑制作用稍差于地塞米松组,但是Ad并不影响伤口愈合且产生的副作用很少。同时,与预防性物理分离疗法相比,Ad有易于给药和安全性能强的特点。因此,Ad作为抗术后肠粘连的辅助药物,具有较好的应用前景。
总之,Ad对大鼠腹腔粘连的形成具有较好的抑制作用,其或可通过抑制炎症反应和调节TGF-β/Smad信号通路来发挥作用。但是,Ad作为一种潜在的新型抗粘连治疗药物,其具体的作用机制、最佳剂量及不良反应还需进一步研究探讨。
