替诺福韦阻断高HBV DNA载量孕妇母婴传播临床效果观察
2020-05-09周培渠淑云
周培 渠淑云
在我国,乙型肝炎病毒(Hepatitis B virus ,HBV)感染仍是导致肝硬化和肝癌的主要原因之一,虽然长期抗HBV治疗能够减少肝硬化和肝癌的发生率,但仍不能完全清除体内的HBV,因此减少HBV传播是重要的预防手段[1]。母婴传播是导致乙肝慢性化的主要因素,HBeAg阳性的孕妇如未进行抗HBV治疗,母婴传播率可达80%~90%,而新生儿如进行有效的HBV疫苗和乙型免疫球蛋白(Hepatitis b immunoglobulin,HBIG)联合免疫,母婴传播率可减少至5%~10%,但是孕妇HBV DNA载量>106拷贝/毫升,就算新生儿进行了有效的联合免疫预防,仍有10%~30%的新生儿感染HBV,研究显示高病毒载量孕妇进行核苷(酸)类似物[Nucleos(t)ide analogues,NAs]治疗后可明显降低其血清中HBV DNA载量,减少母婴传播风险,保证孕妇和胎儿安全[2]。2017年欧洲肝病协会(EASL)和2018年美国肝病协会(AASLD)均只推荐TDF为孕妇孕中晚期的抗病毒治疗药物,本研究通过观察HBV感染孕妇口服TDF观察临床疗效和母婴阻断效果,为临床干预提供理论依据[3-4]。
资料与方法
一、一般资料
选择了2017年1月至2018年11月到我院和核工业二一五医院就诊、查体及分娩的慢性乙型肝炎的患者共23例,诊断均符合2015年版的《慢性乙肝诊断标准》[5],纳入标准:①、年龄在20~40岁;②、HBsAg和HBeAg阳性;③、HBV DNA载量>106拷贝/毫升;④、同意服用TDF直至分娩。排除标准:①、HAV、HCV、HDV、HEV或HIV感染;②、ALT≤4×ULN(正常值上限);③、有明显泌尿系、心血管、呼吸系统或神经系统基础疾病;④、合并肝衰竭;⑤服用免疫调节、细胞毒及类固醇等药物;⑥、三维超声提示胎儿畸形;⑦、合并恶性肿瘤;用药前已向孕妇及家属说明TDF用药标准和风险,并签署用药同意书,经医院伦理委员会审批通过后方进行试验。
二、方法
23例孕妇在孕27周~28周给予TDF 300 mg/d治疗(葛兰素史克有限公司)。婴儿出生后立即给予乙肝疫苗10 μg(华兰生物疫苗有限公司)及HBIG 100~200 U(武汉生物制品研究所有限责任公司)联合免疫,1个月和6个月时再次注射10ug乙肝疫苗。
三、评价指标
在治疗前、分娩前分别采集孕妇外周血4 mL,用罗氏Light Cycler实时荧光定量PCR仪检测HBV DNA载量,试剂盒购自瑞士罗氏制药公司,评价治疗前后HBV DNA载量变化情况。在治疗前和分娩前采集孕妇外周血,取血清Aeroset 生化分析仪检测ALT和血Cr值,其中ALT采用速率法、Cr采用苦味酸法,试剂均购自中生北控生物科技股份有限公司,评价ALT和血Cr值变化情况。婴儿在9~12月时采集其外周血4 mL,用酶免疫吸附法测定HBsAg,如为阴性则表示阻断成功。并观察婴儿出生时的性别、体质量、Apgar评分、分娩方式、是否母乳喂养。观察孕妇服药期间的药物不良反应,有无胃肠道反应、肾功能损害等。
四、统计学方法
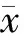
结 果
一、一般资料
23例孕妇的基线情况:平均年龄为(28±5.54)岁,平均孕周为(31±3.45)周, HBsAg、HBeAg均为阳性,平均服用TDF时间为(48±23.24)d,基线HBV DNA载量为(8.54±0.69) lg 拷贝/毫升,ALT为(38.5±14)U/L,血Cr为(64±25)μmol/L。
二、实验室检查
23例孕妇经抗病毒治疗后,HBV DNA载量下降为(5.39±1.22)lg拷贝/毫升,较基线下降明显,有统计学意义(P<0.001))。治疗后ALT为 (34.5±16)U/L,较基线无明显改变(P>0.05)。治疗后Cr为(60±23) μmol/L, 较基线无明显改变(P>0.05)。
三、婴儿HBV感染及出生情况
23例新生儿体质量为(3 405±352)g,失随访3例,余20例新生儿Apagar为8~10分,无出生畸形,并在12个月随访时测HBsAg为阴性,测HBV DNA载量均低于检测下限。
四、药物副作用及停药时间
只有1例孕妇在TDF治疗期间出现恶心、呕吐不适,治疗1周后停用TDF(编号2),HBV DNA载量下降1lg 拷贝/毫升,其余孕妇在整个治疗过程中并未出现任何不良反应。停药时间选择:母乳喂养孕妇建议产后立即停药,在妊娠前开始服用NAs类药物或在孕期诊断为慢性乙型肝炎患者,产后不能立即停药者,遵照慢性乙型肝炎治疗方案管理。
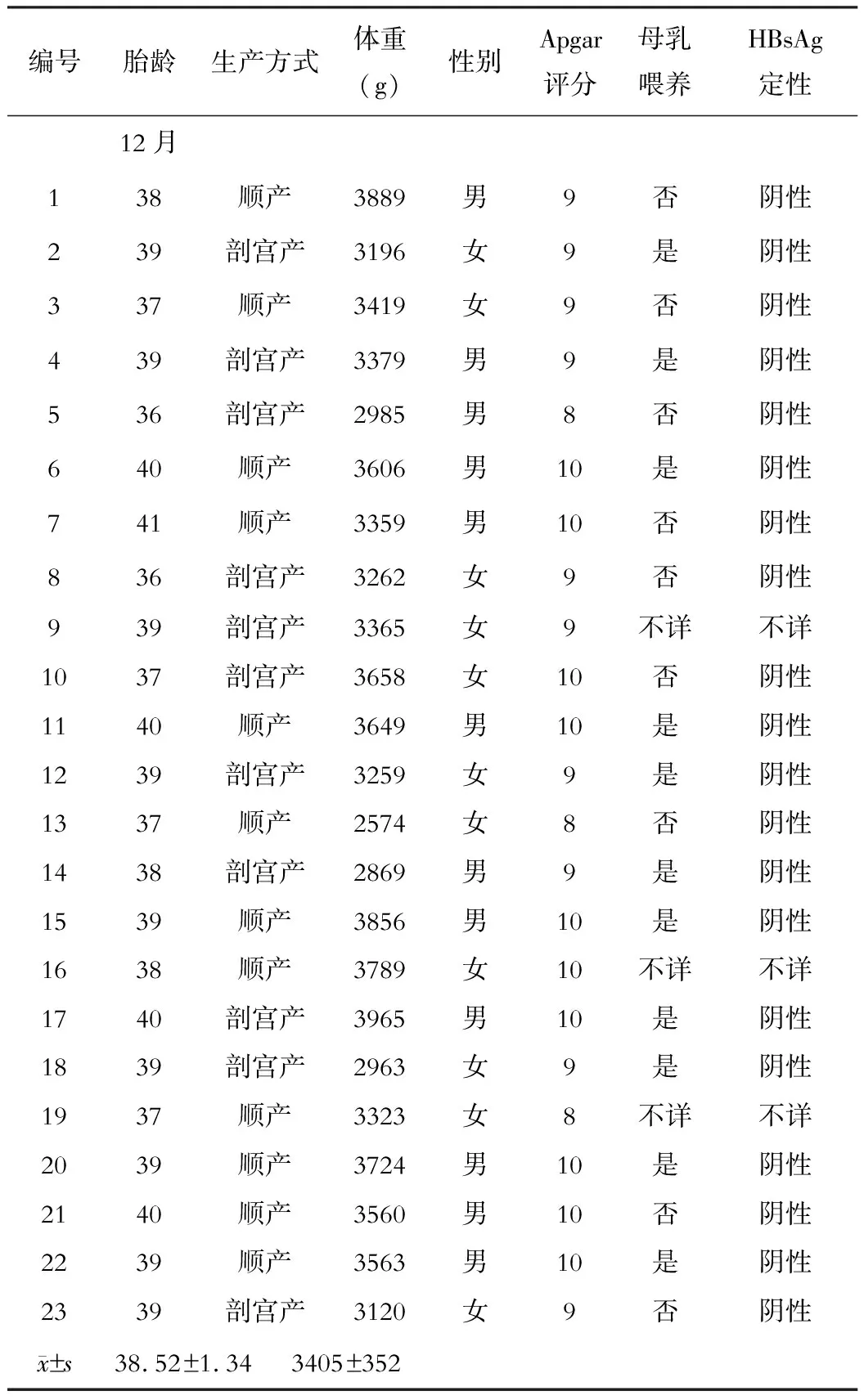
表1 随访新生儿情况
讨 论
尽管新生儿出生后立即进行联合免疫预防,对HBeAg阳性孕妇的母婴阻断,有效率可达90%,但孕妇HBV DNA高载量仍是HBV母婴传播的独立危险因素[6]。Wen等[7]研究表明,HBV DNA高载量孕妇的HBV母婴传播风险较低载量孕妇高3倍(OR3.49;95%CI1.63~7.48),孕妇HBV DNA载量为8 log拷贝/毫升和5 log拷贝/毫升母婴传播率分别为14.6%(95%CI5.6%~23.6%)和0.9%(95%CI0.9%~2.7%)。YIN等[8]对1 355例HBV感染孕妇研究表明,母婴阻断失败与HBeAg阳性(RR=31.74,95%CI3.88~259.38)和HBV DNA载量>7lg 拷贝/毫升(RR=22.58;95%CI4.751~107.40)显著相关他们认为母婴传播风险与HBV DNA水平有关。Zou等[9]研究发现HBV DNA>8 lg拷贝/毫升,7~12个月时新生儿母婴传播率为7.6%,因此,降低HBV DNA载量是阻断HBV母婴传播的重要措施之一。虽然NAs类药物在孕妇抗HBV治疗过程中存在HBV耐药、胎儿安全性、停药时间等问题,但2017年欧洲肝病协会(EASL;HBV DNA>6log10拷贝/mL或HBsAg定量>4 log10 IU/mL)和2018年美国肝病协会(AASLD;HBV DNA>6log10拷贝/mL)均建议孕妇HBV感染后在孕24周~28周唯一能用于抗HBV治疗的NAs类药为TDF。尽管在动物实验和HIV感染的小儿中有报道TDF治疗会导致骨质疏松和生长发育障碍,但TDF在治疗HBV或HIV感染的孕妇中是安全的,孕妇所生的新生儿无论在死亡率、先天畸形、生长发育情况等方面均无显著差异[10,11]。TDF治疗的主要副作用为ALT升高和肾毒性,肾毒性多见于HIV感染的患者应用TDF抗HIV治疗,在本研究中均未发现ALT升高和肾功能异常,但仍需监测产后继续口服TDF抗HBV治疗患者的肝肾功能[12]。本研究23例新生儿均未发现先天畸形,生长发育情况方面也良好,无新生儿感染HBV。经TDF治疗后孕妇HBV DNA水平显著降低,且仅1例因胃肠道症状停药。3例新生儿失随访,余20例新生儿12个月随访复查HBsAg为阴性,HBV DNA载量均低于检测下限。综上所述,本研究表明TDF在HBV感染孕妇能明显降低孕妇HBV DNA载量,阻断HBV母婴传播,安全性较高,高HBV DNA载量孕妇可根据自身情况在孕中晚期应用TDF抗HBV治疗,但其安全性和有效性仍需要大规模临床研究来证实。
