硫酸亚铁铵的纯度和组成的测定分析
2020-05-09
(天津市化学试剂研究所有限公司,天津300240)
硫酸亚铁铵的组成成分相对复杂,包含了硫、铁、铵等多种化学元素,具有较高的实际应用价值,而要最大程度开发硫酸亚铁铵的价值,就需要充分了解并掌握其具体成分组成以及该化学物质的纯度,这样才能进一步扩展其应用广度和维度。由于硫酸亚铁铵的成分较为复杂,所以其纯度和组成测定过程也相对繁琐,需要通过还原滴定法、蒸馏后滴定法、沉淀重量法等多种手段对其进行测定,以下为本文进行的简单实验分析[1~3]。
1 仪器与试剂
仪器有:转靶全自动X射线粉末衍射仪;热重质谱联用仪;BP210S型万分之一电子天平;电热恒温水浴;真空干燥箱;循环水式多用真空泵;抽滤瓶、蒸馏装置、滴定管等。
试剂有:铁屑;(NH4)2SO4;乙醇;H2SO4溶液;Fe3+标准溶液;KSCN 溶液;HCl溶液,KMnO4溶液;K2Cr2O7溶液;二苯胺磺酸钠;硫-磷混酸溶液;Na2H2Y·2H2O 溶液;1∶1 NH3·H2O 溶液;磺基水杨酸;H2O2;H3BO3;Na2CO3;甲基红指示剂;甲基红-溴甲酚绿混合指示剂;饱和NaOH溶液;BaCl2溶液等。以上试剂均为分析纯,实验用水均为去离子水。
2 实验方法
2.1 制备六水合硫酸亚铁铵
准备50 mL浓度为3 mol/L的H2SO4,然后精密称取8 g铁屑投入其中,进行恒温水浴加热,温度为60℃,待二者充分反映后分离过滤残渣和滤液可得FeSO4,根据过滤量的多少加入适量(NH4)2SO4固体,再次进行水浴加热,之后自然冷却到常温可得硫酸亚铁铵晶体。最后用乙醇对晶体进行洗涤,并放于烘箱烘干,时长大概2 h,达到恒重即可。
2.2 Fe2+的测定
称取以上硫酸亚铁铵样品20.2904 g,用0.05 mol/L H2SO4溶液将其溶解,体积至500 mL即可。通过高锰酸钾法、重铬酸钾法测定以及络合滴定法等方法对其中的Fe2+进行测定。本次实验分别使用三种测定方法进行了6次实验,最后计算了平均值,测定结果见表1。
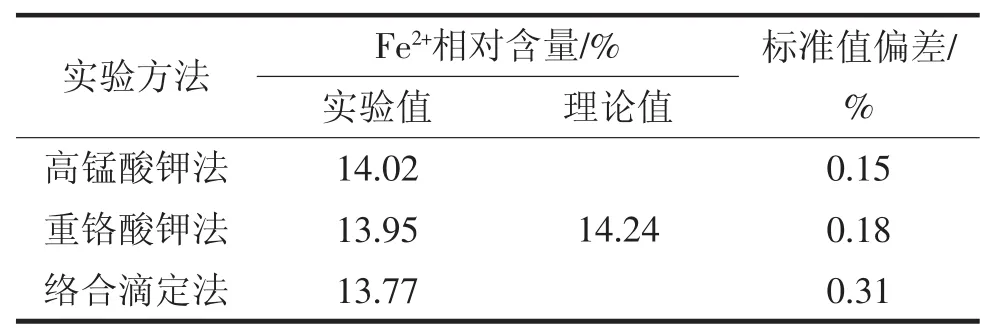
表1 三种测定Fe2+方法的结果比较
2.3 蒸馏后滴定法测定样品中的
首先向蒸馏瓶中加入适量的离子水、甲基红指示剂H2SO4以及数粒防爆沸石,以滴入甲基红-溴甲酚绿混合指示剂的H3BO3溶液为接收液。然后量取5mL样品溶液加入到蒸馏瓶中,并向其中加入10 mL饱和NaOH溶液,盖严塞子加热蒸馏大概8min。当吸收瓶中累积收集量至40 mL,并用0.05 mol/L HCl溶液滴定接收液后变成暗红色为止。以相同的操作做空白试验6次,仍取平均值,本次实验结果如表2所示。
表2 蒸馏后滴定法测定化合物中的NH

表2 蒸馏后滴定法测定化合物中的NH
实验方法 NH+4的相对含量/%实验值 理论值 标准值偏差%蒸馏后滴定法 9.02 9.20 0.25
2.4 沉淀重量法测定样品中的
取1个250mL烧杯,向其中加入0.4g硫酸亚铁铵样品,注入清水70mL,HCL溶液2mL,用蒸汽法将其加热到80℃以上,搅拌状态下滴入12mL热氯化钡,之后将烧杯放到温度在90℃左右的热水浴中加热陈化大概1h之后进行冷却和过滤,得到沉淀物质。将其放至坩埚内用电炉上灰化处理后移入800℃高温炉灼烧1h,最后再次冷却称重,直到质量稳定即可。
3 实验结果
本次实验中所呈现的实验结果与理论值基本上接近,经过计算后得出,硫酸亚铁铵中各成分比例大概如下:由此可以推算出,硫酸亚铁铵这种化学物质的分子式应为:FeSO4·(NH4)2SO4·6H2O。
4 结束语
本次实验分析可以充分证明,硫酸亚铁铵中含有丰富的化学元素,其测定方法较为复杂,针对不同化学成分要采用氧化还原滴定、蒸馏后滴定、沉淀重量法及沉淀分离和蒸发分离等多种手段进行测定,最后才能计算出正确的硫酸亚铁铵化学公式,进而为该化学物质的应用提供可靠的参考依据。
