剪接因子SRSF9在肺癌中的表达量变化及意义
2020-05-09李梦仙俞建昆温艳萍吴翰欣刘晓晓邰文琳
李梦仙,俞建昆,温艳萍,吴翰欣,高 凌,刘晓晓,邰文琳
(1)昆明医科大学第二附属医院检验科;2)中国医学科学院医学生物学研究所,云南昆明 650118)
肺癌作为最常见的恶性肿瘤之一,经研究报道其发病率及致死率逐年攀升,均跃居恶性肿瘤的首位[1]。剪接因子(splicing factor,SF)参与调控前体mRNA(pre-mRNA)去除内含子连接外显子形成成熟mRNA这一过程。其中富含丝氨酸和精氨酸的SR蛋白(serine/arginine-rich protein)作为普遍的剪接因子家族,在选择性剪接和组成性剪接过程中均扮演着重要的角色[2]。它们具有相似的结构域,即位于氨基末端(N末端)的RNA识别结构域(RNA recognition motif,RRM)和位于羧基末端(C末端)含有高度磷酸化的丝氨酸和精氨酸的结构域(arginine/serine-rich domain,RS)。SRSF9作为该剪接因子家族成员之一,研究报道其已被证明是原癌基因,并且在脑癌,结肠癌,肺癌以及皮肤癌等癌症中都存在着癌组织较于癌旁高表达的情况[3]。有不少研究表明,SRSF9主要是通过调控与细胞凋亡相关基因的选择性剪接过程来影响肿瘤的发生发展[4]。但SRSF9在肺癌中表达量变化差异以及作用还未有研究报道。因此,本研究通过实时荧光定量 PCR(quantitative Real-Time PCR,QPT-PCR)、蛋白免疫印迹(Western blotting)检测剪接因子SRSF9在临床肺癌样本以及肺癌细胞系中mRNA及蛋白水平的表达量差异变化,并通过ROC曲线分析其对肺癌的诊断价值,旨在为临床早期诊断肺癌以及患者预后评估提供参考。
1 资料与方法
1.1 病理资料及细胞来源
本研究所用的64例临床病理样本均来自昆明医科大学第三附属医院2017年9月至2018年5月经病理诊断确诊为肺癌患者的组织样品。其中男性患者36例,女性患者28例;组织学分型鳞癌12例,腺癌52例;年龄<55岁23例,≥55岁41例;TNM分期I~II期57例,III~IV期7例。本研究获得医院伦理委员会批准并征得患者及家属的知情同意。肺癌细胞A549、H1299购自南京科佰生物有限公司;人胚肺正常二倍体细胞KMB17由中国医学科学院生物研究所中心实验室提供。
1.2 主要试剂
RNAiso plus(日本Takara公司);Prime Script TM1ST Strand cDNA Synthesis Kit(南京vazyme公司);ChamQTM Universal SYBR qPCR Master Mix(南京vazyme公司);RIPA裂解缓冲液(医学生物学研究所中心实验室);Anti-SRSF9抗体(Abclonal);BCA蛋白浓度测定试剂盒(Invitrogen公司)。
1.3 方法
1.3.1 临床肺癌样本及肺癌细胞系中总mRNA的提取 根据病理组织大小加入适量的RNAiso plus并用匀浆机匀磨组织后分装到容积2 mL EP离心管中;离心管中加入1/5组织裂解液体积的氯仿,剧烈的上下颠倒混匀,静止5 min后4℃,12 000 g离心15 min;将上清转移到新的EP离心管后加入适量氯仿,反复颠倒混匀后室温静置10 min,4℃,12 000 g离心10 min;弃去上清保留沉淀,加入75%的乙醇清晰沉淀,4℃,12 000 g离心5 min;弃去上清后用笔圈出沉淀,待乙醇挥发完全后加入适量的Rnase free的水溶解沉淀;测定RNA浓度后备用。肺癌细胞系总mRNA提取方法与此一致。
1.3.2 实时荧光定量PCR检测SRSF9mRNA水平表达量 将从临床样本及细胞系中提取的总mRNA均按照Vazyme去基因组逆转录试剂盒说明书操作将mRNA逆转录成cDNA,然后按照Q-PCR试剂说明书操作来测SRSF9的相对表达量。Q-PCR反应体系共20μL;2×SYBR qPCR Master Mix 10μL,上下游引物各0.4μL,cDNA 2 μL,ddH2O7.2μL。正向引物序列5'-TCGGCTTCGTGTGGAGTTC-3',反向引物序列5'-AGCTTCTCGCATGTGATCCTTC-3';内参基因EEF1A1的正向引物序列5'-CGTAGATTCGGGCAAGTCCAC-3',反向引物序列5'-GTGATACCACGTTCACGCTCAG-3'。将配好的反应体系放入荧光定量PCR仪上反应,反应程序设为95℃,30 s;95℃,10 s;60 ℃,30 s;共40个循环并且每样品3复孔重复3次。反应结束后收集数据并采用2-△△CT相对定量来计SRSF9的相对表达量。
1.3.3 Western blotting检测SRSF9蛋白水平表达量 将混有细胞的PBS液体收集在干净的EP离心管中后离心,根据细胞团块大小加入适量含有蛋白酶抑制剂的RIPA蛋白裂解液,用移液器吹打,充分裂解细胞。用BCA试剂盒来测定得到的细胞蛋白液浓度。统一蛋白上样量后将变性好的蛋白液用来进行PAGE电泳。参照蛋白Marker待目的条带分离充分后进行转膜。转膜采用“三明治”湿转法(转膜过程中小心不能出现气泡)。转膜完成后用5%的脱脂奶粉封闭1 h,根据目的及内参蛋白大小切膜来进行后续的免疫杂交反应。加入提前稀释好的SRSF9兔多克隆抗体以及GAPDH鼠单克隆抗体,4℃过夜。次日用TBST清洗PVDF膜后分别加入羊抗兔及羊抗鼠单克隆抗体,室温孵育1 h。TBST清洗膜后配制发光显色剂,显色观察。
1.4 统计学处理
采用SPSS统计学软件对数据进行处理分析。计量资料符合正态分布的数据用平均数±标准差()描述;两组间比较采用t检验,多组间比较采用单因素方差分析检验。若不符合正态分布则用中位数以及四分位数间距描述,用Wilcoxon秩和检验比较。诊断价值用ROC曲线分析;SRSF9与患者临床病理参数之间有无相关性采用Fisher确切概率法分析。P<0.05为差异有统计学意义。
2 结果
2.1 剪接因子SRSF9在肺癌及癌旁组织中mRAN的表达量差异
肺癌组织中剪接因子SRSF9的表达量(3.85×10-3,2.81×10-3)高于癌旁(3.05×10-3,1.35×10-3)。差异有统计学意义(P=0.003),见图1。
2.2 剪接因子SRSF9 mRNA水平的表达量差异
分别在人胚肺正常二倍体细胞KMB17及肺癌细胞系A549、H1299中检测剪接因子SRSF9 mRNA的表达量(见图2)。结果显示,A549、H1299中SRSF9的表达量分别为(7.1×10-3±2.96×10-)4、(1.49×10-2±1.55×10-)3,均高于在KMB17中的表达量(5.42×10-3±5.15×10-)4,差异有统计学意义(P<0.05,P<0.01)。
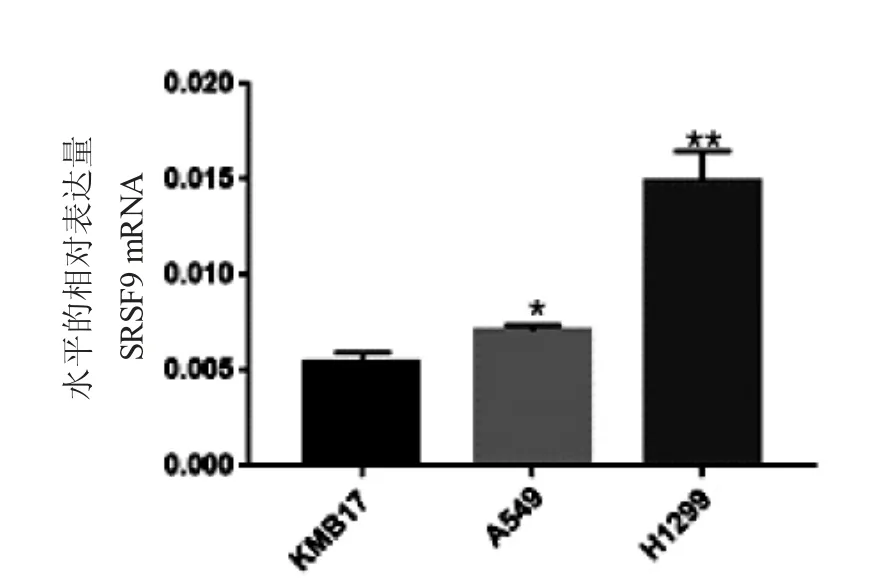
图2 剪接因子SRSF9在细胞系KMB17、A549、H1299中mRNA水平表达量差异图Fig.2 The difference in mRNA expression levels of splicing factor SRSF9 in cell lines KMB17,A549,and H1299
2.3 剪接因子SRSF9蛋白水平的表达量差异
从未经过任何处理人胚肺正常二倍体细胞KMB17、肺癌细胞系A549、H1299中提取蛋白后,通过Western blotting检测剪接因子SRSF9蛋白水平在三株细胞系中的表达量差异(见图3)。结果显示,剪接因子SRSF9蛋白水平在肺癌细胞A549、H1299中均高于人胚肺正常二倍体细胞KMB17。

图3 剪接因子SRSF9在细胞系KMB17、A549、H1299中蛋白水平表达量差异Fig.3 The difference in protein expression levels of splicing factor SRSF9 in cell lines KMB17,A549 and H1299
2.4 剪接因子SRSF9表达量诊断价值经受ROC曲线分析
ROC曲线下面积为0.755,P=0.02,有统计学意义,见图4。其中,诊断临界值为3.83×10-3,相应的灵敏度和特异度分别为0.507,0.791。

图4 剪接因子SRSF9表达量诊断价值经受ROC曲线分析Fig.4 The diagnostic value of SRSF9 splicing factor was analyzed by ROC curve
3 讨论
近几年流行病学研究表明肺癌由于其高发病率和高致死率已经成为威胁人类生存的首要杀手之一。由于缺乏早期诊断的分子标志物,患者确诊时往往已处于病程较晚阶段,治疗比较棘手。并且目前临床对于肿瘤采取的治疗手段主要是化疗和放疗,对患者副作用大且效果不甚理想[5]。随着靶向治疗以及精准治疗的出现,研究引起疾病发生的分子机制以及治疗分子靶标对于临床诊断治疗意义重大[6]。选择性剪接是前体mRNA通过剪接因子等调控因子对剪接位点选择性识别去除内含子连接外显子的过程。一个前体mRNA经过选择性剪接的调控可以形成不同的剪接异构体,进而翻译出功能不同甚至相反的蛋白。这一生理过程使得真核生物在进化过程中出现各种功能各异的蛋白而编码蛋白的基因数目并没有增多,极大的增加了基因的“丰度”。选择性剪接在生物基因转录后表达过程中一种广泛存在的调控机制,真核生物中有大约有90%的基因受到选择性剪接的调控[7]。随着对选择性剪接研究的深入,已有不少研究报道选择性剪接的失调与不少疾病息息相关,而其中与肿瘤的关系格外引人注意[8]。SR蛋白家族作为剪接因子的重要一类,研究其在疾病中功能异常与否对于研究选择性剪接在疾病进展过程中发挥的作用机制。不少研究[9-11]表明SR蛋白家族不同成员在多种类型肿瘤中都异常表达。例如SRSF1在结肠癌,甲状腺癌,乳腺癌中高表达;SRSF3在卵巢癌,宫颈癌中高表达,在肝癌中低表达[12-14]。其中SRSF9已被证明在裸鼠中具有致瘤能力,即是一个原癌基因。并且其在脑癌、皮肤癌等中高表达。关于SRFS9对于肿瘤细胞的生物学功能研究也有过不少研究报道。例如在宫颈癌中通过小RNA(siRNA)技术来干扰SRSF9在宫颈癌细胞系中的表达量后通过CCK-8、平板克隆等实验发现SRSF9会影响肿瘤细胞的增殖、细胞周期等方面进而影响肿瘤的发生发展[15]。在膀胱癌中对肿瘤细胞增殖迁移等的影响也已经有过报道[16]。但是SRSF9在肺癌中无论是表达量差异还是其生物学功能都还未有研究报道,所以本研究先初步通过用实时荧光定量PCR和Western blotting来检测SRSF9在临床肺癌样本以及肺癌细胞系中的表达量差异,结合ROC曲线分析其对肺癌的诊断价值。通过本研究发现,SRSF9在肺癌及肺癌细胞系中都高表达,并且其对肺癌的诊断有一定的价值。提示SRSF9可能在肺癌整个疾病进程中都高表达,可以作为肺癌的一个潜在诊断指标。但对与其作用的分子机制并无研究并且临床样本量较少,所以后期应扩大样本量并深入研究其在肺癌中发挥作用的分子机制,为临床诊断肺癌提供新的思路,肺癌治疗提供新靶点的理论基础。
并且通过本研究还发现虽然在肺癌细胞A549及H1299中SRSF9蛋白水平均高于KMB17,但在H1299和A549两株细胞中表达量差异也很显著。分析原因可能是两株肺癌细胞之间的差别主要在于H1299细胞中P53缺陷,猜想可能是P53作为抑癌基因会抑制原癌基因SRSF9的表达。并且有研究报道过SR蛋白家族作为剪接因子的重要一员,当其选择性剪接功能失调时,主要会造成与细胞凋亡相关的基因功能异常。已有研究报道P53通过Bax/Bcl2,Fas/Apol,IGF-BP3等蛋白来完成对细胞凋亡的调控作用[17]。因此猜想P53与SRSF9之间存在着某些互作关系。本研究仅发现表达量异常这种表象,具体的作用机制还有待进一步研究。
选择性剪接作为生物进程中一个重要的调控机制,极大的提高了生物物种的基因丰度,满足了生物进化过程中需要不断出现新功能蛋白的诉求。其作用异常与人类疾病息息相关,研究明白其与疾病的关系对于人类的生命健康有着重要的意义。由于选择性剪接作用过程复杂且参与者众多,对于其的研究学习任重而道远。
