Meprinα 对TGF-β1诱导的成纤维细胞胶原合成的调节作用
2020-05-09张诗汇靳馥宇
王 珺,张 乙,张诗汇,靳馥宇,李 田,徐 洪
(华北理工大学基础医学院/河北省器官纤维化重点实验室,河北唐山 063210)
课题组前期研究发现,N-乙酰-丝氨酰-天门冬氨酰-赖氨酰 -脯氨酸(n-acetyl-serylaspartyl-lysyl-proline,Ac-SDKP)能够显著拮抗矽肺大鼠肺纤维化,在体外能够抑制转化生长因子(transforming growth factor,TGF)-β1介导胶原合成和肌成纤维细胞分化[1-2]。Ac-SDKP来源于胸腺素β4,其中内肽酶meprinα 是胸腺素β4水解成为Ac-SDKP的关键酶之一[3-4]。Meprin属于金属蛋白酶超家族,含有α 和β两个亚基,能够水解基质膜蛋白、细胞因子、紧密连接蛋白、生长因子、蛋白激酶等多种成分,一些研究认为Meprin在器官纤维化中发挥了重要的调节作用[5-6]。因此本研究拟通过体外原代培养肺成纤维细胞,并予以TGF-β1诱导向肌成纤维细胞分化,观察重组Meprinα 对肺成纤维细胞胶原合成和肌成纤维细胞转化的调节作用。
1 材料与方法
1.1 主要试剂
达尔伯克(氏)改良伊格尔(氏)培养基(dulbecco modified eagle medium,DMEM)(10099141,美国GIBCO公司);胎牛血清(BI-SH0019,以色列BI公司);GAPDH兔多克隆抗体(sc-25778,美国Santa Cruz公司);I型胶原(ab34710,英国Abcam公司)、α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA,ab32575)、M eprin α(ab232892);重组 TGF-β1蛋白(240-B,美国R&D公司)、重组Meprin α 蛋白(4007-ZN,美国R&D公司)、放线酰胺素(Actinonin,c3331,美国APExBIO公司)。
1.2 细胞培养及分组
采用贴壁法培养肺成纤维细胞,取新生1~3 d乳鼠,取肺组织剪成小块儿,采用血清平铺于培养瓶底,翻转放置6 h。待细胞爬出呈次融合状态时,传代,取3~4代细胞进行实验。同步化24 h后,细胞分组为:(1)对照组:无血清培养;(2)TGF-β1诱导组:无血清培养条件下,予以5 ng/mL TGF-β1诱导;(3)Meprin α 预处理组:无血清培养条件下,先予以100μmol/L Meprin α预处理1 h,再给予5 ng/mL TGF-β1共诱导;(4)Actinonin预处理组:无血清培养条件下,先予以20μmol/L actinonin预处理1 h,再给予5 ng/mL TGF-β1共诱导。
1.3 CCK-8法检测细胞增殖
按照5×103/ 孔将细胞种植于96孔板,同步化后按照实验设计分组并诱导,24 h后每孔加入10μL CCK溶液,细胞培养箱中孵育1 h,酶标仪于450 nm测定吸光度。
1.4 划痕实验
以2×105/孔的密度将细胞种植于24孔板,同步化后使用200μL枪头划痕,按照实验设计分组并诱导,分别于0 h、48 h倒置显微镜下拍照,采用IPP 6.0图像分析软件测定划痕区域面积,迁移率计算公式
1.5 免疫细胞荧光染色
细胞常规爬片,高压修复,血清封闭1 h,滴加α-SMA一抗(1:200)4℃过夜,次日二抗37℃孵育1 h,含DAPI封片剂封片,荧光显微镜下观察扫图。
1.6 免疫印迹
每25 cm2培养瓶加入100μL细胞裂解液,冰上静置15 min,刮取细胞移至EP管,12 000 g离心15 min取上清。Brafford法测定蛋白浓度,10μg/ 泳道上样,常规电泳和电转。孵育Meprin α、α-SMA、I型胶原一抗(1:1 000)4 ℃过夜,二抗(1:5 000)37℃1h后,ECL发光显色,采用Image-Lab 5.1软件定量分析条带,目的条带的OD值经相应内参平衡后与对照组的比值作为该蛋白的相应表达量。
1.7 统计学处理
2 结果
2.1 重组Merpin α 能够抑制TGF-β1介导的肺成纤维细胞的增殖
与对照组相比较,TGF-β1诱导组的OD值增加;与TGF-β1诱导组相比较,Merpin α 预处理组的OD值减小,经方差分析差异均具有统计学意义(P<0.05);而Actinonin预处理组OD值与TGF-β1诱导组差异无统计学意义(P>0.05),见表1。
2.2 重组Merpin α 能够抑制TGF-β1介导的肺成纤维细胞的迁移
与对照组的相比较,TGF-β1诱导组的迁移率增高;与TGF-β1诱导组相比较,Merpin α 预处理组的迁移率降低,Actinonin预处理组迁移率升高,经方差分析差异有统计学意义(P<0.05),见图1。
2.3 重组Merpin α 能够抑制TGF-β1介导的肺成纤维细胞的I型胶原和α-SMA的表达
见图2、图3、表2所示,与对照组比较,TGF-β1诱导组I型胶原、α-SMA表达水平显著上调,Merpin α 表达水平显著下调,免疫荧光染色显示α-SMA阳性表达,经t检验,差异有统计学意义(P<0.05),见图4、表3。与TGF-β1诱导组相比较,Merpin α 预处理组的I型胶原、α-SMA表达水平显著下调;如图4、表4所示,与TGF-β1诱导组相比较,Actinonin预处理组I型胶原、α-SMA表达水平显著上调,经t检验,差异有统计学意义(P<0.05)。
表1 重组Meprin α 和Actinonin对TGF-β1诱导的成纤维细胞增殖和迁移的影响()Tab.1 The effects of meprin α and actinonin on cell proliferation and cell migration in lung fibroblasts induced by TGF-β1()

表1 重组Meprin α 和Actinonin对TGF-β1诱导的成纤维细胞增殖和迁移的影响()Tab.1 The effects of meprin α and actinonin on cell proliferation and cell migration in lung fibroblasts induced by TGF-β1()
与对照组比较,*P <0.05;与TGF-β1诱导组比较,#P <0.05。
表2 TGF-β1对Meprin α 表达的调节作用()Tab.2 The effect of TGF-β1 on the expression of meprin α()

表2 TGF-β1对Meprin α 表达的调节作用()Tab.2 The effect of TGF-β1 on the expression of meprin α()
表3 重组Merpin α 对TGF-β1介导的COL I和α-SMA的调节作用()Tab.3 The regulation of recombinant meprin α on the ex pression of COL I and α-SMA induced by TGF-β1()

表3 重组Merpin α 对TGF-β1介导的COL I和α-SMA的调节作用()Tab.3 The regulation of recombinant meprin α on the ex pression of COL I and α-SMA induced by TGF-β1()
表4 Actinonin对TGF-β1介导的COL I和α-SMA的调节作用()Tab.4 The regulation of actinonin on the expression of COL I and α-SMA induced by TGF-β1()

表4 Actinonin对TGF-β1介导的COL I和α-SMA的调节作用()Tab.4 The regulation of actinonin on the expression of COL I and α-SMA induced by TGF-β1()
3 讨论

图1 重组Merpin α 抑制TGF-β1介导的肺成纤维细胞的迁移Fig.1 Merpin α inhibits fibroblasts migration induced by TGF-β1

图2 重组Merpin α 对TGF-β1介导的α-SMA表达的调节作用Fig.2 The effect of merpin α on the expression of α-SMA in lung fibroblast induced by TGF-β1
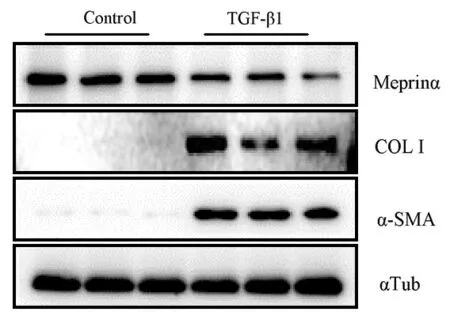
图3 TGF-β1对Merpin α 表达的调节作用Fig.3 The effect of TGF-β1on the expression of merpin α in lung fibroblast induced by TGFβ1

图4 重组Merpin α 和Actinonin对TGF-β1介导的COL I和α-SMA的调节作用Fig.4 The effect of merpin α and actinonin on the expression of COL I and α-SMA in lung fibroblasts induced by TGF-β1
Meprins属于金属蛋白酶家族,包含两个α、β亚基,可以各自或与对方聚合形成寡聚蛋白,其中包含α 亚基的称为Meprin A蛋白,多定位于膜上或形成可溶性Meprin α 蛋白而分泌到细胞外基质[5-6]。研究表明,Meprin α 在肾小管上皮细胞中强表达,能够水解胸腺素β4形成Ac-SDKP,是体内Ac-SDKP合成的主要来源之一[3-5]。课题组多年围绕Ac-SDKP的抗矽肺纤维化作用进行了系列研究,发现Ac-SDKP及其相关血管紧张素系统关键调节肽能够抑制肌成纤维细胞分化,包括肺泡II型上皮细胞,抑制细胞外基质沉积从而发挥拮抗矽肺大鼠肺纤维化的作用[1,2,7-9],因此推测,Meprin α 可能在体内具有调节胶原代谢的作用。
研究表明,Meprinα、β亚基能够水解I型胶原前肽,诱导原纤维组装,促进胶原成熟;Mep1a-/-和Meplb-/-基因敲除小鼠较野生型小鼠相比较,皮肤胶原纤维排列不规则,厚度降低,提示Merpins能够调节皮肤胶原代谢[10]。与野生型小鼠相比较,Mep1a-/-、Meplb-/-和双基因敲除小鼠博来霉素染毒后肺功能、炎症指标差异并不显著,但Meplb-/-基因敲除小鼠较野生型小鼠其胶原沉积水平降低,提示Meprinβ可能与肺纤维化的形成关系较为紧密[11]。在针对肺动脉高压的研究中也发现,Meprin α 能够抑制炎症细胞及炎症介质对血管内皮细胞的损伤作用[12]。而在肿瘤微环境的研究中,关于Meprin α 的作用机制尚不明确,甚至有争论。这些研究多认为,Meprin α 可水解炎性介质、胶原蛋白和生长因子,可以执行激活或失活各类活性物质的作用[13-15],但其在纤维化疾病中的具体作用机制,尚未完全了解。
在本研究中,给予重组Merpin α 预处理,能够显著抑制肺成纤维细胞的增殖、迁移,并抑制其向肌成纤维细胞分化和胶原沉积,提示Merpin α 具有抗纤维化作用的潜能。课题组最近的研究也显示,Merpin α 可被血管紧张素转化酶2、血管紧张素(1-7)信号所激活,从而促进Ac-SDKP的生成,减轻矽肺纤维化病变程度,抑制肌成纤维细胞分化[9]。上述结果说明,外源性给予重组merpin α 能够调节胶原代谢。由于merpin α 的器官定位、细胞定位以及形成寡聚蛋白成分不同,其作用机制可能不同,仍需进一步研究确定。
