外源性趋化因子在高糖环境下对人脐静脉内皮细胞功能的影响
2020-05-08胡海林
胡海林,罗 敏
目的:探讨高糖环境下外源性趋化因子CXCL9、CXCL10、CXCL11对人脐静脉内皮细胞(HUVEC)功能的影响及其机制。
方法:将对数生长期的细胞分为对照组(葡萄糖浓度5.5mmol/L)、低糖组(葡萄糖浓度5mmol/L)、高糖组(葡萄糖浓度30mmol/L),分别加入CXCL9(100ng/mL)、CXCL10(10ng/mL)、CXCL11(100ng/mL),培养24、48、72h,采用CCK-8法检测细胞增殖能力,RT-PCR检测CXCR3 mRNA的表达,免疫荧光法检测细胞增殖标志分子Ki-67阳性表达情况。
结果:CCK-8法检测结果显示,加入三种外源性趋化因子后,随着时间的延长,对照组细胞吸光度值逐渐增强;低糖组细胞吸光度值呈现先增强后降低的趋势,48h达到高峰;高糖组细胞吸光度值总体呈降低趋势。RT-PCR检测结果显示,加入三种外源性趋化因子后48、72h,低糖组和高糖组细胞CXCR3 mRNA表达水平均高于对照组,且均较同组24h时升高。免疫荧光检测结果显示,加入三种外源性趋化因子后72h,低糖组与高糖组细胞Ki-67荧光强度降低,高糖组变化更明显。
结论:高糖环境下外源性加入CXCL9、CXCL10、CXCL11可使HUVEC细胞活力下降并诱导CXCR3表达增强,且以外源性加入CXCL10、CXCL11配体后,CXCR3表达增幅最高,这可能成为临床干预糖尿病视网膜病变的靶点。
0 引言
糖尿病视网膜病变(diabetic retinopathy,DR)是糖尿病患者眼部最常见的并发症之一,是世界范围内主要的致盲性眼病[1-2]。DR患者表现为视力模糊,眼前有暗点或闪烁的灯光以及视力丧失,眼底检查表现为微血管瘤、出血、渗出、视网膜内微血管异常、静脉串珠样改变、新生血管等。糖尿病患者由于高血糖引起血管内皮细胞凋亡,氧化酶损伤,微血栓形成,细胞黏附分子活化,白细胞淤积和细胞因子活化,继之缺氧调节的生长因子表达增加和细胞因子产生导致微循环障碍。DR的发病机制包括异常代谢途径、氧化应激和慢性炎症等学说[3-4]。近年来,慢性炎症学说越来越受到国内外学者的关注。靶向抗炎治疗,如抗血管内皮生长因子(VEGF)或皮质类固醇类药物玻璃体腔注射等,可以在一定程度上延缓DR的发展[4-5]。
白细胞在视网膜微血管的黏附可能是激活DR复杂病理过程的起始途径,趋化因子参与了这一过程。趋化因子是细胞因子超家族中的一种由70~80个氨基酸组成,对白细胞等细胞具有趋化作用的小分子蛋白质[6]。γ-干扰素诱导的单核因子(CXCL9)、干扰素诱导蛋白10(CXCL10)、干扰素诱导的T细胞α化学引诱剂(CXCL11)是趋化因子CXCR3的3个配体[7-8]。CXCR3是表达在T细胞表面的趋化因子受体,能诱导趋化、细胞迁徙和黏附。临床研究表明,CXCR3在临床监测DR病情严重程度上具有一定价值[9]。动物研究也表明,CXCR3族趋化因子参与了DR的病程变化[10]。然而,CXCR3的3个配体在DR发展过程中所起的作用不明。因此,本研究从细胞学角度研究CXCR3的3个配体与DR病情之间的关联,以便为寻找治疗DR的靶点提供依据。
1 材料和方法
1.1材料
1.1.1细胞和试剂 人脐静脉内皮细胞(human umbilical vein endothelial cell,HUVEC)(上海细胞生物研究所);DMEM(Gibco,美国),抗生素(青-链霉素)、0.25%胰蛋白酶、胎牛血清(Hyclone,美国),CXCL9、CXCL10、CXCL11(Bioleng,美国),CXCR3抗体(Abcam,美国),CCK-8细胞活性检测试剂盒(同仁公司,日本),鼠抗Ki67单克隆抗体、Alexa Fluor 488羊抗鼠二抗、SYBR green one Real-time PCR试剂盒(TaKaRa,日本),Trizol试剂盒(Life technology,美国)。
1.1.2主要仪器 恒温CO2培养箱(Thermal,美国),倒置显微镜(OLYMPUS,日本),程序降温冻存盒(Nalgene,美国),-80℃低温冰箱(SANYO,日本),JB90-1定时磁力搅拌器(上海衡平仪器厂),PHS-2C型酸度计(上海伟业仪器厂),旋涡混合器MAXIMIX plus TM (Thermolyne,美国),台式低温离心机(Beckman Coulter,法国),电热恒温水温箱(上海医疗器械五厂),高速离心机(Beckman Coulter,美国),精密天平BS110S(Sartorius,德国),电泳仪及电转仪Mini Protein Ⅱ型(Bio-Rad,美国),制冰机F-120C-50型(HOSHIZAKI,日本),Envsion全波段酶标检测仪(PE,美国),电泳系统(电泳仪、电泳槽等),Bio-Rad GelDoc 2000成像系统,Stratagene Mxp3000荧光PCR仪。
1.2方法
1.2.1细胞培养与分组 HUVEC置于含10%胎牛血清的培养液中,37℃、5% CO2恒温孵育箱内培养,1~2d更换培养液,细胞融合率达到90%~95%后按1∶3以上的比例进行传代培养,约2~3d消化传代一次。将对数生长期的细胞分为对照组(葡萄糖浓度5.5mmol/L的培养基培养)、低糖组(葡萄糖浓度5mmol/L的培养基培养)、高糖组(葡萄糖浓度30mmol/L的培养基培养)进行实验。
1.2.2 CCK-8法检测细胞增殖能力 根据实验分组将HUVEC细胞接种至96孔板,每孔5000个细胞(200μL相应的培养基),分别加入趋化因子CXCL9、CXCL10、CXCL11,终浓度分别为100、10、100ng/mL。培养24、48、72h,向待测孔中加入20μL CCK-8试剂孵育2h后,在酶标检测仪450nm下检测吸光度值(OD)。检测3次,取平均值。
1.2.3 Real-time PCR检测CXCR3 mRNA的表达 根据实验分组将HUVEC细胞接种至6孔板中,每孔2×104个细胞,分别加入趋化因子CXCL9、CXCL10、CXCL11,终浓度分别为100、10、100ng/mL。培养24、48、72h。利用Trizol法抽提细胞总RNA,进行浓度检测后,使用反转录试剂盒合成cDNA。采用SYBR green 法对CXCR3进行Real-time PCR检测,管家基因GAPDH作为内参,以2-△△Ct值计算CXCR3 mRNA的相对表达量。CXCR3正向引物5’-CCACCTAGCTGTAGCAGACAC-3’,反向引物5’-AGGGCTCCTGCGTAGAAGTT-3’。GAPDH正向引物5’-GGAGCGAGATCCCTCCAAAAT-3’,反向引物5’-GGCTGTTGTCATACTTCTCATGG-3’。
1.2.4免疫荧光法检测细胞增殖标志分子Ki67含量 将HUVEC细胞接种至放置爬片的6孔板中,每孔2×104个细胞,孵育24h,换不同葡萄糖浓度的培养基并分别加入趋化因子CXCL9、CXCL10、CXCL11,终浓度分别为100、10、100ng/mL。72h后,去除培养基,PBS漂洗3次。用4%多聚甲醛固定10min,PBS漂洗3次,10%驴血清封闭30min;加入鼠抗Ki67单克隆抗体(1∶1000),4℃孵育过夜;次日用PBS漂洗3次,加入Alexa Fluor 488羊抗鼠二抗室温避光孵育2h,随后漂洗3次,10min/次,加入DAPI染色20min,PBS冲掉染色液后用滤纸吸干,封片后在荧光显微镜下进行观察。以细胞核出现绿色荧光为Ki67阳性染色,计数每视野荧光细胞数和总细胞数,并计算荧光细胞百分比。

2 结果
2.1外源性趋化因子对HUVEC细胞增殖的影响 CCK-8法检测结果显示,加入外源性趋化因子CXCL9、CXCL10、CXCL11后,随着时间的延长,对照组细胞吸光度值逐渐增强;低糖组细胞吸光度值呈现先增强后降低的趋势,48h达到高峰;高糖组细胞吸光度值总体呈降低趋势(表1)。加入三种趋化因子后24h,三组细胞吸光度值差异均无统计学意义(P>0.05);加入三种趋化因子后48h,高糖组与对照组细胞吸光度值差异有统计学意义(P<0.05),且加入CXCL11时低糖组与对照组细胞吸光度值差异有统计学意义(P<0.05);加入三种趋化因子后72h后,低糖组和高糖组细胞吸光度值分别与对照组比较,差异均有统计学意义(P<0.05),且加入CXCL10时低糖组与高糖组细胞吸光度值差异有统计学意义(P<0.05)。

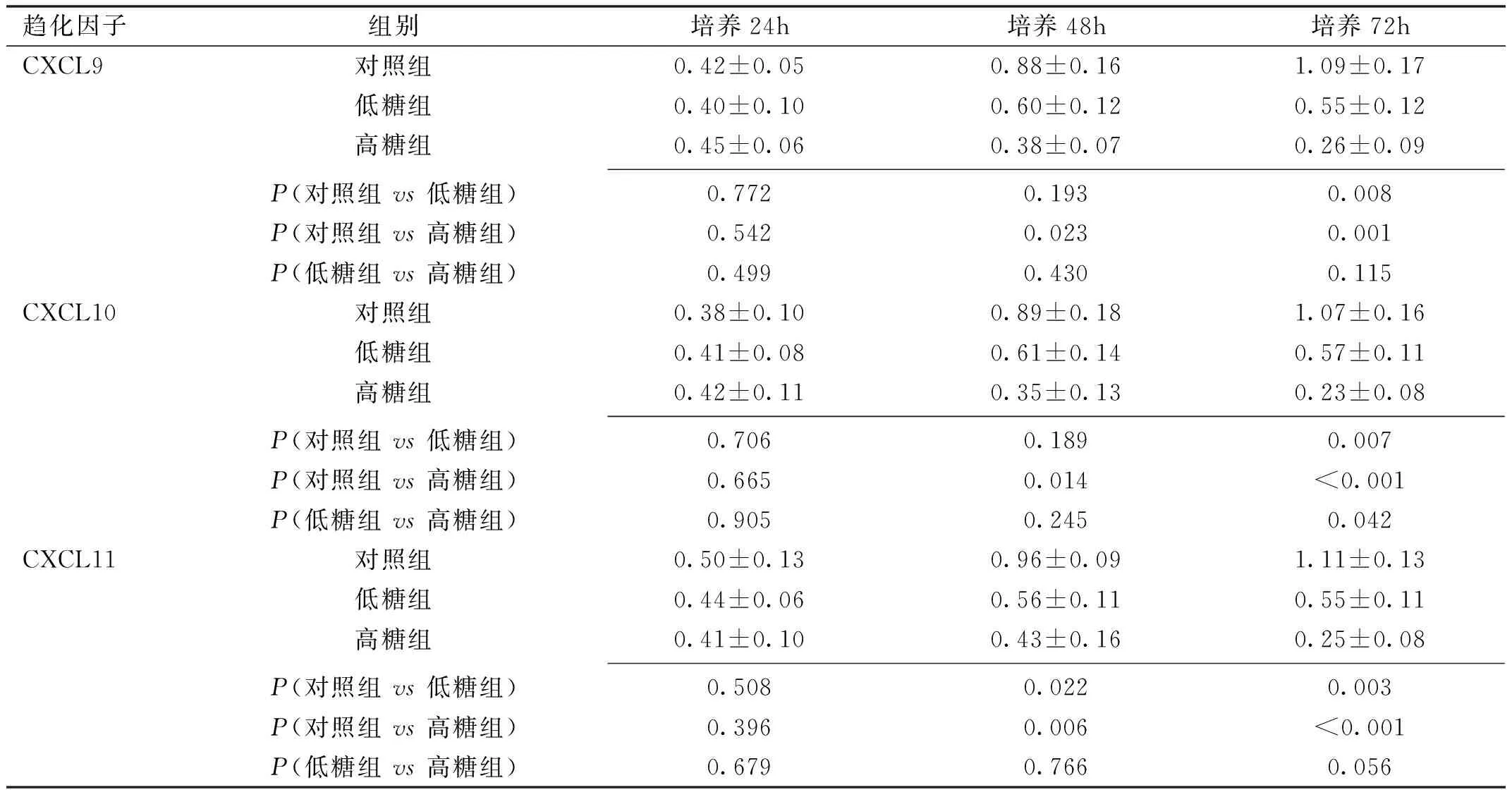
趋化因子组别培养24h培养48h培养72hCXCL9对照组0.42±0.050.88±0.161.09±0.17低糖组0.40±0.100.60±0.120.55±0.12高糖组0.45±0.060.38±0.070.26±0.09P(对照组 vs 低糖组)0.7720.1930.008P(对照组 vs 高糖组)0.5420.0230.001P(低糖组 vs 高糖组)0.4990.4300.115CXCL10对照组0.38±0.100.89±0.181.07±0.16低糖组0.41±0.080.61±0.140.57±0.11高糖组0.42±0.110.35±0.130.23±0.08P(对照组 vs 低糖组)0.7060.1890.007P(对照组 vs 高糖组)0.6650.014<0.001P(低糖组 vs 高糖组)0.9050.2450.042CXCL11对照组0.50±0.130.96±0.091.11±0.13低糖组0.44±0.060.56±0.110.55±0.11高糖组0.41±0.100.43±0.160.25±0.08P(对照组 vs 低糖组)0.5080.0220.003P(对照组 vs 高糖组)0.3960.006<0.001P(低糖组 vs 高糖组)0.6790.7660.056
注:CXCL9:F时间=11.14,P时间=0.002;F组间=15.18,P组间=0.004;F组间×时间=12.51,P组间×时间<0.001。CXCL10:F时间=11.46,P时间=0.002;F组间=19.38,P组间=0.002;F组间×时间=12.35,P组间×时间<0.001。CXCL11:F时间=13.13,P时间=0.001;F组间=29.95,P组间=0.001;F组间×时间=13.61,P组间×时间<0.001。


趋化因子组别培养24h培养48h培养72hCXCL9对照组1.01±0.201.07±0.191.04±0.18低糖组3.20±1.204.20±0.804.37±0.51高糖组4.46±0.955.40±0.675.30±0.51P(对照组 vs 低糖组)0.0710.002<0.001P(对照组 vs 高糖组)0.009<0.001<0.001P(低糖组 vs 高糖组)0.3980.1570.019CXCL10对照组1.05±0.211.00±0.201.01±0.19低糖组3.20±1.084.60±0.804.33±0.51高糖组4.80±1.306.10±0.406.00±1.11P(对照组 vs 低糖组)0.1080.0100.004P(对照组 vs 高糖组)0.0100.002<0.001P(低糖组 vs 高糖组)0.2800.2910.036CXCL11对照组0.98±0.210.98±0.181.02±0.23低糖组3.14±1.153.73±1.124.06±0.39高糖组4.33±0.765.67±0.725.50±0.49P(对照组 vs 低糖组)0.0510.015<0.001P(对照组 vs 高糖组)0.0070.001<0.001P(低糖组 vs 高糖组)0.3640.0660.003
注:CXCL9:F时间=19.41,P时间<0.001;F组间=35.42,P组间<0.001;F组间×时间=4.48,P组间×时间=0.019。CXCL10:F时间=45.12,P时间<0.001;F组间=23.22,P组间=0.001;F组间×时间=13.74,P组间×时间<0.001。CXCL11:F时间=12.26,P时间=0.001;F组间=38.8,P组间<0.001;F组间×时间=3.71,P组间×时间=0.034。
2.2外源性趋化因子对HUVEC细胞CXCR3 mRNA表达的影响 RT-PCR检测结果显示,外源性趋化因子CXCL9、CXCL10、CXCL11加入48、72h后,低糖组和高糖组细胞CXCR3 mRNA表达水平高于24h(表2)。加入外源性趋化因子CXCL9、CXCL10、CXCL11后 24h,高糖组细胞CXCR3 mRNA表达水平比对照组高,差异均有统计学意义(P<0.05);加入三种趋化因子后48h,低糖组、高糖组细胞CXCR3 mRNA表达水平与对照组差异均有统计学意义(P<0.05);加入三种趋化因子后72h后,低糖组、高糖组细胞CXCR3 mRNA表达水平与对照组,低糖组和高糖组差异均有统计学意义(P<0.05)。
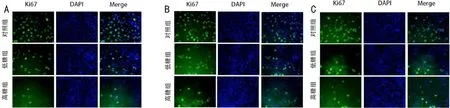
图1 加入外源性趋化因子后72h Ki-67免疫荧光显色图(×40) A:加入CXCL9;B:加入CXCL10;C:加入CXCL11。


组别CXCL9CXCL10CXCL11对照组37.0±5.244.2±4.140.7±4.6低糖组20.7±4.516.7±4.324.5±3.5高糖组16.8±2.516.2±2.615.2±4.9 P(对照组 vs 低糖组)0.0150.0010.008P(对照组 vs 高糖组)0.0040.0010.003P(低糖组 vs 高糖组)0.2600.8720.056
注:FCXCL9=19.302,PCXCL9=0.002;FCXCL10=54.939,PCXCL10<0.001;FCXCL11=26.102,PCXCL11=0.001。
2.3外源性趋化因子对HUVEC细胞增殖标志分子Ki67表达的影响 免疫荧光检测结果显示,加入外源性趋化因子CXCL9、CXCL10、CXCL11后72h,与对照组相比,低糖组与高糖组细胞Ki-67荧光强度降低,阳性细胞数明显减少,差异均有统计学意义(P<0.05),且高糖组降低更明显(图1,表3)。
3 讨论
随着糖尿病患病人数的增多,DR的发病率也越来越高[11]。有研究人员在2017年对我国山东等省糖尿病患者进行调查发现,DR发病率高达34.08%[12]。随着DR病情的进展,可造成不可逆的视力损害,对视觉健康造成巨大的影响,因此找到DR的治疗靶点至关重要[13]。研究表明,DR是一种高血糖引起的视网膜慢性低度炎症性疾病[14]。动物和临床实验均证实,CXCR3参与这一炎症反应过程,但其配体CXCL9、CXCL10、CXCL11和CXCR3结合后在DR发展过程中所起的作用不明,本研究从细胞学角度研究CXCR3的3个配体与DR病情之间的关联,从而为发现DR治疗的靶点提供一定的依据。
有研究认为,CXCL9通过与相应受体相互作用,活化各类白细胞并趋化至病灶处,调节免疫细胞的迁移,在炎症性疾病的发病过程中起着关键性作用[15]。CXCL10对于T细胞的发育、迁移、黏附起着重要作用,还能够活化单核细胞及自然杀伤细胞,参与多种自身免疫疾病的发生发展过程[16]。 CXCL11和受体结合后,可以诱导T细胞迁移,产生促炎作用,抑制血管内皮生长,调控血管生成等[17]。
本研究中,CCK-8法检测结果显示,在加入三种外源性趋化因子后,随着时间的延长,对照组细胞吸光度值逐渐增强,低糖组48h达到高峰,72h又呈下降趋势,而高糖组除加入CXCL11 48h时略有增长外,总体呈降低趋势。该结果表明高糖环境下,加入三种外源性趋化因子后,细胞生长抑制,细胞活力下降,这与既往研究结果一致[18]。此外,RT-PCR检测结果表明,加入三种外源性趋化因子后,低糖组和高糖组细胞CXCR3 mRNA较对照组均出现增高的趋势,且在48、72h时有统计学差异,提示三种外源性趋化因子和CXCR3的作用存在一定的时间性。高糖环境下,三种外源性趋化因子与CXCR3作用引起其表达下降拐点出现在48h,分析早期高糖环境下趋化因子能招募免疫细胞(如Th1细胞),发挥抑制血管新生作用[19]。目前,国内关于CXCL9、CXCL10及CXCL11与DR的相关报道较少,推测可能是该三种外源性趋化因子有不同的调控机制,其表达有不同的时间性和空间性,在不同的条件下有不同的优势因子,所以该三种趋化因子与DR及其临床表现的相关性并不完全一致。
综上,本研究表明,高糖环境下外源性加入CXCL9、CXCL10、CXCL11可使HUVEC细胞活力下降并诱导CXCR3表达增强,且以外源性加入CXCL10、CXCL11配体后,CXCR3表达增幅最高,这可能成为临床干预糖尿病视网膜病变的靶点。
