聚集诱导发光材料在生物分子检测中的应用
2020-05-08马拉毛草马恒昌
马拉毛草,马恒昌
(1.西北师范大学 逸夫图书馆,甘肃 兰州 730070;2.西北师范大学 化学与化工学院,甘肃 兰州 730070)
2014年诺贝尔化学奖颁发给了发现超高分辨率荧光显微技术的三位科学家,该技术的发现实现一场细微至分子水平的荧光检测技术变革[1-2]。在2001年,唐本忠院士研究小组首次提出“聚集诱导发光”(AIE)的概念突破了传统荧光材料在聚集态时极易发生荧光猝灭(ACQ)的缺陷,实现了AIE材料在化学、生物、医学等各个方面的快速发展[3]。与ACQ荧光团相反,聚集诱导发射(AIE)材料在单分子溶液中不发光或者发光很弱,但在聚集体形成时强烈地发射,荧光急剧增强[4]。可以说,AIE现象的发现为荧光材料领域提供了一个崭新的研究方向。目前AIE荧光材料已很好地应用在了生物成像、医学诊断以及治疗的各个方面,并取得了瞩目的研究成果[5-6]、基于研究者们对于AIE研究的深切关注,RIM机制的AIEgens已经开发了许多,如四苯乙烯(TPE)[7]、六苯基噻咯(TPS)[8]、喹啉腈(QM)[9]和有机硼配合物[10]等。已有多种基于AIE传感原理,总结如下:①自组装与分析物形成高度发射通过各种非共价相互作用聚集,包括静电、氢键、范德华和金属-配体相互作用[11];②与靶向配体的络合,通过限制分子内运动来识别分析物和开启荧光[12];③与酶或特定化学物质反应以裂解溶解促进配体并降低溶解度以形成聚集体[13];④光物理猝灭过程的破坏,例如光致电子转移(PET)[14]、分子内电荷转移(ICT)[15]和荧光共振能量转移(FRET)[16]过程。本文综述了AIE的产生机理以及在生物检测方面的应用,并对AIE材料在未来的应用前景进行了展望。
1 AIE的机理
从AIE的机理出发研究潜在机制对于寻求光物理学的基础知识非常重要。它将指导我们设计新型发光剂,探索实际应用和促进技术创新的发展。自从2001年AIE概念出现以来,研究人员一直努力去揭示AIE现象的真正机制和原因。已经假设了许多机理途径,包括构象平面化、J-聚集体形成、E/Z异构化、扭曲分子内电荷转移(TICT)和ESIPT[3]。本文对AIE产生的机理进行了总结,主要分为分子内振动受阻(RIR)[17]、分子内旋转受阻(RIV)[18-19]和分子内运动受限(RIM)[20-21]。
1.1 分子内振动受阻(RIR)
目前对于AIE机理的一种说法是分子内振动受阻(RIR),研究者们以六苯基噻咯(HPS)为例[17],仔细研究了HPS的结构,发现在一个HPS分子中,噻咯核心共装饰有六个苯基通过单键连接,分子像螺旋桨一样构造,外围苯环和中心硅杂环平面之间存在大的扭转角度。由于其高度扭曲以及和相邻的苯环之间的空间位阻,一种致密的面对面堆叠结构不可能存在,因此,HPS分子实际上在固态下没有π-π堆叠相互作用。
1.2 分子内旋转受阻(RIV)

1.3 分子内运动受阻(RIM)
RIM机制是RIR和RIV机制的统一。RIM的结果说明RIR和RIV机制不是相互排斥的,而是可以共同起作用来实现AIE现象。它可以试图解释和创造其它关于AIE的荧光材料的设计与开发,可以增强孤立单分子的非辐射衰减,然而结构刚性阻挡这些无辐射通道,通过辐射通道引导激子的弛豫,即导致强烈的荧光发射[20-21]。
2 AIE荧光材料在生物检测方面的应用
在生活的各个领域中,对于物质检测仍然充满着无限的吸引力,需要分析无数的生物物种,需要揭示、监测甚至调节无数的生物/生理过程[22]。发光技术凭借其卓越的灵敏度、简单性、快速性、可视性、实时性和现场响应性、经济适用性、高时空分辨率、无创性等优点,已成为生物应用的理想选择[23]。鉴于此,发光可以作为生物分析过程的直接可视化的有用工具[24]。如今,发光材料一直是科研领域热点研究方向之一。各种各样的发光材料,包括有机染料[25]、有机纳米粒子[26]、无机纳米粒子[27]和荧光蛋白[28]已被开发并用作生物探针。
然而,大多数有机发光体通常具有ACQ效应,一旦发光体分子聚集,由于π-π堆积,发光将部分或完全淬灭,这种效果极大地限制了它们作为生物探针的应用[5]。与传统的在聚集态下引起的ACQ材料相反,新出现的聚集诱导发射材料在聚集状态下具有高发射效率、高信噪比、强光稳定性和大斯托克斯移位,这为各种传感材料应用提供了独特的机会[3]。

2.1 生物小分子识别探针
2.1.1 ATP检测探针 在2017年,陆仲林课题组设计了一种AIE型的ATP分子探针[29]。由于Cu2+和5-三磷酸腺苷(ATP)在细胞代谢过程中起重要作用,因此建立人工化学传感器检测它们具有非常重要的意义[30]。作者基于四苯乙烯(TPE)两亲物在水溶液中自组装产生聚集诱导发射(AIE)胶束,用于序列识别Cu2+和ATP,并且具有高选择性和高灵敏度。具体思路是将Cu2+引入探针的100%水溶液中,就形成由探针和Cu2+以1∶2化学计量组成的复合物,导致显著的荧光猝灭。在原位生成的Cu2+溶液中加入ATP可以很容易地恢复系统的荧光。Cu2+和ATP的检测限(LoD)为1.0×10-7mol/L和1.5×10-6mol/L。该复合物均具有低细胞毒性和良好的细胞膜通透性,已成功应用于HepG2细胞中的对Cu2+离子的检测和ATP图像。
2.1.2 Ag+检测探针 在2017年,Atul Goel课题组设计了一个Ag+识别探针[12]。通过简便途径合成新的四苯乙烯(TPE)结合物,该独特的基于TPE的聚集诱导发射的化合物,当研磨时发射从蓝色变为绿色时,显示出明显的压致变色性质,当用溶剂还原时荧光发射从绿色又变到蓝色。通过TPEN的压致变色特性,可以制备用于安全文档的无墨可重写纸。TPEN的详细光物理研究表明,发现其对银离子(Ag+)的敏感性高于其他金属离子,在水系统中检测限为0.25 μmol/L。在光物理研究中,在质量分析和高分辨率质谱分析的基础上,TPEN和银离子的络合物的化学计量被确定为2∶1(TPEN∶Ag+)。
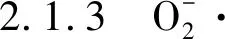
2.1.4 H2S检测探针 目前溶酶体中H2S响应性荧光探针通常具有ACQ现象并且遭受不可避免的背景荧光信号[32]。为了解决这个问题,2018年,陈建课题组将具有H2S识别的聚集诱导发射材料与光致变色螺吡喃部分结合起来,设计出了新型光路转换型AIE纳米探针(DNBS-DCM-SP)[33],用于溶酶体中H2S的检测。在H2S存在下,吸电子DNBS部分将通过H2S诱导的Se—O键断裂,在约592 nm处荧光发生明显的增强。制备得到的纳米探针显示出良好的灵敏度(5.0 nmol/L)和高特异性(特别是针对其他硫醇)。此外,H2S激活的AIE纳米探针(DCM-SP)的荧光可以通过选择性荧光共振能量转移(FRET),通过交替的紫外/可见光照射从AIE荧光团(DCM)可逆地切换到螺环吡喃的开环状态。并且,通过观测活细胞内源性H2S的产生以及可逆双色荧光成像,也证明了制备的光可切换AIE纳米探针的可行性。
2.1.5 氨基酸检测探针 氨基酸作为构成蛋白质的基本单位,与基体正常表达有着非常直接的关系,因此,对于氨基酸的检测显得尤为重要[34]。2019年,马骧课题组开发了具有结构简单的红色荧光发射材料,通过简单地将共同电子给体(D)和受体(A)通过π桥结合,设计了一种具有分子内电荷转移(ICT)效应的新型简单AIE活性红色发光体,并通过逐步不对称Knoevenagel缩合简便地合成。其AIE属性来自非平面3D配置和多个转子,ICT效应源于其D-A电子结构[35]。这种醛基官能化的AIEgen具有以点亮方式特异性检测含巯基氨基酸的能力,在2 min内具有显著的荧光蓝移。动力学的显著差异使得该探针能够区分半胱氨酸(Cys)和同型半胱氨酸(Hcy)与谷胱甘肽(GSH)。更重要的是,它显示出对Ccy的Hcy更高的敏感性。此外,当Cys浓度高于250 μmol/L时,显著的荧光增强和Hcy的紫外-可见吸收光谱中的明显蓝移显示出该AIEgen可用作Cys/Hcy相关指示剂的潜力。
2.2 生物大分子识别探针
由于临床诊断的强烈要求,生物大分子的荧光传感引起了人们的广泛关注。已经开发出AIE传感器用于感测各种生物大分子,例如霍乱毒素[36]、凝集素[37]、γ-球蛋白[38]和G-四链体DNA[39]。
2.2.1 肝素识别探针 近年来,用于构造人工功能材料的分级自组装研究引起了人们的广泛关注。基于配位键的离散金属环已被证明是通过分级自组装制造各种超分子聚合物或智能软物质的有效途径。
在2015年,杨海波课题组通过多次静电相互作用,利用有机铂(II)金属环骨架的正电荷,提出了离散金属环的分级自组装的第一个例子[40]。肝素是一种广泛用作抗凝血药物的硫酸化糖胺聚糖聚合物,由于存在多种负电荷,因此被选择用于诱导分级自组装。为了研究分级自组装过程,通过配位驱动的自组装将聚集诱导发射(AIE)活性部分四苯基乙烯(TPE)引入金属环。光物理研究表明,在tris-TPE金属环状溶液中加入肝素可以显著增强荧光,这有助于金属环和肝素之间的聚集,这是由多种静电相互作用驱动的。此外,通过SEM、TEM和LSCM实验检测到的纠缠珍珠项链网络是通过分层自组装获得的。特别地,在AFM和TEM图像中观察到单珠状链,其为带正电荷的金属环和带负电荷的肝素的聚集提供直接的视觉证据。更有趣的是,进一步的光学研究表明,这种TPE装饰的金属环可以作为肝素检测的开启荧光探针,具有高灵敏度和高选择性。
2.2.2 半胱天冬酶-3识别探针 在2016年刘斌课题组报道了一种自我验证的荧光探针[41],其由作为能量供体的香豆素荧光团和具有聚集诱导的发射特征的荧光剂(AIEgen)组成,作为通过半胱天冬酶-3特异性肽底物连接的能量猝灭剂。与传统上广泛研究的荧光共振能量转移(FRET)探针不同,该课题组设计的新一代FRET探针本身是非荧光的,因为能量转移以及通过AIEgen的自由分子运动耗散受体能量。在与半胱天冬酶-3相互作用后,由于供体-猝灭剂的分离和释放的AIEgen的聚集,探针同步显示强绿色和红色荧光信号。双信号放大的荧光开启允许实时和自我验证的酶检测具有高信号背景比,提供了以实时方式准确监测各种生物过程的良好机会。
2.2.3β-半乳糖苷酶识别探针 在2017年,王江国课题组开发了一种β-半乳糖苷酶的检测探针[42]。首先,作者通过测量其正辛醇/水分配系数(logP)来评估TPE-Gal的亲水性。TPE-Gal的logP确定为0.6,表明其两亲特性,这有利于细胞渗透。还使用MTT方法研究了TPE-Gal对HeLa细胞的细胞毒性,结果发现细胞活力几乎不受10 mmol/L TPE-Gal的影响,表明TPE-Gal的细胞毒性低。然后建立模型,利用来自人卵巢癌患者的OVCAR-3细胞已证实内源性b-半乳糖苷酶,TPE-Gal的过度表达,显示内源性b-半乳糖苷酶的明显增亮成像,并且,信号被点亮后又急剧下降。总之,鉴于TPE-Gal的简单性,高特异性和生物相容性,这种策略可能在癌症诊断和评估癌症化疗的效率方面具有很高的应用潜力。
2.2.4 碱性磷酸酶(ALP)识别探针 2014年,唐本忠课题组通过对2′-羟基查尔酮的简单修饰,开发了一种新型比率荧光生物探针[43],具有AIE特征和ESPIT特性,可用于缓冲液和血清样品中的ALP活性测定。在存在ALP的情况下,生物探针的发射从黄绿色变为红色。生物探针能够在0~150 mU/mL的浓度范围内进行ALP检测,检测限为0.15 mU/mL,与以前的文献相比具有突出的优势。此外,酶残留物的红色发射可防止血清样品的自发荧光干扰。荧光探针还可用于检测细胞间液中的ALP和相应活细胞的可视化。分子设计策略提供了一个综合实例,利用天然产物构建具有高灵敏度和聚集状态的红色荧光发射的比率荧光探针。
3 结论与展望
本文从AIE的机理出发,阐述了AIE的发光机制,总结了基于AIEgen材料在生物检测方面的一些最新进展。AIEgens在生物应用方面非常有前途。在荧光生物成像和治疗诊断过程中,通过巧妙的生物探针设计,AIEgens的“点亮”适用于识别各种生物分析物,包括核酸、蛋白质和其他大分子,以及细胞内状态等。此外,如果在这些AIE应用中使用亲水设计,也可以实现无洗涤检测,这对于高精度和高可靠性的生物过程的实时监测具有重要意义。总而言之,AIE材料应用的大门已经打开,更多的应用探究还需要研究者们去继续探索。
