ATRP接枝壳聚糖分子及其对阿苯达唑载药性能研究
2020-05-08赵磊赵聪思任雷强王明亮唐二军刘少杰
赵磊,赵聪思,任雷强,王明亮,唐二军,刘少杰
(河北科技大学 化学与制药工程学院,河北 石家庄 050018)
包虫病是人畜共患寄生虫病,严重危害人类健康和影响畜牧业发展[1],常用的药物阿苯达唑[2]治疗效果较好,但其细胞毒性大、生物利用度差,选用药物辅料可使药物缓控释放,提高苯并咪唑类药物生物利用度。纤维素[3]和壳聚糖[4]是常用的药用辅料,在其分子骨架接枝功能性分子刷,制备环境敏感型药用辅料[5-10],在药物负载及药物缓释方面发挥着越来越重要的作用。
本文在离子液体[Amim]Cl中,采用ATRP技术在壳聚糖上接枝分子量分布窄、分子量分布均匀的NIPA分子刷,制成温敏性CS-g-NIPA共聚物,用透析法包载模型药物阿苯达唑,并对其体外释药机制进行研究,以期使阿苯达唑作用时间持续而平稳,增加药物吸收率,提高药效。
1 实验部分
1.1 原料与仪器
壳聚糖 (CS)、溴化亚铜(CuBr)、乙二胺、三乙烯四胺、N,N-2-甲基-1,3-丙二胺、四氢呋喃(THF)、阿苯达唑均为分析纯;2-溴代异丁酰溴(BiB)、N-异丙基丙烯酰胺、N,N,N',N″,N″-五甲基二乙烯基三胺(PMDETA)均为优级纯。
FTS-13型傅里叶红外光谱仪;MSL500型核磁共振光谱仪;S-4800型场发射扫描电镜;100CX-Ⅱ型透射电子显微镜;Bruker D8型X射线衍射仪;UV2550紫外分光光度计。
1.2 实验方法
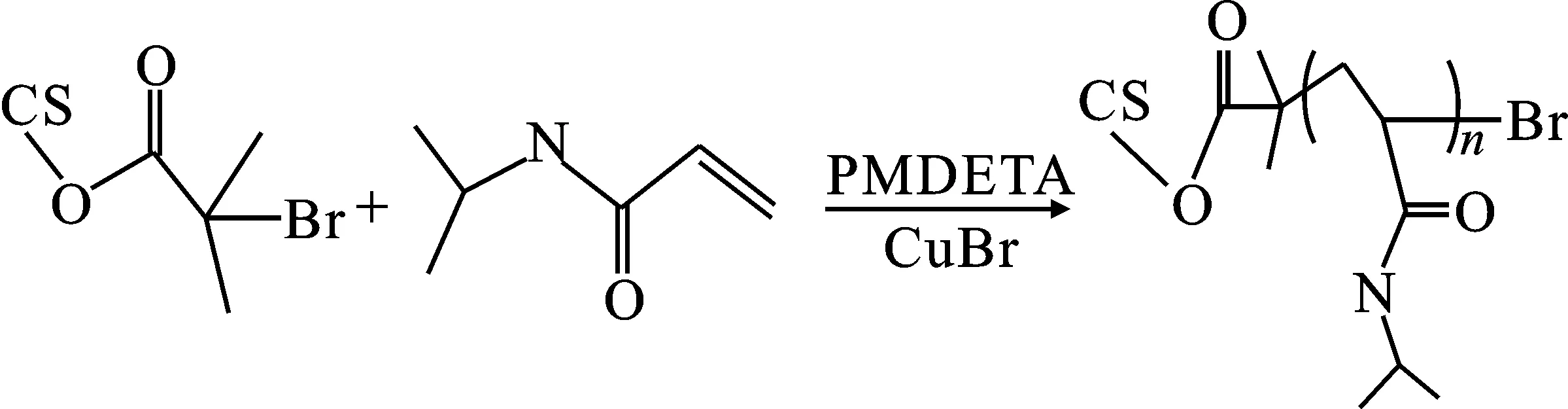
1.2.1 CS-g-NIPA聚合物的合成 称取一定配比的[Amim]Cl 和CS于三口烧瓶,将其固定在油浴锅内进行加热搅拌反应,反应温度维持在80 ℃,待CS溶解后,在冰水浴的条件下,将甲苯和2-溴代异丁酰溴的混合液采用恒压滴定管慢滴于上述三口烧瓶内,室温条件下反应24 h后,将三口烧瓶内的反应物和产物倒入盛有大量蒸馏水的烧杯内,析出大量白色沉淀物质,通过抽滤、洗涤、冷冻干燥等步骤即得到大分子引发剂CS-g-BiB[11];取一定量的CS-g-BiB、[Amim]Cl于三口烧瓶中,一定温度下,搅拌至CS溶解。在氮气保护下,加入一定配比的CuBr、1,3-丙二胺、 NIPA,在一定温度下反应12 h。经过洗涤,用透析袋透析、冷冻干燥得到壳聚糖接枝共聚物CS-g-NIPA。合成路线见下式。

1.2.2 胶束的制备 量取一定量的DMF、DMSO于三口烧瓶中,加入一定质量比的模型药物阿苯达唑和CS-g-NIPA,超声30 min,在室温下进行搅拌,24 h后加入2 mL蒸馏水,诱导聚合物形成载药胶束。之后将中间体放于透析袋(截留分子量为3 500)中每6 h换1次水,透析48 h,冷冻干燥后可得到载药胶束;在不放药物的前提下,进行上述操作即可获得空白胶束。
1.3 药物释放实验
1.3.1 药物释放实验 在无水乙醇和冰醋酸的缓冲溶液中放10 mg载药胶束进行溶解,将溶液移动到透析袋(截留分子量为3 500)并封密,置于90 mL相应外界缓冲溶液中,并在水浴锅中进行药物释放实验。分别在10,13,16,19,22,25,28,31,34,37,40,43,46 ℃取10 mL外界释放液,同时加入10 mL的新鲜缓冲溶液。在相应的波长下,检测缓冲液中的药物含量,每组实验重复3次,取平均值。
1.3.2 标准曲线的绘制和体外药物释放率的计算 将一定量的阿苯达唑溶于缓冲液中,用紫外分光光度计测出阿苯达唑的最大吸收波长为240 nm,标准曲线方程为:Y=0.091 47X-0.217 4 (R2=0.999 43);取载药胶束粉末10 mg放入到缓冲液中,在波长为240 nm的前提下,测阿苯达唑的吸光度,可得出聚合物胶束内的药物含量。载药胶束在不同外界环境下的累积药物释放量(%)用下式[12]计算:
式中W0——10 mg载药胶束中含有的药物质量,mg;
Cn——检测时间内第n次测量时释放液中药物的浓度,mg/L;
Cn-1——第n-1次测量时释放液中药物的浓度,mg/L;
ΣCn-1——前n-1次测量出的药物浓度之和,mg/L。
2 结果与讨论
2.1 CS-g-NIPA接枝聚合物的红外表征
分别对CS(曲线c)、CS-g-BiB(曲线b)、CS-g-NIPA(曲线a)进行红外表征分析,结果见图1。

图1 CS、CS-g-BiB和CS-g-NIPA 聚合物红外表征

2.2 CS-g-NIPA接枝聚合物扫描电镜表征
利用SEM对CS和CS-g-NIPA表面形貌进行测试,观察表面形态变化,结果见图2。


图2 CS 和 CS-g-NIPA胶束的投射电镜图
由图2可知,CS(图a)的表面密实且平滑,而接枝到壳聚糖上的NIPA分子刷,使得接枝共聚物(图b)的表面粗糙,凹凸不平。这表明利用ATRP法制备了CS-g-NIPA,并且改变了壳聚糖的表面形态,能够为其以后的应用奠定良好的基础。
2.3 CS-g-NIPA的GPC测试
利用凝胶渗透色谱测定侧链NIPA的分子量和分子量分布(Mw/Mn),结果见图3。

图3 CS-g-NIPA凝胶渗透色谱图
由图3可知,侧链N-异丙基丙烯酰胺呈单峰分布,其分子量(Mn)为276 451,分子量分布(Mw/Mn)为1.27,此结果表明利用ATRP法合成的聚合物CS-g-NIPA的侧链具有较大的数均分子量,较窄的分子量分布,反应呈现出良好的可控性,有利于聚合物CS-g-NIPA自组装形成形状规则的胶束。
2.4 载药前后的红外光谱分析
对CS-g-NIPA、阿苯达唑载药胶束、阿苯达唑和阿苯达唑与CS-g-NIPA的混合物进行红外检测,结果见图4。
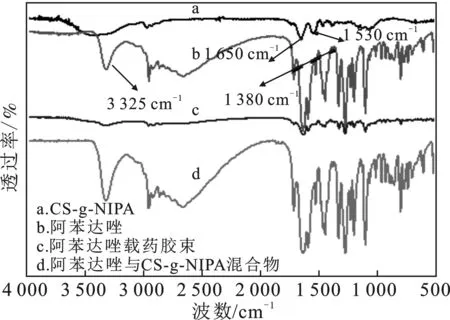
图4 CS-g-NIPA空白胶束(a)、阿苯达唑(b)、阿苯达唑载药胶束(c)和阿苯达唑与CS-g-NIPA混合物空白胶束(d)红外表征
由图4可知,在曲线b与曲线d中3 325 cm-1处出现 —OH的红外特征峰;在曲线a中1 650 cm-1处出现羰基的吸收峰,1 530 cm-1处出现了N—H及C—N的吸收峰;在曲线b中1 380 cm-1处出现了阿苯达唑的红外特征峰。曲线a、曲线b和曲线d比较可知,曲线d的特征峰只是曲线a与曲线b的特征峰的重叠相加,曲线d的特征峰还是以曲线b的特征峰为主,说明物理混合红外光谱主要表现为阿苯达唑的红外光谱特征;将曲线a、曲线b和曲线c的红外图谱对照发现,曲线c的特征峰与曲线a的特征峰相近,并且曲线b的特征峰与曲线c的特征峰对比发现,曲线c的特征峰明显减弱,这可能是胶束已把阿苯达唑包裹,其分子振动受到约束,在对应的红外特征峰处峰形变宽或不见[13]。包裹有阿苯达唑的聚合物胶束没有出现新的特征峰,表明包覆过程只是一个物理过程,没有发生化学反应;由红外光谱结果可以发现,已经合成了阿苯达唑载药胶束。
2.5 聚合物胶束形态表征
通过ATRP法在疏水性的壳聚糖表面接枝上了亲水性的温敏性基团,聚合物可自组装形成核壳结构的胶束,因此利用透射电镜对CS-g-NIPA空白胶束、包载阿苯达唑的载药胶束形态进行观察,结果见图5。

图5 空白胶束和CS-g-NIPA载药胶束的电镜图
由图5a可知,CS-g-NIPA的自组装胶束呈现出规则的球形结构,形态稳定,这可能是因为胶束壳层的NIPA分子内有亲水性的酰胺基和疏水性的异丙基,壳层向溶液中的溶解趋势较小,呈现出规则的球状结构;与图5a相比较,图5b中 CS-g-NIPA包载有阿苯达唑的胶束粒径有所增大,并且载药后胶束无明显交联现象。胶束具有明显的内核-外壳结构,分散性较好,形态较稳定。这表明了聚合物CS-g-NIPA的胶束对阿苯达唑具有良好的包覆性能。
2.6 聚合物胶束对药物阿苯达唑的载药性分析及体外释放研究
探究阿苯达唑与CS-g-NIPA的质量比对载药率和包封率的影响。当固定CS-g-NIPA的质量为40 mg,加入药物阿苯达唑与CS-g-NIPA的质量比为1∶2、1∶4与1∶8时,对载药胶束的载药率与包封率进行了检测,结果见表1。

表1 阿苯达唑与CS-g-NIPA的质量比对胶束载药率和包封率的影响
由表1可知,随着阿苯达唑与CS-g-NIPA质量比的增加,载药后胶束的粒径和载药率增加,包封率下降。当阿苯达唑与CS-g-NIPA的质量比由1∶2增加到1∶1时,阿苯达唑载药胶束的载药率由50.89%增长到53.45%,而其包封率由51.77%下降到32.13%。对比质量比为1∶8与1∶4时载药胶束,其载药率增长的并不明显,但是包封率明显下降。说明阿苯达唑与CS-g-NIPA的质量比为1∶2时,得到的阿苯达唑载药胶束的载药效率的理论值最高。
对阿苯达唑与胶束CS-g-NIPA的质量比为 1∶2,1∶4与1∶8的载药胶束做体外药物阿苯达唑的释放实验,利用公式Y=0.091 97X-0.217 4可以计算出在不同温度下载药胶束对药物阿苯达唑的释放情况,结果见图6。

图6 不同质量比的载药胶束的药物释放曲线
由图6可知,药物阿苯达唑的累积释药量随温度的增加一直在增大,载药胶束的累积释药量在31 ℃ 时有一个明显的上升过程,但是在37 ℃以后药物的累积释药量变化并不明显,并且体外累积释药量的曲线有趋于平缓的趋势,说明载药胶束在31~37 ℃之间具有明显的温敏性。对比阿苯达唑与载药胶束质量比为1∶2,1∶4和1∶8时的累积释药量曲线,发现当质量比为1∶2时,体外累积释药量最大,达到了86.47%,理论值与实际值达到一致。
将阿苯达唑与载药胶束质量比为1∶2的载药胶束在不同温度下进行药物释放实验,以时间作为横坐标,药物累计释放量作为纵坐标作图,结果见图7。

图7 不同温度的载药胶束的药物释放曲线
由图7可知,在30 ℃时,温度过低药物的释放受温度影响较小,药物的释放行为相对最慢,并且累计释放量在20 h后仅为36.84%;在温度为35 ℃ 时药物释放曲线较为稳定,释药时间最长可达30 h,并且释放量高达77.37%;当温度为40 ℃时,药物的累积释放量在短时间内剧增,5 h已经高达68.47%,对药物缓释最快。不同比例载药胶束的药物释放曲线表明,载药胶束在31~37 ℃之间具有明显的温敏性,当药物阿苯达唑与胶束CS-g-NIPA的质量比为1∶2时,体外累积释药量达到最高;由不同温度的载药胶束的药物释放曲线进一步表明,阿苯达唑与载药胶束质量比为1∶2的壳聚糖载药胶束在 35 ℃时的累积释放时间可高达30 h,累积释药量高达77.37%,并且药物释放曲线较为平缓,对阿苯达唑具有很好的控释作用,在包虫病的治疗上有较好的应用前景。
载药胶束在不同温度条件下对模型药物的释放结果示意图见图8。

图8 低温与高温条件下药物释放机制
当温度升高时,H2O分子与 —CO—NH— 基团之间的氢键作用被削弱,NIPA与水的相容性减弱,构象从伸展的链变为卷曲收缩的链。NIPA支链的这种溶胀/收缩热可逆性,使CS-g-NIPA微球对所包封的药物产生热响应性释放控制。由图8可知,用CS-g-NIPA胶束包载药物阿苯达唑,在LCST以下,接枝链在水中舒展开来,彼此交叉覆盖,阻塞了胶束的孔洞,被包封的药物扩散受阻,处于“关”状态;温度在LCST以上时,接枝链自身收缩,孔洞显现出来,使药物顺利扩散到水中,处于“开”状态[14]。
3 结论
采用ATRP技术制备的温敏性聚合物CS-g-NIPA分子量分布窄且均匀,当其与阿苯达唑的质量比为2∶1时,阿苯达唑载药胶束在31~37 ℃之间具有良好的温敏性和释药性,这也为治疗包虫病的方面上奠定理论基础。
