壳寡糖复合固体饮料对Ⅱ型糖尿病小鼠肠道菌群结构的影响
2020-05-08姜雅杰席茂盛罗学刚陈列欢
姜雅杰,王 畅,席茂盛,罗学刚,2,*,陈列欢
(1.天津科技大学生物工程学院,工业发酵微生物教育部重点实验室暨天津市工业微生物重点实验室,天津 300457;2.天津市微生物代谢与发酵过程控制技术工程中心,天津 300457;3.仲恺农业工程学院动物科技学院,广东广州 510225;4.广州优蓝海洋生物科技有限公司,广东广州 510530)
现今,由饮食过剩引起的慢性代谢性疾病如肥胖和糖尿病的发病率已逐渐成为全世界日益引人注目的社会健康问题;据国际糖尿病联合会(IDF)统计,2017年全世界的糖尿病患者人数约为4.25亿人,而中国糖尿病患者人数已达1.14亿,占全球糖尿病患者总数的1/3,而Ⅱ型糖尿病(T2DM)占糖尿病患者总数的90%以上[1-2]。因此,对T2DM预防和有效治疗方法的研究具有重要意义和紧迫性。然而,目前的降糖药物都具有不同程度的毒副作用,因此天然无毒副作用的降血糖产品成为研究热点。
肠道菌群是人体内最大的微生态系统,一般情况下,人体肠道微生物群落的占比和结构多样性都是处于相对平衡的状态,然而,这种平衡在一定条件下会被打破导致宿主疾病[3]。影响肠道微生物菌群的稳态和多样性的因素有很多,比如使用抗生素、饮食习惯、环境等均会对肠道菌群的稳态与多样性产生一定的影响[4]。随着高通量技术的发展,人们对肠道微生态的认识更加的全面,肠道微生态与疾病之间的相互作用也成为研究的热点。T2DM是一种以代谢紊乱为特征的慢性疾病,其发病原因较为复杂,目前认为其发病主要原因是由于胰岛素分泌不足或胰岛素抵抗引起的[5]。不过,也有研究证明,肠道菌群失调也是引起糖尿病的一个重要原因[6]。
壳寡糖(COS)是存在于自然界中的碱性寡糖,它作为一种重要的海洋性功能寡糖,具有降胆固醇[7]、调节免疫[8]等多种特性,同时对肠道菌群有重要的调节作用;β-葡聚糖和水苏糖都是功能性的糖类,具有促进肠道内有益菌的增殖继而提高其所占比例、抑制肠道内有害菌的生长、阻止外源性病原菌在肠道的定植、增加机体肠道免疫力等生理功能[9-10]。白芸豆提取物含有α-AI(天然的α-淀粉酶抑制剂),它可以通过降低淀粉类的消化率来辅助降低Ⅱ型糖尿病病人血糖[11]。亚麻籽油富含α-亚麻酸,α-亚麻酸能有效降低高血脂和高血液粘稠度,改善微循环,有助于糖尿病人的康复。目前市面以壳寡糖为原料并且上市的壳寡糖产品并不多,而以壳寡糖为主要原料并配比白芸豆、水苏糖、β-葡聚糖,亚麻籽油的功能性复合固体饮料还尚未见到。
因此,本文参考中医药讲究的“君臣佐使”理念,以壳寡糖为“君”,白芸豆提取物为“臣”,水苏糖和葡聚糖为“佐”,亚麻籽油为“使”,将其合理科学配伍研发了壳寡糖复合固体饮料“壳糖平”;并利用T2DM小鼠模型,运用高通量测序技术就其对糖尿病小鼠肠道菌群的影响,展开较为系统的分析,为其合理应用及保健食品的开发奠定了基础。
1 材料与方法
1.1 材料与仪器
壳糖平及壳寡糖 广州优蓝海洋生物科技有限公司;昆明小鼠 健康雄性清洁级,4周龄(体重18~22 g),生产许可证:SCXK(军)2007-004,合格证号:00549571;高脂饲料和基础饲料 中国人民解放军军事医学科学院实验动物中心;阿卡波糖片(Acar) 杭州中美华东制药有限公司;AxyPrep DNA提取试剂盒 AXYGEN公司;KOD Polymerase Illumina公司。
702超低温冰箱 美国Thermo Forma公司;YDS-50B-20液氮罐 四川亚西机器有限公司;Quanti FluorTM荧光计 Promega公司。
1.2 实验方法
1.2.1 实验分组和Ⅱ型糖尿病小鼠模型的建立 健康雄性SPF昆明小鼠70只(4周龄,20±2 g),按照体重随机分组分为7组,正常对照组(NFD)、模型组(T2DM)、阳性对照阿卡波糖组(Acar)、壳寡糖组(COS)、壳糖平低剂量组(LKTP)、壳糖平中剂量组(MKTP)、壳糖平高剂量组(HKTP)。实验小鼠以基础饲料适应性喂养一周后,T2DM、Acar、COS、LKTP、MKTP和HKTP组小鼠禁食不禁水12 h,采用65 mg/kg链脲佐菌素(STZ)连续3 d进行腹腔注射,造模期间饲喂高脂饲料。注射药物5 d后,小鼠尾静脉取血,测定小鼠的血糖,空腹血糖水平≥7.0 mmol/L,餐后2 h血糖水平≥11.1 mmol/L为造模成功[12-13]。小鼠从第3周后开始连续灌胃4周实验样品;灌胃定于每天上午9:30开始,其中NFD组、T2DM组小鼠每天PBS(10 mmol/L,pH=7.4)的灌胃量为0.2 mL/只/天,根据小鼠的体重计算Acar组50 mg/kg、COS组80 mg/kg、LKTP组40 mg/kg、MKTP组80 mg/kg、HKTP组120 mg/kg灌胃量,灌胃期间小鼠自由饮食。
1.2.2 小鼠的处理与组织保存 实验结束后,小鼠禁食12 h,采用断颈法处死小鼠,进行解剖摘取小鼠横结肠部分装于离心管中,迅速置于液氮罐中冷却,保存于超低温冰箱(-80 ℃)中备用。
1.2.3 小鼠结肠内容物菌群DNA提取16S和测序 将保存在超低温冰箱中的结肠内容物取出解冻。利用DNA提取试剂盒提取盲肠内容物微生物总DNA。用带有Barcode的特异引物扩增16S rDNA的V3+V4区。引物序列为:341F:CCTACGGGNGGCWGCAG;806R:GGACTACHVGGGTATCTAAT[14]。PCR反应体系50 μL:10×KOD缓冲液5 μL、5 μL(2.5 mmol/L)DNTPS、正反引物(5 μmol/L)各1.5 μL、1 μL KOD聚合酶和100 ng模板DNA,补充ddH2O至50 μL;PCR所需要的反应条件:95 ℃ 2 min;98 ℃ 10 s;退火温度62 ℃ 30 s;68 ℃ 30 s,27个循环;68 ℃延伸10 min。然后进行PCR扩增产物,运用切胶回收试剂盒回收目的片段,并进行定量。将纯化的扩增产物进行等量混合,连接测序接头,构建测序文库,运用Hiseq2500 PE250上机测序。
1.3 数据分析
1.3.1 原始测序数据的处理 采用高通量Illumina Hiseq 2500测序得到原始数据。将测序得到的原始下机数据(Raw data)进行预处理。具体的处理步骤如下:a.使用FASTP(https://github.com/opengene/fastp)将原始数据进行过滤;b.使用FLASH软件包将过滤后数据进行Tags拼接;c.利用QIIME软件将拼接后的Tags过滤,得到高质量干净的Tags;d.将过滤后的Tags在数据库(http://drive5.com/uchime/uchime_download.html)中进行比对搜索,并使用Uchime算法将比对后高质量Tags去嵌合体,获得Effective tags用于进一步分析。最后利用Mothur软件包对Tag序列进行了去冗余处理,从中挑选出Unique tag序列。
1.3.2 OUT聚类 OTU(Operational Taxonomic Units)是指为了方便在系统发生学或群体遗传学研究,人为设定的分类单元。利用Effective tags之间的序列相似性关系,可以将不同的Tags聚类成OTU。为了研究样品的物种的组成多样性信息,用Uparse软件对所有样品的全部Effective tags序列聚类,默认提供以97%的一致性(Identity)将序列聚类成为OTUs(Operational taxonomic units)结果,并计算出每个OTU在各个样品中的Tags绝对丰度和相对信息。根据OTU丰度和序列信息,利用SILVA数据库(https://www.arb-silva.de/)或Greengene数据库的RDP软件包分类器,通过一种简单的贝叶斯模型将代表序列进行微生物分类。用Krona软件包可视化每个分类的丰度统计。用Metastats软件和LEFSe软件进行各组的标志生物筛选。最后利用相关软件,对每组样品逐一开展物种注释、群落多样性、组间差异等多种核心分析。统计分析采SPSS 17.0软件进行,P<0.05为有统计学意义差异。
2 结果与分析
2.1 OTU及多样性分析
由表1可知每个实验组的有效序列为130301~244496条,其长度范围在315~478 bp。本研究中各实验组OTU范围为1367~1835,肠道菌群的物种覆盖率大于0.99,表明本研究测序覆盖率和深度可满足样品16S测序分析需求[15]。由图1A可知,7组小鼠结肠样品的稀释曲线在100000趋向于平坦,说明本研究样品测序数据可靠测序深度满足要求;如图1B Shannon-Wiener曲线趋向平坦,说明测序数据物种丰富度高且分布均匀,其中NFD组样品群落多样性最高,其它依次是COS组、MKTP组、T2DM组、LKTP组、HKTP组、Acar组。表1可知,NFD组ACE指数(2720.99)、Chao1指数(2745.55)、Shannon香农指数(7.31)值都是最高的,说明高脂联合STZ诱导的T2DM小鼠肠道菌群发生了显著变化,使得其肠道菌群的多样性降低,而灌服COS、LKTP和MKTP提高了Shannon香农指数,说明灌服壳寡糖及壳糖平可有效恢复T2DM小鼠肠道菌群多样性。
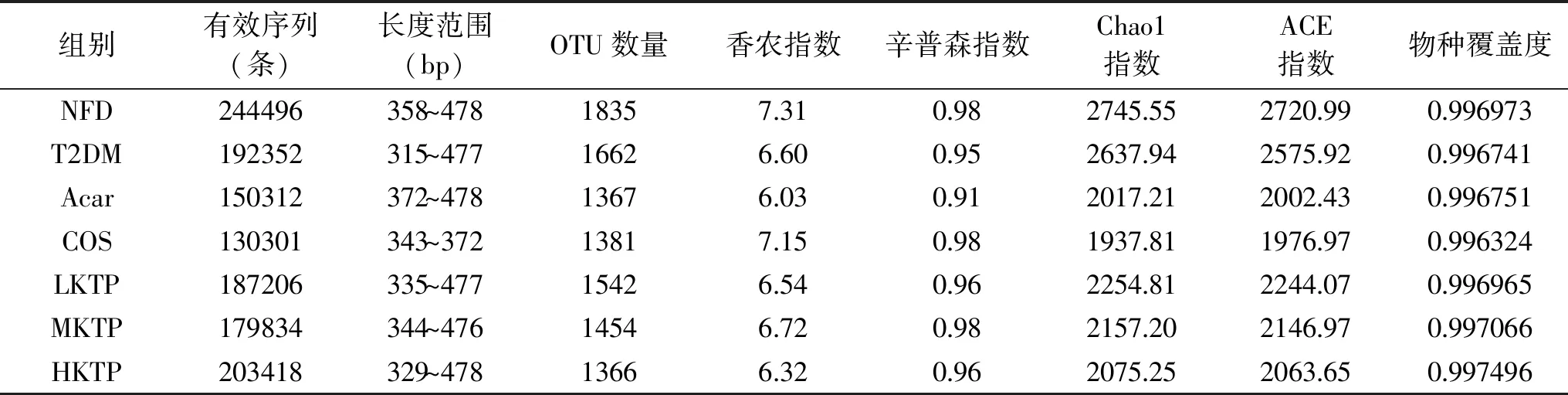
表1 各组样品有OTUs数量和菌群多样性

图1 稀释曲线(A)和Shannon-Wiener曲线(B)分析
2.2 不同分组之间OTU物种差异和PCA分析
如图2所示,根据OTU丰度信息开展韦恩图分析,7组样本含有的特有的OTU个数分别为326(NFD组)、223(T2DM组)、237(Acar组)、118(COS组)、197(LKTP组)、142(MKTP组)、181(HKTP组)。其中有556个OTU是7组共有。基于OUT数据,组间PCoA图表明,小鼠肠道样品情况,其反映在PCoA图中的距离远近上,如图3所示,NFD、T2DM、Acar、COS、LKTP、MKTP和HKTP组内样品距离相近,说明所有实验组组内样品具有良好的平行性和重复性;T2DM组与COS组距离较近,而Acar、LKTP、MKTP和HKTP组与T2DM组距离较远,说明与T2DM组相比,COS组的处理效应弱,Acar、LKTP、MKTP和HKTP组处理效应强。

图2 7组样本OTU水平上的维恩图
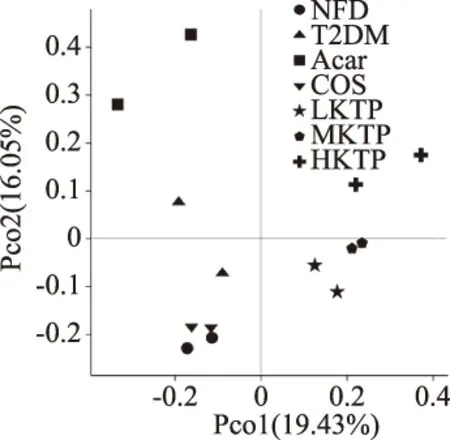
图3 小鼠肠道样本PCoA分析
2.3 在门水平上的菌群丰度及差异
基于OUT数据,将微生物由门到种进行各个水平上的分类,如图4所示,各组小鼠在门(phylum)的水平上的菌群组成主要由厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、变行菌门(Proteobaterria)、酸杆菌门(Actinobateria)、蓝菌门(Cyanobacteria)、Saccharibacteria、疣微菌(Verrucomicrobia)、梭杆菌门(Fusobacteria)、脱铁杆菌门(Deferribacteres)、浮霉菌门(Planctomycetes)等10个菌门组成,其中厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes)为主要优势菌,这与Larsen等[16]研究报道一致。与NFD组厚壁菌门(Firmicutes)相比(38.33%),在T2DM组显著升高(54.57%,P<0.05);而Acar组、COS组、LKTP组、MKTP组、HKTP组与T2DM模型组相比均可显著降低厚壁菌门丰度(P<0.05),其中Acar组占比28.61%、COS组占比30.40%、LKTP组占比20.00%、MKTP组占比20.76%、HKTP组占比23.89%。与NFD组相比(占比为56.31%),拟杆菌门(Bacteroidetes)丰度在T2DM组(P<0.05),其中MKTP组占比最高(75.88%)、其次是LKTP组占比74.27%、HKTP组占比67.64%、COS组占比65.90%、Acar组占比64.48%。研究表明,厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes)协同作用于宿主能量吸收或代谢[17-18];而糖尿病患者肠道与正常人肠道对比拟杆菌门(Bacteroidetes)显著性降低,厚壁菌门(Firmicutes)显著性升高[19-20]。

图4 7组样本在门水平上的相对丰度
由此可知,高脂联合STZ诱导的Ⅱ型糖尿病模型组小鼠厚壁菌门(Firmicutes)升高,拟杆菌门(Bacteroidetes)降低,而灌服壳糖平对Ⅱ型糖尿病小鼠肠道菌群失调具有一定改善调节作用,其中壳糖平中剂量组作用效果最显著。
2.4 在科水平上的菌群组成及差异分析
如图5所示,7组样本在科分类水平上的主要组成菌为:拟杆菌目(Bacteroidales_S24-7_group)、毛螺科菌(Lachnospiraceae)、理研菌科(Rikenellaceae)、普雷沃氏菌(Prevotellaceae)、瘤胃菌科(Ruminococcaceae)、拟杆菌科(Bacteroidaceae)、脱疏弧菌科(Desulfovibrionaceae)、肠杆菌科(Enterobacteriaceae)、乳酸杆菌科(Lactobacillaceae)、紫单胞菌科(Porphyromonadaceae)等10个菌科;其中拟杆菌目(Bacteroidales_S24-7_group)、毛螺科菌(Lachnospiraceae)为两种丰度最大的优势菌,占比超过了57%。与正常对照组(NFD)相比,T2DM模型组拟杆菌目(Bacteroidales_S24-7_group)和普雷沃氏菌(Prevotellaceae)显著下降(P<0.05),而毛螺科菌(Lachnospiraceae)和脱疏弧菌科(Desulfovibrionaceae)显著升高(P<0.05)。与模型组(T2DM)相比,Acar组、COS组、LKTP组、MKTP组、HKTP组拟杆菌目(Bacteroidales_S24-7_group)、普雷沃氏菌(Prevotellaceae)显著升高(P<0.05),而毛螺科菌(Lachnospiraceae)和脱疏弧菌科(Desulfovibrionaceae)显著降低(P<0.05),其中HKTP组Bacteroidales_S24-7_group升高最明显,而Lachnospiraceae降低最明显。如图6,与阳性药组(Acar)相比,通过LEFse分析组间菌群差异,壳糖平中高剂量组拟杆菌群占主导,且所占比例较高;相关研究表明,毛螺科菌(Lachnospiraceae)与肠道炎症程度正相关[21];人类Ⅱ型糖尿病和T2DM模型小鼠的发病可能与Lachnospiraceae相关[22-23]。Desulfovibrionaceae是一种硫酸盐还原菌,能够产生毒素并破坏粘膜屏障与炎症密切相关[24];Prevotellaceae是一种与肠道通透性相关的黏蛋白降解菌[25],在抵御病原菌方面发挥重要作用;肠道中的Bacteroidales_S24-7_group是丁酸盐产生菌,丁酸盐是肠道上皮的能量提供源,并有助于肠道对营养物质的消化吸收,从而提高机体的肠道免疫力[26-31]。

图5 七组样本在科水平上的相对丰度

图6 各实验组的LEFse分析比较
本研究结果表明,灌服壳糖平可以改善T2DM小鼠肠道炎症程度,促进肠道有益菌的生长而抑制致病菌的增殖,从而使得肠道免疫力增强,同时使得宿主整体内环境协调稳定。
3 结论
肠道微生物可以反向调节宿主健康状况,本研究结果表明,与模型组(T2DM)相比,灌服壳糖平可显著增加T2DM小鼠肠道Bacteroidales_、S24-7_group、Prevotellaceae的相对丰度,这些菌可能与改善Ⅱ型糖尿病小鼠症状有关;并且,灌服壳糖平使得T2DM小鼠肠道Firmicutes、Lachnospiraceae和Desulfovibrionaceae的相对丰度减少,这些菌可能与Ⅱ型糖尿病发生有关;这些发现表明适当剂量壳糖平具有调节肠道菌群结构、提高肠道免疫力同时辅助治疗Ⅱ型糖尿病的功效。
