蓝圆鲹分离蛋白水溶性蛋白酶的鉴定及性质
2020-05-08林怡晨刘伟峰孙小舒张凌晶曹敏杰孙乐常
林怡晨,刘伟峰,孙小舒,张凌晶,翁 凌,2,曹敏杰,2,孙乐常,2,3
(1.集美大学食品与生物工程学院,福建 厦门 361021;2.水产品深加工技术国家地方联合工程研究中心,福建 厦门 361021;3.福建省海洋功能食品工程技术研究中心,福建 厦门 361021)
0 引言
蓝圆鲹(Decapterusmaruadsi)隶属鲈形目(Perciformes)、鲹科(Carangidae),属于暖水性中上层鱼类,是我国重要的低值海洋经济鱼类之一。据统计,2017年,全国蓝圆鲹捕捞量总计达53.5万t,其中福建省捕捞量为24.3万t,居全国首位,具有巨大的开发价值[1]。目前,蓝圆鲹主要被加工成鱼干、鱼露或腌制品等低值产品,精深加工程度较低。随着海洋渔业资源的日益缩减,蓝圆鲹逐渐取代传统的鱼糜原料鱼被应用于鱼糜制品的加工。
等电点沉淀法(isoelectric solubilization/precipitation,ISP)是一种利用蛋白质在不同pH值下的溶解度不同的原理,对蛋白质进行溶解、沉淀从而实现蛋白质分离的技术。近年来,有研究者开始尝试利用ISP代替传统鱼糜加工中的漂洗工序制备鱼类肌肉分离蛋白,结果发现,ISP不仅可以分离油脂、色素以及鱼鳞等其他杂质,还可有效回收水溶性蛋白质,从而显著提高蛋白质的回收率,避免优质蛋白质的浪费[2-3]。课题组在前期研究中利用酸/碱ISP法从蓝圆鲹肌肉中制备获得分离蛋白,证实ISP法不仅能极大提高肌肉中蛋白质的回收率,其制备得到的分离蛋白还具有更好的消化性[4]。
进一步的研究发现,蓝圆鲹分离蛋白在加热凝胶化过程中也会出现类似凝胶劣化的现象。前期研究中,通过观察肌球蛋白在ISP法pH值调节过程中的构象变化规律,发现酸法ISP分离蛋白的弱凝胶是由于肌球蛋白变性导致,而碱法ISP制备得到的肌球蛋白能基本保持天然肌球蛋白的构象与凝胶化能力[5]。由此可见,碱法ISP分离蛋白的凝胶劣化极可能是由其内源性蛋白酶的水解作用导致。目前,关于诱导传统鱼糜凝胶劣化内源性蛋白酶的研究在白姑鱼(Pennahiaargentata)[6]、马鲛鱼(Scomberomorusniphonius)[7]、白鲢(Hypophthalmichthysmolitrix)[8]等鱼类已有较多报道。这些结果普遍表明,组织蛋白酶L和肌原纤维结合型的丝氨酸蛋白酶(myofibril-bound serine proteinase,MBSP)是诱导鱼糜凝胶劣化的主要内源性蛋白酶。对于蓝圆鲹,文献[9-10]纯化得到肌肉中的MBSP和组织蛋白酶L,通过对比二者对肌原纤维蛋白的降解情况,发现MBSP具有更高的肌原纤维蛋白水解活性,推测其在传统鱼糜制品的凝胶劣化中起更重要的作用。值得注意的是,ISP法能够同时有效回收肌原纤维蛋白与水溶性蛋白,水溶性蛋白往往含有高活性的水溶性蛋白酶。考虑到ISP法制备分离蛋白过程中pH值的变化也会对内源性蛋白酶的活性产生重要影响,笔者推测,ISP分离蛋白的凝胶劣化机制可能不同于传统的鱼糜制品。然而,目前针对因酶诱导的ISP分离蛋白凝胶劣化作用机理的研究至今还未见报道。本研究以蓝圆鲹肌肉分离蛋白为对象,分析比较不同分离蛋白的自身降解规律,结合特异性荧光底物与肌原纤维酶谱对内源性蛋白酶进行研究,以期为鱼类ISP分离蛋白的凝胶劣化机制研究提供理论基础。
1 材料与方法
1.1 材料与仪器
蓝圆鲹,每尾约150 g,购于厦门市集美菜市场。
绿豆胰蛋白酶抑制剂(mung bean trypsin inhibitor,MBTI)是本实验室分离纯化得到的。SDS-PAGE用标准蛋白购于Thermo Fisher Scientific公司(美国);Boc-Phe-Ser-Arg-MCA等MCA荧光合成底物购于Peptide Institute公司(日本);十二烷基磺酸钠(SDS),乙二醇双(2-氨基乙基醚)四乙酸(EGTA),乙二胺四乙酸(EDTA),Trans-Epoxysuccinyl-L-leucylamido(4-guanidino)butane(E-64),Leupeptin,Bestatin,4-(2-Aminoethyl)-benzolsulfonylfluorid-hydrochloride(AEBSF),Pepstatin,购于Sigma公司(美国);其他试剂均为国产化学分析纯。
PT-2100组织捣碎机(Kinematica公司,瑞士);UB-7型pH计(梅特勒公司,瑞士);Avanti J-25高速冷冻离心机(Beckman 公司,美国);Mini-PROTEAN蛋白质电泳装置(Bio-Rad公司,美国);G:BOX凝胶成像仪(Syngene公司,英国);FR-8200荧光分光光度计(JASCO公司,日本)。
1.2 实验方法
1.2.1 分离蛋白制备
以下操作若无特殊说明,所有操作均在4 ℃下进行。本实验采用酸、碱ISP法制备分离蛋白,并同时以肌肉中全蛋白(total protein,TP)作为对照进行比较。其中,蓝圆鲹肌肉TP是直接采取新鲜蓝圆鲹的骨骼肌,并用绞肉机搅碎,其中的蛋白质即为全蛋白组;蓝圆鲹骨骼肌酸/碱溶解-等电点沉淀的分离蛋白(acid/alkaline aided solubilized-isoelectric solubilization/precipitation,API/KPI)则参考前期研究已报道的方法[4]制备,具体操作过程为:蓝圆鲹肌肉与冰水以1∶8的质量比混合并组织捣碎,分别用1 mol/L HCl或1 mol/L NaOH调节pH值分别为2.0和11.0进行溶解,离心后收集上清液部分,并调节pH值至5.5,经离心后收集沉淀部分蛋白质,加入适量的碳酸氢钠调pH值至中性,即为API与KPI。
1.2.2 分离蛋白自身降解规律研究
在得到的三组蛋白质样品中加入7.5倍体积的缓冲液A(20 mmol/L Tris-HCl,0.5 mol/L NaCl,pH=8.0)组织捣碎,取100 μL分装于1.5 mL的离心管中,在50 ℃分别孵育0,15,30,60,120 min。孵育结束后,立即加入2倍体积的蛋白质溶解液(20 mmol/L Tris-HCl ,pH=8.0,质量分数1% SDS,8 mol/L尿素,质量分数2%β-巯基乙醇),并于95 ℃加热20 min,完全溶解后的样品参照Laemmli等[11]方法进行SDS-PAGE分析。
1.2.3 水溶性蛋白酶的提取
取TP、API和KPI 各100 g,分别加入4倍体积的缓冲液B(20 mmol/L Tris-HCl,pH=8.0)中组织捣碎,捣碎后匀浆,12 000g离心取上清,即为粗酶液,分别命名为WTP、WAPI和WKPI。
1.2.4 酶活力测定
酪蛋白TCA可溶性肽含量测定法[12]:取100 μL适当稀释的酶液加入至900 μL的含质量分数1%酪蛋白的缓冲液B中,40 ℃孵育30 min,立即加入300 μL质量分数30%TCA终止反应,得到的反应液经8 000g离心10 min后收集上清液。通过Lowry法[13]测定上清液的可溶性肽含量,并用酪氨酸为标准。活力单位(U)定义为每分钟释放1 μmol酪氨酸所需要的酶量。
肌原纤维酶谱法[12]:为避免蓝圆鲹肌肉肌原纤维蛋白中结合型丝氨酸蛋白酶(MBSP)[9]对肌原纤维蛋白的降解干扰,本实验以不易发生自身降解的罗非鱼肌原纤维蛋白为底物进行肌原纤维蛋白酶谱检测。具体步骤为:添加罗非鱼肌肉肌原纤维蛋白到SDS-PAGE凝胶中使其终质量浓度为1.0 g/L。将酶与SDS上样缓冲液混匀后,直接上样,并在低温条件下进行电泳。结束后,将胶取出,放入含质量分数2.5% Triton X-100的冰水中振荡孵育以去除SDS使酶复性,随后将凝胶置入缓冲液B中,在37 ℃下孵育24 h,用考马斯亮蓝法进行染色。罗非鱼肌原纤维蛋白参考Rawdkuen等[14]的方法进行制备。
1.2.5 温度和pH值对蛋白酶的影响
1)最适温度:取100 μL适当稀释的酶液加入至900 μL含质量分数1%酪蛋白的缓冲液B中,分别在20~70 ℃下孵育,通过1.2.4方法测定酶活力。
2)最适pH值:取100 μL适当稀释的酶液加入至900 μL含质量分数1%酪蛋白的不同pH值缓冲液中,通过1.2.4方法测定酶活力。其中不同pH值的缓冲溶液分别为:NaCl-HCl缓冲液(pH=2.0),甘氨酸-HCl缓冲液(pH=3.0),乙酸钠缓冲液(pH=4.0~5.0),磷酸缓冲液(pH=6.0~7.0),Tris-HCl(pH=8.0),甘氨酸-NaOH(pH=9.0~10.0),磷酸氢二钠-NaOH(pH=11.0)。
3)pH值稳定性:取20 μL酶液与80 μL 100 mmol/L的不同pH值缓冲液(pH=2.0~11.0)混合,在室温下放置30 min后加入至900 μL含质量分数1%酪蛋白的50 mmol/L Tris-HCl(pH=8.0)缓冲液中,按1.2.4的方法测定酶活力。
1.2.6 蛋白酶对肌原纤维的降解以及蛋白酶抑制剂的影响测定
将蛋白酶与不同类型抑制剂混匀,于冰上放置30 min充分反应后,按照体积比1∶2与含罗非鱼肌原纤维(6 g/L)的缓冲液A混匀,置于50 ℃孵育120 min,随后进行SDS-PAGE分析。所加入抑制剂及其在体系终浓度为: MBTI,0.02 g/L;AEBSF,1 mmol/L;Leupeptin,100 μmol/L;E-64,10 μmol/L;EDTA,10 mmol/L;EGTA,10 mmol/L;Bestatin,10 μmol/L;Pepstain A,1 μmol/L。
1.2.7 荧光底物分析
1)荧光底物特异性分析:参考游银川的方法[15],在900 μL 20 mmol/L Tris-HCl(pH=8.0)中加入50 μL的酶样和50 μL 10 μmol/L的荧光底物,振荡混匀。50 ℃孵育30 min,加入1.5 mL终止液(V(水)∶V(甲醇)∶V(异丙醇)=35∶35∶30)终止反应。采用荧光分光光度计测定反应液在激发波长380 nm和发射波长450 nm的荧光度值,对照组用缓冲液代替荧光底物。酶活力单位(U)定义为每分钟释放1 nmol 7-氨基-4-甲基香豆素(7-amino-4-methylcoumarin,AMC)所需酶量。不同类型荧光底物有:Boc-Phe-Ser-Arg-MCA,Boc-Gln-Arg-Arg-MCA,Boc-Gln-Ala-Arg-MCA,Boc-Ala-Gly-Pro-Arg-MCA,Boc-Arg-Val-Arg-Arg-MCA,Boc-Leu-Gly-Arg-MCA,Boc-Val-Leu-Lys-MCA,Suc-Leu-Leu-Val-Tyr- MCA,Suc-Glu-Pro-MCA,Z-Arg-Arg-MCA,Z-Leu-Arg-MCA,Leu-MCA,Lys-MCA。
2)抑制剂对蛋白酶分解荧光底物的影响:在20 mmol/L Tris-HCl(pH=8.0)的缓冲液中,将蛋白酶与不同的抑制剂相混合,以Boc-Phe-Ser-Arg-MCA作为荧光底物,在50 ℃水浴锅中进行孵育,测定酶活力。
1.3 数据分析
所有的实验均至少重复3次以上,用Microsoft Excel 2013进行数据处理,求平均值、偏差。
2 结果与讨论
2.1 蓝圆鲹分离蛋白的自身降解

将3组蛋白质样品置于50 ℃孵育不同时间观察自身降解情况,结果如图1所示。可见,3组蛋白质均可观察到明显的肌球蛋白与肌动蛋白条带(图1箭头标记)。此外,ISP法制备得到的KPI蛋白条带组成上与TP组相似,这说明碱法ISP能有效回收水溶性蛋白质组分。前期研究[4]发现,通过酸、碱ISP法可以分别回收65.0%与84.6%的肌肉总蛋白,这与图1的结果相一致。随着孵育时间的延长,3组蛋白质发生不同程度的自身降解现象,其中,TP的分解最强烈,反应30 min其MHC条带几乎完全分解。相比于TP组,KPI组的自身降解相对较弱,但明显强于API组。前期研究的流变学结果发现,TP与KPI均能在50~60 ℃升温过程中发生凝胶劣化[4]。本结果进一步证实,此凝胶劣化现象是由于蛋白质发生自身降解导致的。
2.2 水溶性蛋白酶酶活力
为了进一步阐明图1中不同组分离蛋白自身降解速度的差异,对其水溶性蛋白酶的酶活力进行测定,结果如图2a所示。与对照组(WTP)相比,API上清液的蛋白酶相对酶活力(以下简称WAPI)仅为10%,而KPI的上清液(以下简称WKPI)则保留了80%以上的蛋白酶活性。通过肌原纤维酶谱(图2b)可以看出,TP与KPI中主要存在3种能特异性分解肌原纤维蛋白的蛋白酶,其分子质量分别约为120,110与70 ku。相对于TP与KPI,API则没有检测到能降解肌原纤维蛋白的亮带,表明API中相关内源性蛋白酶的活性极低,这与图2a的结果一致。此外,Sun等[12]利用ISP法从太平洋磷虾中制备得到分离蛋白,并在酶谱与酪蛋白水解活力测定中也发现了类似规律。这也暗示了相对于酸性pH值,水溶性蛋白酶在碱性条件下具有更好的稳定性。

2.3 温度和pH值对水溶性蛋白酶活力的影响
以酪蛋白为底物,测定WTP与WKPI中蛋白酶的最适温度、最适pH值与pH值稳定性,结果如图3所示。可见,WTP与WKPI最适温度均为60 ℃,且温度上升至70 ℃时,酶活力快速下降。WTP的pH=9.0与pH=3.0均表现出最高的水解酪蛋白活性,且在pH=5.0处出现一个峰肩,表明TP中存在碱性蛋白酶(如丝氨酸类蛋白酶)、酸性蛋白酶(如组织蛋白酶D)以及组织蛋白酶B/L[9]。此结果与文献[16-18]报道的鲭鱼和虱目鱼的组织蛋白酶D(最适pH=3.0)、鲭鱼的组织蛋白酶B(最适=5.5)、鲢鱼组织蛋白酶L(最适pH=5.0~5.5),以及蓝圆鲹肌肉丝氨酸蛋白酶(最适pH=9.0)[19]等鱼类内源性蛋白酶的最适pH值结果相似。
另一方面,WKPI则仅在pH=9.0具有最高的酪蛋白水解活力。通过对WTP内源酶在不同pH值下的稳定性,可以看出酸性蛋白酶类在碱性pH值范围并不稳定,特别在pH=11.0时,基本丧失全部水解活力。相比之下,WTP中的碱性蛋白酶在碱性pH值下具有良好的稳定性,当pH=11.0时,依然能保留70%的活力,该结果进一步证实了图3b中WKPI的最适pH值结果。

2.4 水溶性蛋白酶对罗非鱼肌原纤维的降解
将WTP和WKPI加入至罗非鱼的肌原纤维中,并加入不同的蛋白酶抑制剂观察降解情况,结果如图4所示。图4的SDS-PAGE结果发现,WKPI的蛋白质条带要明显少于全蛋白,推测在pH值调节过程中,部分肌浆蛋白发生变性进而产生沉淀。
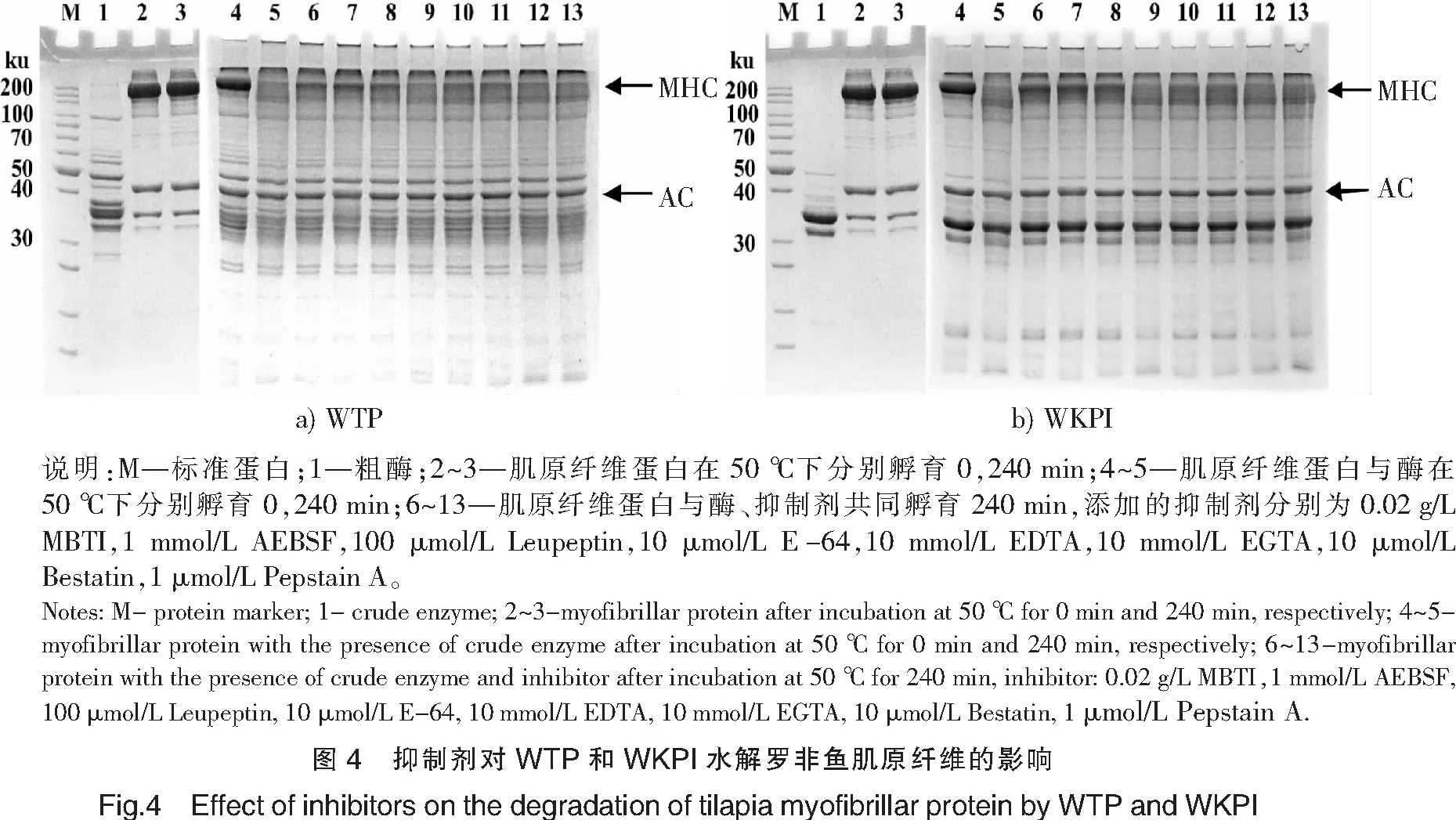
罗非鱼肌原纤维经50 ℃孵育4 h后,空白组没有检测到明显的自身降解,而加入WTP和WKPI的肌原纤维蛋白组可以观察到肌球蛋白重链(MHC)被完全降解。为了更好判断水溶性蛋白酶的类型,孵育过程中加入了不同类型抑制剂,结果发现,所有抑制剂均无法完全抑制蓝圆鲹肌浆蛋白酶降解罗非鱼肌原纤维,说明蓝圆鲹的肌浆蛋白酶包含了多种类型的蛋白酶,这与WTP最适pH值的结果一致(见图3c)。而对于添加WKPI组,抑制剂的抑制作用则相对更为明显,其中丝氨酸蛋白酶抑制剂MBTI、Leupeptin以及Antipain对MHC的降解抑制效果最为显著,而金属蛋白酶抑制剂EDTA、EGTA,半胱氨酸蛋白酶抑制剂E-64,天冬氨酸蛋白酶抑制剂Pepstain A以及氨肽酶抑制剂Bestatin对内源酶的水解具有部分抑制作用。以上结果表明,在pH=8.0条件下,蓝圆鲹肌肉中分解肌原纤维蛋白的主要内源酶为丝氨酸蛋白酶类型。此外,相对于分离蛋白组,肌肉中的内源酶种类更为复杂。
2.5 水溶性蛋白酶对MCA底物水解特性
利用荧光底物对WTP与WKPI中内源酶的种类进行进一步鉴定,结果如表1所示。在反应pH=8.0时,WTP和WKPI对羧基端P1位为Arg残基的多肽具有特异的水解活性,尤其是Boc-Gln-Arg-Arg-MCA,表明在该pH值条件下起主要水解活性的是胰蛋白酶类型的丝氨酸蛋白酶。
以通用荧光底物Boc-Phe-Ser-Arg-MCA为对象,考察不同抑制剂对WTP与WKPI内源性蛋白酶酶活力的影响,结果如表2所示。MBTI、AEBSF和Leupeptin均对蛋白酶活性有显著抑制作用,这也进一步证明了分离蛋白中的内源酶属于胰蛋白酶类型。此外,金属螯合剂EDTA对内源酶具有部分抑制作用,推测可能是由于其活性中心的金属离子被螯合所致。
表1 蓝圆鲹分离蛋白内源性蛋白酶的底物特异性分析Tab.1 Substrates specificity analysis of endogenousproteinases from blue round scads protein isolates底物Substrates(10 μmol/L)相对活性Relative activity/%WTPWKPIBoc-Phe-Ser-Arg-MCA100.0100.0Boc-Gln-Arg-Arg-MCA476.0358.3Boc-Gln-Ala-Arg-MCA187.0216.4Boc-Ala-Gly-Pro-Arg-MCA71.883.8Boc-Leu-Gly-Arg-MCA37.961.1Boc-Val-Leu-Lys-MCA29.730.7Suc-Leu-Leu-Val-Tyr-MCA9.14.5Suc-Glu-Pro-MCA0.70.6Z-Arg-Arg-MCA38.443.2Z-Phe-Arg-MCA23.118.7Leu-MCA8.61.3Lys-MCA7.80.5表2 抑制剂对蓝圆鲹分离蛋白内源性蛋白酶的影响Tab.2 Effect of inhibitors on endogenousproteinases from blue round scads protein isolates抑制剂Inhibitor抑制剂浓度Inhibitorconcentration相对活性Relative activity/%WTPWKPIControl0100.0100.0MBTI0.01 mg/L14.810.3AEBSF1 mmol/L8.17.9Leupeptin0.1 mmol/L9.66.1E-640.01 mmol/L84.6100.0EDTA10 mmol/L35.324.5EGTA10 mmol/L36.624.5Bestatin0.01 mmol/L100.097.4Pepstain A0.001 mmol/L100.092.2
3 结论
本实验以蓝圆鲹为对象,比较分析了肌肉与ISP分离蛋白中水溶性蛋白酶的酶学性质,结果表明,蓝圆鲹肌肉中存在多种水溶性蛋白酶,而经过酸法ISP制备后分离蛋白中的内源酶酶活性基本丧失。相比之下,碱法ISP制备的分离蛋白中则保留较高活力的水解活性,且其主要的内源性蛋白酶为胰蛋白酶类型,提示该酶可能是诱导引起碱法ISP分离蛋白鱼糜凝胶劣化的主要原因。
