肌酐酶在枯草芽孢杆菌中的异源表达及分泌机制
2020-05-08陶政宇付刚闻建平张大伟
陶政宇,付刚,闻建平,张大伟,3
(1天津大学化工学院,系统生物工程教育部重点实验室,天津300072;2中国科学院天津工业生物技术研究所,天津300308;3中国科学院大学,北京100049)
肌酐是人体代谢的产物,可随尿液排出到体外。当肾脏代谢功能紊乱,肌酐会于体内积聚,进而造成慢性肾衰竭[1-2]。对于检测和治疗,目前研究多是从肌酐酶着手,利用肌酐酶联体系进行体内肌酐含量的测定,又或是通过构建低毒菌株来分解体内代谢多余肌酐[3]。肌酐酶的市场需求量大,但由于野生菌株产量低、工业放大困难[4-5],使肌酐酶的生产成本高,同时Tang等[6]虽然实现重组大肠杆菌肌酐酶菌株的构建,但其比酶活力不高,并且纯化蛋白的方法过于复杂而导致胞内蛋白的回收率过低无法进行市场应用。因此构建一株能够胞外生产肌酐酶的重组基因工程菌株,既可方便工业生产和纯化肌酐酶,又可以该菌为基础,进而构建能够帮助治疗肾衰竭患者的无毒或低毒的重组菌株。
枯草芽孢杆菌是常见的蛋白表达宿主菌株,与大肠杆菌相比,其具有优异的胞外分泌能力,可通过Sec、Tat 经典分泌途径、Holin 孔蛋白以及细胞泄漏等方式将细胞内的蛋白分泌到胞外培养基中[7-8]。目前已有很多的研究报道使用枯草芽孢杆菌作为高效生产的工程菌株,Chen等[9]通过启动子筛选成功使α-淀粉酶的表达量提高2倍,Li等[10]通过启动子优化和分子伴侣的应用成功将生长因子FGF21在枯草芽孢杆菌中可溶表达,此外利用细胞泄漏的方式成功在枯草芽孢杆菌中生产尿苷[11]、核黄素[12]。枯草芽孢杆菌是国际公认的安全菌株,在培养过程中,未有内毒素的产生,在很大程度上减轻了工业发酵应用的额外负担。同时,作为常用宿主菌株,枯草芽孢杆菌具有良好的发酵工艺技术,这为目的产物进一步扩大生产提供了基础。本研究成功构建了一株基于泄漏表达的产肌酐酶枯草芽孢杆菌菌株,该菌株即可作为潜在的工业发酵生产应用菌株,又可根据工程菌株自身无毒的特性,进一步构建治疗肾衰竭患者的无毒重组菌株,具有良好的应用潜力和研究价值,同时据本文作者了解这是首次关于肌酐酶在枯草芽孢杆菌表达的研究,为构建枯草芽孢杆菌细胞工厂提供进一步的理论基础。
1 实验材料和方法
1.1 实验材料
1.1.1 实验菌种、质粒和引物
菌种、质粒及构建引物分别列于表1、表2 和表3,引物用Primer5 软件进行设计,送苏州金唯智生物科技有限公司合成,实验中所有菌株均在37℃,220r/min条件下培养。
1.1.2 主要试剂
2×Primer STAR Mix DNA 聚合酶购自Takara 公司;一步克隆试剂盒(ClonExpress®Ⅱ)、2×Taq PCR Master Mix和Marker Ⅲ购自于南京诺唯赞生物科技有限公司;蛋白酶抑制剂Cocktail、麦芽糖、彩虹广谱蛋白Maker、考马斯亮蓝R250 和肌酐均购自北京索莱宝生物科技有限公司;细菌基因组DNA 提取试剂盒、质粒小提试剂盒(DP103-03)购自北京天根生化科技有限公司;柱式PCR 胶回收试剂盒(Gel Extraction Kit,D2500-02) 购自OMEGA公司;其余试剂均为进口或国产分析纯。
1.2 实验方法
1.2.1 重组质粒的构建及验证
以NCBI 中恶臭假单胞杆菌来源的Creatininase(WP_120653449.1)的基因序列为模板,送往金唯智生物科技有限公司进行全基因合成和密码子优化。以合成的Cre 基因序列为模板,利用引物Creatininase-F 和Creatininase-R 对目的基因Cre 进行扩增。扩增后的PCR产物用1%琼脂糖凝胶电泳鉴定,验证后的PCR产物进行胶回收。pMA5表达载体同样使用该手段扩增后利用胶回收试剂盒纯化回收,将目的片段Cre 与载体pMA5 通过一步克隆试剂盒进行拼接,拼接步骤严格按照说明书进行。连接后产物转入E.coli 商业化感受态DH5α 中,用含有100μg/mL氨苄西林(Amp)的LB平板进行阳性克隆筛选,进而完成重组质粒pMA5-CR的构建。同样重组表达质粒pMGC也依据此方法进行构建。
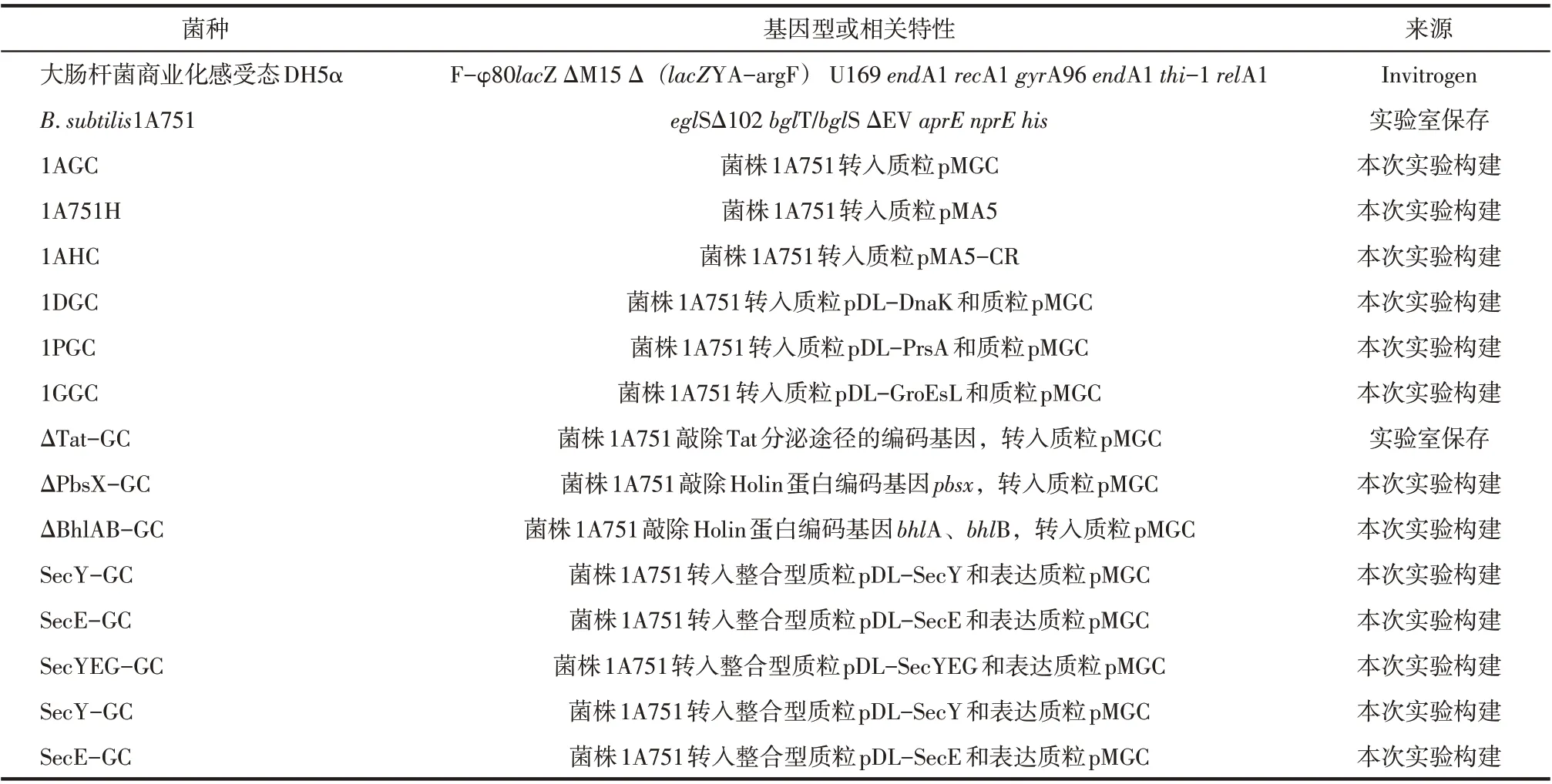
表1 实验菌种

表2 实验中所用质粒
1.2.2 重组表达菌株的构建
将测序结果正确的表达质粒通过Spizizen 盐化学转化法转入表达宿主B.subtilis 1A751中,通过菌落PCR 验证筛选正确的重组菌株,重组菌株1A751H、1AHC和1AGC均按照文献中所述方法进行构建[13]。
1.2.3 基因敲除菌株的构建
通过单敲换手段,将Holin 途径的编码基因pbsx 和bhlAB 用氯霉素抗性基因(Cmrgene)进行代替。以菌株ΔPbsX 为例,构建敲除菌株的步骤如下。
①以实验室保存的Cmrgene为模板,通过引物PbsX-1-F 和PbsX-1-R 进行扩增,通过胶回收试剂盒进行目的产物纯化回收,获得片段1。
②在pbsx 基因上游区段截取约为1500 bp,至pbsx 基因的5’端为止。通过引物PbsX-2-F 和PbsX-2-R 进行扩增,随后利用胶回收试剂盒对PCR产物纯化回收,获得片段2。
③通过引物PbsX-3-F 和PbsX-3-R 对pbsx 基因的下游区段进行扩增,约为1500bp(从3’端开始),利用胶回收试剂盒进行回收,获得片段3。
④通过PCR 扩增,利用引物PbsX-2-F 和引物PbsX-3-R 将片段1、2、3 融合,获得PCR 产物直接转入B.subtilis1A751感受态中,涂布在氯霉素浓度为12.5μg/mL的固体LB平板上,37℃过夜培养。
⑤挑取单菌落,使用引物PbsX-CR-R和CR-F进行菌落PCR 验证,验证正确的菌株,此为基因敲除株ΔPbsX。
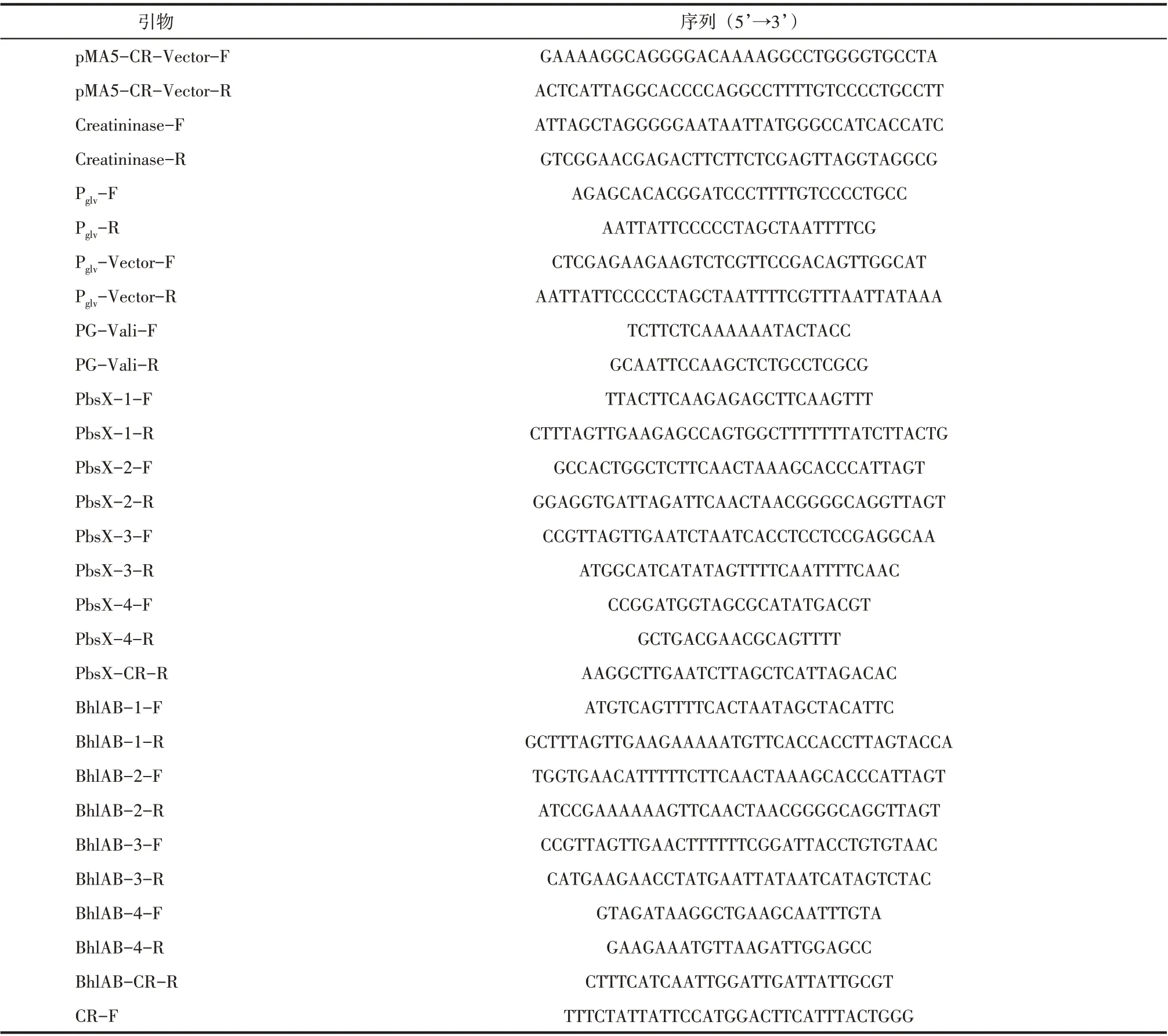
表3 本研究所用引物
另外,通过Spizizen 转化,将表达质粒pMGC转入菌株ΔPbsX,涂布在12.5 μg/mL 氯霉素和50 μg/mL 卡那霉素的固体平板上,过夜培养后进行PCR菌落验证,即可获得过表达肌酐酶的基因敲除重组菌株ΔPbsX-GC。
按上述同样的方法获得ΔBhlAB-GC菌株。
1.2.4 重组蛋白的诱导表达和SDS-PAGE分析
所有转入表达质粒pMGC的重组菌株均在零时诱导,诱导物麦芽糖在摇瓶中的终浓度为质量分数3%。摇瓶培养及SDS-PAGE 蛋白样品制作步骤,根据参考文献进行操作[13]。1.2.5 肌酐酶的酶活测定用联乙酰与α-萘酚反应测定肌酸,依据原理为底物肌酐在肌酐酶作用下水解生成肌酸,碳酸钠溶液终止反应[14]。在弱碱性条件下,α-萘酚被双乙酰氧化为α-萘醌,α-萘醌与肌酸反应生成荧光化合物,可在525nm波长下进行吸光值测定。检测中所用试剂如下:0.3mol/L磷酸钾缓冲溶液,pH 6.5;0.1mol/L肌酐溶液;4%Na2CO3溶液;2%α-萘酚溶液;1.2g NaOH 和3.2g Na2CO3溶于100mL 双蒸水;0.05%二乙酰溶液。用酶稀释液替代酶液,其他步骤相同,所得溶液吸光度为空白吸光度(ΔAb),ΔA= ΔAε- ΔAb。在上述条件下,单位酶活力定义为:每分钟催化生成1μmol肌酸所需的酶量,计算公式见式(1)和式(2)。
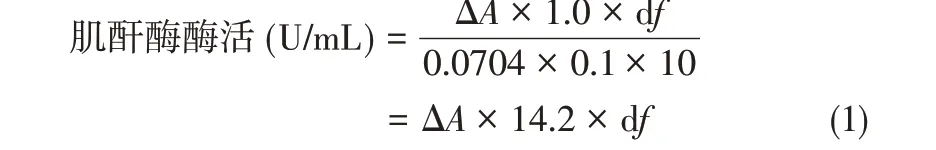
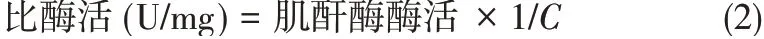
式中,1.0 为反应液总体积,mL;0.1 为酶液体积,mL;10 为反应时间,min;df 为稀释倍数;C 为酶浓度,mg/mL;0.0704 为生色基团在525nm处的摩尔吸光系数,cm2/μmol。
1.2.6 肌酐酶最适反应pH和温度的确定
最适温度的确定:将酶活力测定体系置于不同的反应温度,温度范围30~70℃,其反应体系pH为6.5,比较各温度下的肌酐酶活力,得到最适作用温度。观测肌酐酶的热稳定性,将酶在温度范围从30~70℃的环境下处理15min,在最适温度下进行酶活力测定,残留酶活用于评估温度对肌酸酶稳定性的影响。
最适pH 的确定:分别在pH=3.0~11.0 的范围内,在不同pH 单位的磷酸钾缓冲盐溶液中测定酶活力,以确定最适反应pH。观测酶的pH稳定性是将酶液分别存放在不同pH 的缓冲溶液中,常温保存24h,随后在最适pH 下测定酶活力,确定酶的pH稳定范围。
1.2.7 胞外重组蛋白纯化和Native-PAGE分析
取25mL培养菌液,在4℃、6750g下离心15min,收集离心后的胞外上清液。取1mL Ni-NTA 填料于柱子中,用10 倍柱体积的H2O 和清洗液先后清洗柱子,增强填料的蛋白结合力。随后将胞外上清液装于50mL离心管内,加入填料,冰上结合2~3h。结合后用清洗液除去杂蛋白,最后加入洗脱液(elution buffer)洗脱目的蛋白,纯化结果通过12%SDS-PAGE 鉴定,重组回收后的目的蛋白使用Bardford法[15]测定蛋白浓度。
Native-PAGE 分析可用于鉴定酶的活性功能结构,其凝胶配制成分与SDS-PAGE类似。所用活性2×样品液(sample buffer)组成为62.5mmol/L Tris缓冲液、25%甘油和1%溴酚蓝,所用电泳液(running buffer)由25mmol/L Tris和192mmol/L甘氨酸组成。其电泳条件为冰上处理,电压在100~200V之间。
1.2.8 Calcein-AM/PI染色方法
Calcein-AM 是一种只针对活细胞进行荧光标记的细胞染色试剂,发绿色荧光(Ex=490nm,Em=515nm)。碘化丙啶PI 是死细胞荧光探针,无法穿过活细胞膜,仅可对死细胞着红色荧光(Ex=535nm,Em=617nm)。二者同时对细胞着色可同时进行活死细胞标记,但当细胞即呈现红色荧光,又呈现绿色荧光就表明细胞的细胞膜出现破损[16]。染色步骤如下。
①使用0.01mol/L磷酸缓冲溶液(PBS)配制浓度为20μmol/L Calcein-AM 溶液和45μmol/L PI 染色液,之后各取10μL加入80μL0.01mol/L磷酸缓冲溶液配制为100μL工作液。
②随后用0.01mol/L 磷酸缓冲溶液对细胞进行稀释使其密度为1×105~1×106细胞/mL,取出200μL细胞悬液加入100μL 染色液,混匀,37℃孵育15min。
③在荧光显微镜下进行观察,将观察的图像进行重合得到实验结果。
2 实验结果与讨论
2.1 肌酐酶在枯草芽孢杆菌中的异源表达及酶学性质分析
2.1.1 启动子优化及重组蛋白的诱导表达结果分析启动子强度的不同,可以影响目的基因的转录程度,进而影响外源蛋白在宿主菌株中的表达水平。为得到肌酐酶在枯草芽孢杆菌中合适的转录水平,通过组内已有的蛋白研究,选用麦芽糖诱导型启动子Pglv来代替pMA5的组成型启动子PHpaⅡ
[17],从而构建了麦芽糖诱导型表达质粒pMGC。同时依靠组成型启动子PhpaⅡ的重组肌酐酶表达质粒pMA5-CR也进行构建。质粒pMA5-CR和pMGC的验证结果见图1,约在1200bp 和1500bp 处有明亮单一的条带,与软件预测的理论条带大小一致。将验证正确的菌液接种于试管中培养12~14h,提取质粒,送往金唯智生物科技有限公司进行测序,测序结果用SnapGene 软件进行分析比对,进而获得带有肌酐酶目的基因的重组表达质粒pMA5-CR和pMGC。
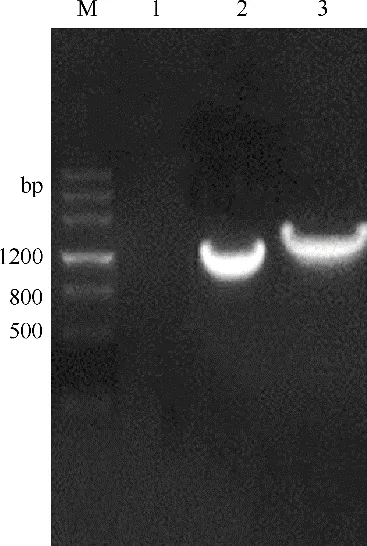
图1 重组质粒pMA5-CR和pMGC的菌落验证
将质粒pMA5-CR、pMGC 和pMA5 转入B.subtilis 1A751进而构建表达菌株1AHC、1AGC和对照菌株1A751H,摇瓶培养后的SDS-PAGE 分析结果见图2。通过SnapGene软件分析预测肌酐酶的理论蛋白分子量为30000,图2 中,可明显观测到菌株1AGC 与1AHC 在30000 处存在条带,与理论预测的蛋白分子量大小一致,同时可明显观察到麦芽糖诱导型菌株1AGC的表达量明显高于组成型启动子表达菌株1AHC。此外,从图2(a)的摇瓶培养结果可分析出在24h时肌酐酶主要以胞内可溶的形式存在逐步积累在细胞内部。而从图2(b)的结果来看,随培养时间增加到48h时,胞外肌酐酶的蛋白量逐渐增加,胞内可溶组分减少,这表明肌酐酶在枯草芽孢杆菌中不依赖于信号肽即可分泌到胞外培养基中。在通过启动子优化提高蛋白表达量的同时,出现少量错误折叠的蛋白即包涵体,很大程度是由于部分蛋白折叠中间体错误聚集形成的,在后续的实验中可以考虑调节启动子强度、降低培养温度等手段进行调节。
2.1.2 胞外肌酐酶的酶学性质分析
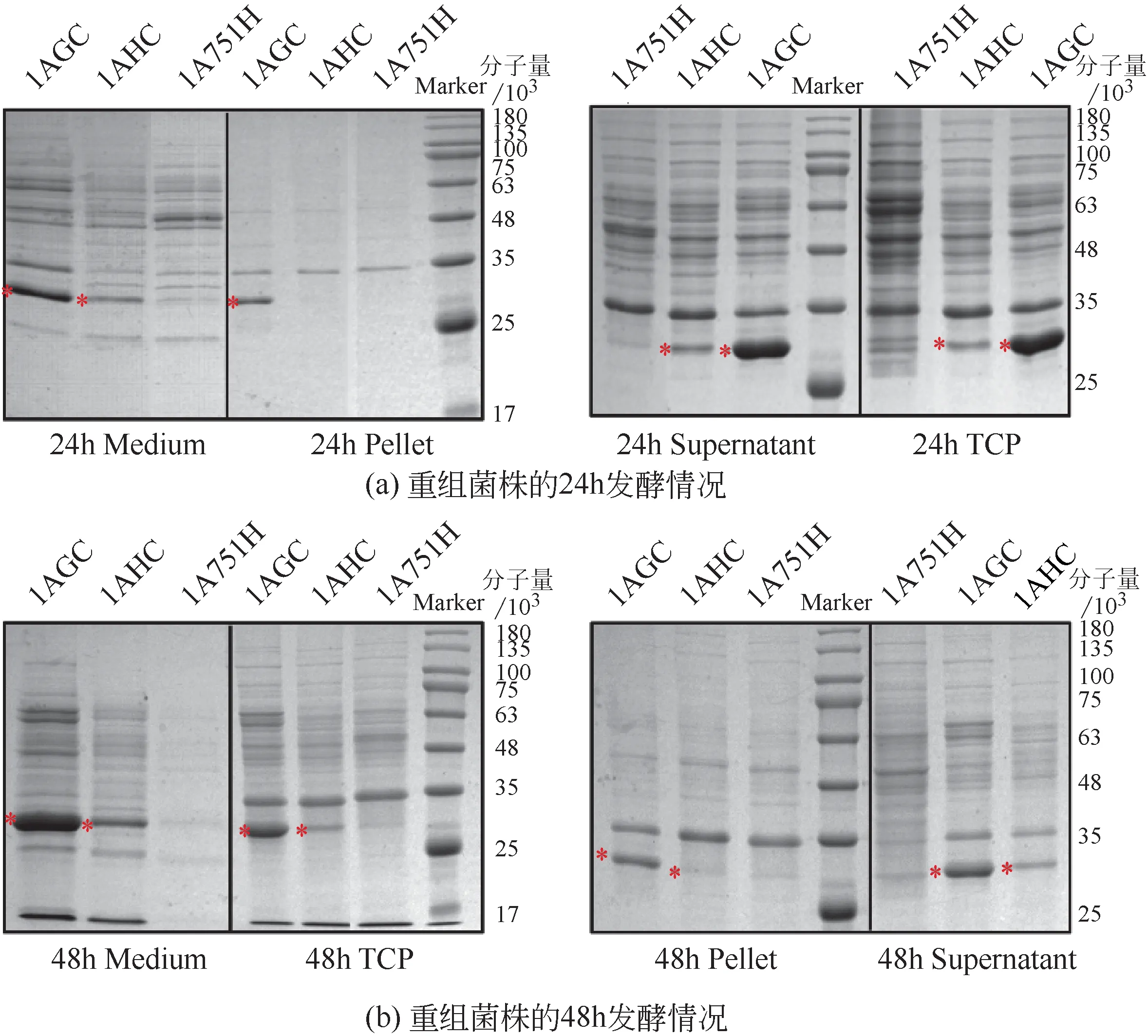
图2 重组菌株SDS-PAGE分析
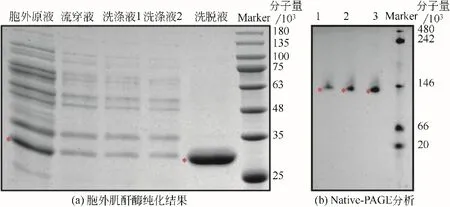
图3 胞外肌酐酶的纯化结果分析和Native-PAGE活性功能结构分析

图4 肌酐酶的最适反应条件和稳定性研究
将肌酐酶重组菌株1AGC的胞外肌酐酶进行纯化分析,所得纯化结果见图3(a),图中洗脱下的目的蛋白浓度为1.08mg/mL,并测得酶活力为257.04U/mL,比酶活为238U/mg。图3(b)为Native-PAGE分析结果,表明胞外肌酐酶的活性功能结构为多聚体,根据理论单体蛋白分子量为30000,进一步推测其为同源四聚体。同时根据图4(a)可得出肌酐酶的最适反应pH和温度分别为8.0和55℃,从图4(b)的折线图可分析出肌酐酶在50℃以下可较好维持活性结构,在pH=6.0~8.0 间维持其功能结构的稳定。图5 表明在最适反应温度和pH 下,通过双倒数作图法测得肌酐酶酶促动力学参数Km为99.38mmol/L,最大反应速 率Vmax为5.9×10-2mmol/(L∙s)。进而求得每秒钟每个酶分子催化的底物分子数Kcat为655.6s-1,同时求得特异性常数Kcat/Km为6.597L/(s∙mmol)。使用Brenda获取来源于恶臭假单胞杆菌的肌酐酶的酶促动力学参数Km范围在26~350mmol/L,而酶的催化效率Kcat/Km的数值范围在0.008~17.4L/(s∙mmol),通过比较分析得出,在枯草芽孢杆菌中表达的重组肌酐酶的底物亲和性中等,催化效率较好。将所有数据酶参数综合分析可得出,该重组肌酐酶具有一定的市场应用潜力。
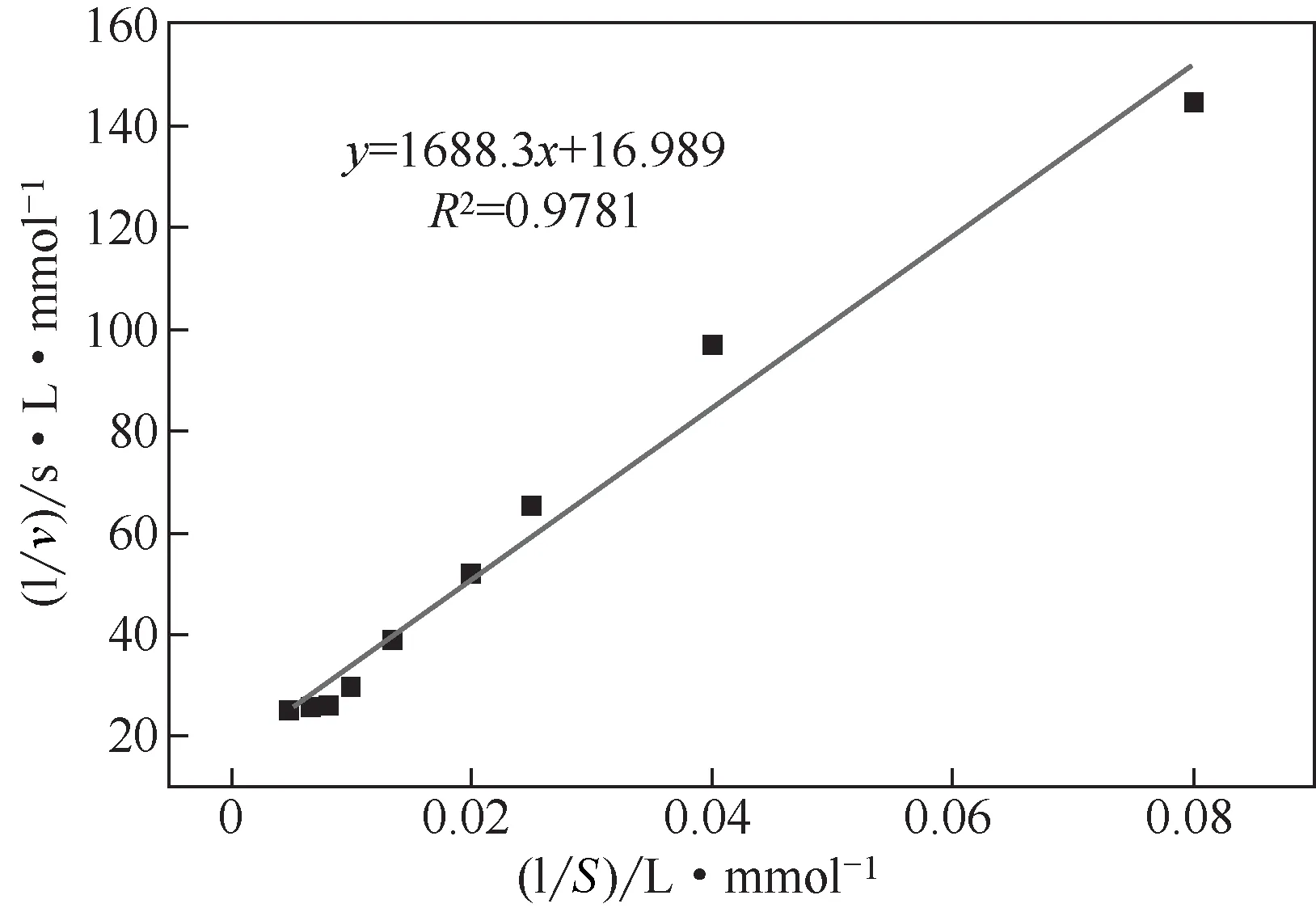
图5 肌酐酶的双倒数曲线
2.1.3 分子伴侣过表达菌株的SDS-PAGE分析
利用pDL整合型质粒,将分子伴侣基因danK、groESL 和prsA 整合到枯草芽孢杆菌1A751 的基因组上,从而完成基因danK、groESL 和prsA 的过表达。分子伴侣的过表达可以进一步的帮助胞内蛋白的可溶性表达[18],因此构建分子伴侣与肌酐酶共表达菌株1DGC、1GGC 和1PGC,将菌株进行培养与SDS-PAGE 分析,结果见图6。以1AGC 菌株结果作为正对照,从胞外和可溶组分来看:枯草芽孢杆菌常用分子伴侣DnaK、GroESL和PrsA的过表达并未能有效提高肌酐酶的胞内可溶产量,其蛋白表达量与对照菌株基本一致。枯草芽孢杆菌中常用的分子伴侣应用无效很有可能是单一过表达的局限性造成的,因此后续研究中可利用多分子伴侣共表达体系来帮助肌酐酶的折叠和表达量的提升。此外,分子伴侣强度的调控同样可能是影响因素,适中的分子伴侣表达强度可以更好地来帮助肌酐酶的正确折叠,从而完成蛋白表达量的提高。

图6 分子伴侣重组菌株的SDS-PAGE分析
2.2 肌酐酶在枯草芽孢杆菌中分泌机制的初步探究
2.2.1 经典分泌途径和Holin 蛋白通道的分析与排除
对于肌酐酶在枯草芽孢杆菌中可不依赖于信号肽即可完成胞外分泌的现象,本文作者课题组对其分泌机制进行了初步探究。通常在枯草芽孢杆菌中,大部分的细胞质蛋白主要通过Sec途径从胞内分泌到胞外培养基中,而小部分蛋白则从Tat 途径分泌到细胞外。为分析肌酐酶的分泌是否与这两个途径相关,分别通过过表达Sec 途径的关键元件SecY、SecE、SecYEG 和敲除Tat 途径的编码基因tatAyCy、tatAdCd 和tatAc 来进行验证,使用实验室保存菌种转入质粒pMGC完成菌株构建,进而培养评价分析,24h 和48h 的SDS-PAGE 结果见图7。菌株1AGC作为对照菌株,从胞内外的目的蛋白的表达量来看,SecY-GC、SecE-GC、SecYEG-GC 以及ΔTat-GC与对照菌株并无差别,这表明肌酐酶在枯草芽孢杆菌中的分泌可能不依赖于Sec 和Tat 分泌途径。

图7 经典分泌途径重组菌株的SDS-PAGE分析
Holin 蛋白途径是一种不依赖于信号肽即可将蛋白释放到胞外的方式,其主要作用的元件是PbsX 和BhlAB,因此通过单交换手段将氯霉素抗性基因替换这两个关键元件,构建突变菌株ΔPbsX和ΔBhlAB,随后转入诱导型表达质粒pMGC,进行培养评价,SDS-PAGE 结果见图8。从图中观察可知,与作为对照菌株的1AGC 相比,Holin 关键元件敲除后的突变菌株所产肌酐酶的胞外分泌量并未受到影响,基本与对照菌株的胞外分泌量一致,这表明肌酐酶的胞外分泌并不通过Holin蛋白途径,对此,可初步猜测肌酐酶主要通过细胞泄漏的方式从细胞质内释放到胞外培养基中。
2.2.2 表达菌株1AGC细胞膜完整性鉴定
若一株菌株出现细胞泄漏现象,其细胞膜必定出现破损。通过Calcein-AM/PI 双染色试剂盒对表达菌株1AGC 和对照菌株1A751H 进行着色来鉴定菌株细胞膜的完整性,染色结果见图9。以菌株1A751H作为对照菌株,从图中可观察到,1A751H的双染色结果经过图像重叠后,红绿荧光分明,并未观察到荧光重叠菌株。而在表达菌株1AGC 中,红绿荧光图像经重叠后可明显观察到黄色菌株的存在,这表明表达菌株的细胞膜出现破损,为细胞泄漏猜想提供了充分的证据。
2.2.3 扫描和透射电子显微镜观察

图9 菌株1A751H和1AGC的染色结果
为进一步地证实肌酐酶主要通过细胞泄漏的方式释放到胞外,采用透射电子显微镜(TEM)和扫描电子显微镜(SEM)对肌酐酶表达菌株进行观察,观察结果见图10。图10(a)为TEM 观察结果,图中可明显看到细胞膜和细胞壁完整的菌株呈现一种凝视饱满的状态,表现为灰黑色。而当细胞膜和细胞壁出现破损后,细胞质内物质流出,使细菌呈现一种空洞的状态,表现为白色。从图10(a)可清晰地看到对照菌株1A751H其大部分菌株的细胞膜和壁完整,基本不存在泄漏型的空白菌株;而表达菌株1AGC的群体细胞图中,可明显观察到存在大量的泄漏型菌株,约占总体的50%。此外,图10(b)的SEM 观察结果也可观测到潜在的泄漏位点的存在,菌株表面的凹陷处即为泄漏孔洞的形成处,已用白色箭头指出。因此,综合经典分泌途径与Holin蛋白通道的分析结果、细胞膜染色结果和电镜观察结果,可得出肌酐酶在枯草芽孢杆菌中的分泌主要是通过细胞泄漏的方式完成的。对于此种分泌方式,作者推测是由于高强度启动子的作用使得肌酐酶大量表达进而形成一种表达压力,加速细胞泄漏或裂解进程,从而使胞内蛋白泄漏出去。而根据图2可知,在表达初期肌酐酶主要是以可溶状态积聚在细胞质内,随着培养时间的增长,胞内蛋白积累量过大形成压力进而加速细胞裂解,使细胞膜出现泄漏孔洞,胞内蛋白质逐渐从泄漏位点逐渐流出。

图10 肌酐酶表达菌株的电子显微镜观察结果
3 结论
本文主要对枯草芽孢杆菌进行了启动子优化,核心蛋白元件的过表达及敲除,Calcein-AM/PI 双染色以及电子显微镜观察,构建了肌酐酶高效表达分泌菌株并解析了肌酐酶在枯草芽孢杆菌中的分泌机制。具体结论如下。
(1)通过对肌酐酶基因的密码子优化,成功构建肌酐酶表达菌株1AHC,实现肌酐酶在枯草芽孢杆菌中的异源表达。
(2)对启动子进行优化,将质粒pMA5上的组成型启动子PHpaⅡ更换为麦芽糖诱导型启动子Pglv,成功构建肌酐酶高产菌株1AGC,使肌酐酶的蛋白表达量有了显著提高,并且胞外肌酐酶的酶活可达257.04U/mL,比酶活为238U/mg,此外通过Native-PAGE 分析出胞外肌酐酶的活性功能结构为多聚体,并用双倒数作图法求得肌酐酶的Km、Vmax、Kcat和Kcat/Km,综合分析后确定该重组酶具有一定的市场应用价值。
(3)研究了不依赖于信号肽的肌酐酶在枯草芽孢杆菌中的分泌机制。通过过表达Sec途径的核心蛋白元件SecY、SecE 和SecYEG,敲除Tat 途径的关键蛋白编码基因tatAyCy、tatAdCd 和tatAc 以及Holin 蛋白通道的关键元件编码基因pbsx 和bhlAB,结果表明肌酐酶在枯草芽孢杆菌中的分泌不依赖于以上途径。并用荧光染料Calcein-AM/PI 验证表达菌株1AGC 的细胞膜存在不同程度的破损。最后,使用透射电镜和扫描电镜对细菌形态进行观察,确定肌酐酶在枯草芽孢杆菌中通过细胞泄漏完成胞外分泌。
(4)相比于传统肌酐酶的宿主菌株E.coli,本文所构建的肌酐酶表达菌株更有助于工业生产提纯和医疗应用,并且可尝试通过扩大培养来进一步提高肌酐酶的表达产量;又或以菌株1AGC为基础进而加入肌酸水解酶,从而构建对人体无毒害作用的尿毒症医疗应用菌株。
