超声波辅助提取杏鲍菇黄酮研究
2020-05-08李建凤黄茜廖立敏
李建凤,黄茜,廖立敏,*
(1.果类废弃物资源化四川省高等学校重点实验室,四川内江641100;2.内江师范学院化学化工学院,四川内江641100)
杏鲍菇又名刺芹侧耳,隶属于担子菌亚门,层菌纲,无隔担子菌亚纲,伞菌目,侧耳科,侧耳属[1-2]。杏鲍菇富含蛋白质、碳水化合物、维生素及钙、镁、铜、锌等多种营养成分,此外还含有多糖、多肽、酚类、黄酮类化合物等多种活性物质,具有抗癌、降血脂、促进肠胃消化、防止心血管病等多种功效[3-4],目前报道对杏鲍菇的研究侧重在产品加工方面,杏鲍菇提取方面的研究尤其是黄酮化合物提取的研究还未引起足够的重视[5-6],由此开展超声波辅助提取杏鲍菇中的黄酮研究。黄酮类化合物是广泛存在于自然界的一大类化合物[7-9],到目前为止,已经发现有5 000 多种植物中含有黄酮类和异黄酮类化合物,黄酮类化合物能够抗心律失常和改善冠脉循环,黄酮类化合物也具有抗癌、防癌的作用。黄酮类化合物还能够促进胰岛B 细胞的恢复,降低血糖和血清胆固醇,改善糖耐量,调节对抗肾上腺素的升血糖作用[10-11]。但黄酮类化合物在人体不能直接合成,只能从食品中获得,由此,黄酮的提取在现实中有重要的作用。目前,植物中黄酮提取方法有多种,用超声波辅助提取黄酮类物质,是目前比较新的方法。其原理主要是利用超声波在液体中的空化作用加速植物有效成份的浸出提取。另外,还利用其次效应,如机械振动、扩散、击碎等,使其加速被提取成份的扩散[12],利用超声波辅助提取杏鲍菇中黄酮的方法可以用于现实生活。
1 材料与方法
1.1 材料、试剂与仪器
杏鲍菇:内江市北京华联超市;无水乙醇:成都金山化学试剂有限公司;去离子水(优质超纯水机):四川优普超纯科技有限公司;氢氧化钠、三氯化铝、亚硝酸钠(均为分析纯):成都金山化学试剂有限公司。
电子分析天平(JA2003A):上海精天电子仪器有限公司;紫外可见分光光度计(UV-mini-1240):岛津制作所;手提式高速粉碎机(DFT-100):温岭市林大机械有限公司;电热恒温鼓风干燥箱(DHG-9245A)、高功率数控超声波清洗器(KQ-400KDB):上海一恒科学仪器有限公司;低速大容器离心机(DTL-5-A):上海安亭科技仪器有限公司;优质超纯水机(UPT-Ⅱ-10T):成都超纯科技有限公司。
1.2 试验方法
1.2.1 杏鲍菇的预处理
将市售的新鲜杏鲍菇清洗干净,手撕成小片,用干燥箱在60 ℃下干燥到恒重,将杏鲍菇放入高速粉碎机中粉碎3 min,制得杏鲍菇干粉,用塑料密封袋装好,放入装有干燥剂的罐子中备用。
1.2.2 芦丁标准曲线的绘制
标准溶液的配制:用分析天平精确称取芦丁标准品0.020 0 g,使用60%的乙醇溶液进行溶解,完全溶解后转移至50 mL 容量瓶中,用60%乙醇进行定容,即得到质量浓度为400 μg/mL 芦丁标准溶液。
测定波长的选择:精确量取芦丁对照液1.0 mL 于25 mL 比色管中,加入5%亚硝酸钠1.0 mL,混匀,静置6 min,再向其中加入10%硝酸铝1.0 mL,混匀,静置6 min,最后向其加入4%氢氧化钠10.0 mL,用60%乙醇稀释至刻度线,混匀,静置15 min,等待显色,用比色皿在300 nm~900 nm 测定显色剂的吸收光谱,得到最大吸收波长为510 nm。
标准曲线的绘制:分别的精密的吸取上述的芦丁试剂 0.0、1.0、2.0、3.0、4.0、5.0 mL 到 25 mL 的比色管中,配置成 0.00、16.00、32.00、48.00、64.00 μg/mL 标准系列。以芦丁空白试剂作参比,用1 cm 比色皿在波长为510 nm 处分别测定它的吸光度,然后以吸光度A作为它的横坐标,并以芦丁标准溶液浓度C(单位μg/mL)作为它的横坐标[13],然后用最小二乘法作线性回归,则计算的芦丁标准曲线的回归方程为C=0.010 07A+0.001 1,R2=0.999 7。
1.2.3 杏鲍菇黄酮的提取及测定
称取1.000 0 g 杏鲍菇粉末于100 mL 干燥锥形瓶,加入一定量一定体积分数的乙醇溶液,用保鲜膜封住,在一定功率超声波中提取一定的时间,温度控制在60 ℃,将提取液转移至离心管,在4 000 r/min 离心10 min,对沉淀及提取液进行分离,将所得的提取液转移至50 mL 容量瓶中,用水定容至,摇匀,用吸量管移取1.0 mL 于25 mL 比色管中,按照芦丁标准曲线测定方法测定。
1.2.4 杏鲍菇黄酮提取率计算公式
当比色管中的提取液显色完全以后,以空白试剂蒸馏水为参比,测定其吸光度,通过所得的芦丁标准曲线回归方程C=0.010 07A+0.001 1 和式(1)计算提取率。

式中:X 为杏鲍菇总黄酮得率,%;C 为杏鲍菇总黄酮的质量浓度,μg/mL;N 为体积,mL;V 为稀释倍数;m 为称取杏鲍菇粉末质量,g。
1.2.5 单因素试验设计
固定超声温度为60 ℃的情况下,共考察分析了液料比、乙醇浓度、超声功率、超声时间4 个单因素对杏鲍菇黄酮提取率的影响。以液料比30 mL/g、乙醇浓度70%、超声功率240 W、超声时间30 min 为基础,固定3 个条件,改变1 个条件,研究其对杏鲍菇黄酮提取率的影响。
1.2.6 正交试验设计
通过对单因素试验的数据的分析,选择液料比、乙醇浓度、超声功率、超声时间4 项条件为提取因素,用来研究对杏鲍菇中黄酮含量的影响,各因素水平见表1。
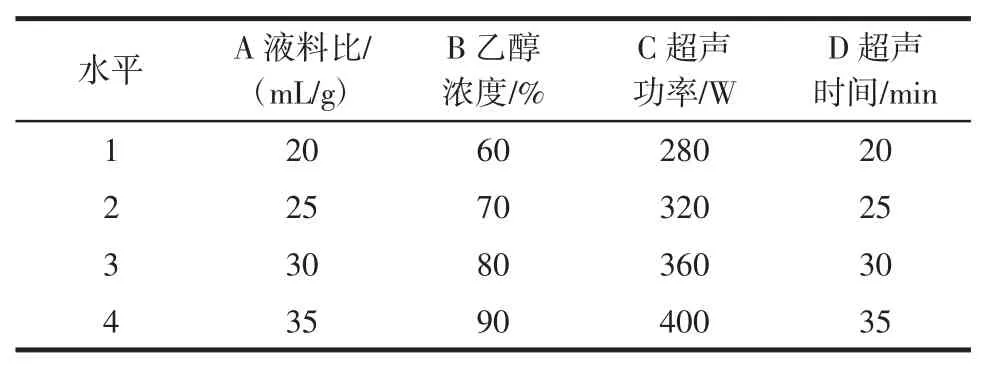
表1 正交试验因素水平Table 1 Factors and levels orthogonal design
2 结果与讨论
2.1 单因素试验
不同液料比对杏鲍菇黄酮提取率的影响如图1。

图1 液料比对提取的影响Fig.1 Effect of liquid-material ratio on extraction
溶剂量较小时,杏鲍菇粉末表面与少量溶剂产生浓度差,有一定的提取率。随着溶剂量的增加,原料表面与溶剂的浓度差也相对增大,进而黄酮的提取率不断提高,当液料比到达30 mL/g 时,杏鲍菇黄酮的提取率到达最大值。在此溶剂量之后,提取率又出现下降趋势,可能是原料与溶剂边界层黄酮因浓度差而生的扩散推动力更大[14],产生更多的杂质,此时溶液的渗透压对黄酮提取成负影响,因此选择30 mL/g 为最佳液料比。不同乙醇浓度对杏鲍菇黄酮提取率的影响如图2。
乙醇浓度较小时,杏鲍菇中黄酮提取的强度不够,得到较小的提取率,随着乙醇浓度的增加,杏鲍菇粉末中黄酮的提取率不断增加,当乙醇浓度到达70%时,杏鲍菇黄酮的提取率到达最大值。在乙醇浓度超过70%以后,黄酮的提取率出现逐渐降低的趋势,分析其原因,黄酮是一种有一定极性的物质,增加乙醇浓度时,乙醇水溶剂极性减弱,按照相似相溶原理,70 %乙醇的与黄酮能更好地相容[15],当乙醇浓度大于70 %时,乙醇水溶剂易溶出其他醇溶性物质,影响提取,因此乙醇浓度选择70%为最佳。不同超声功率对杏鲍菇黄酮提取率的影响如图3。
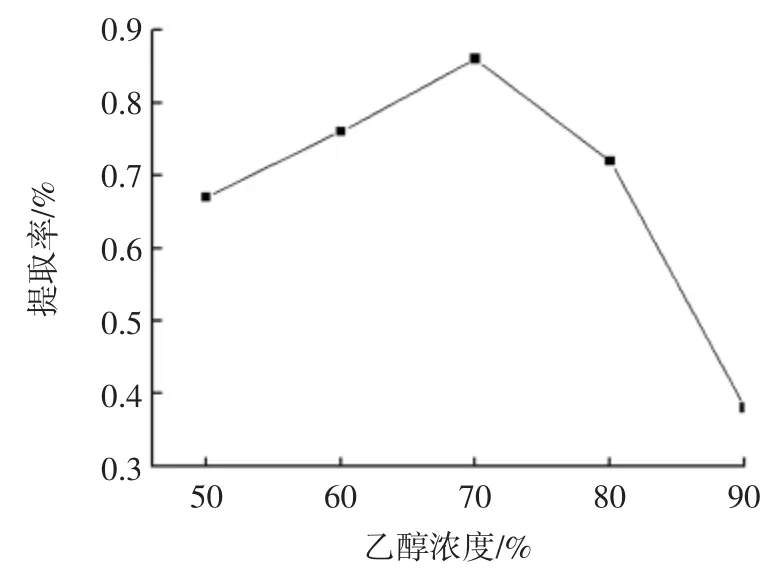
图2 乙醇浓度对提取的影响Fig.2 Effect of ethanol volume fraction on extraction

图3 超声功率对提取的影响Fig.3 Effect of ultrasonic power on the extraction
由于超声波辐射压强主要会对原料产生空化作用,当超声功率强度较小时,对杏鲍菇细胞壁的破碎作用不够,黄酮没有完全溶出,提取率相对较小。随着超声功率的增加,提取率不断上升,当超声功率到达360 W 时,杏鲍菇黄酮的提取率到达最大值。超声功率过强,超声波可能会降解杏鲍菇中的有效成分,并且此时溶剂温度上升较快,高温受热使黄酮损失同时温度升高使乙醇挥发[16],考虑多种原因的影响,选择最佳超声功率为360 W。不同超声时间对杏鲍菇黄酮提取率的影响如图4。
超声时间不够时,杏鲍菇中黄酮没有完全溶出,但随着超声时间的增加,杏鲍菇粉末中黄酮的提取率不断增多,当超声时间到达30 min 时,杏鲍菇黄酮的提取率接近最大值。综合考虑,随着超声时间继续增长,杏鲍菇黄酮结构容易被破坏,进而失去活性,影响提取,并影响最终浓度的测定[17],而且超声处理时间增多,超声产生的噪音增加,还浪费提取时间,因此提取时间选择30 min 时最佳。
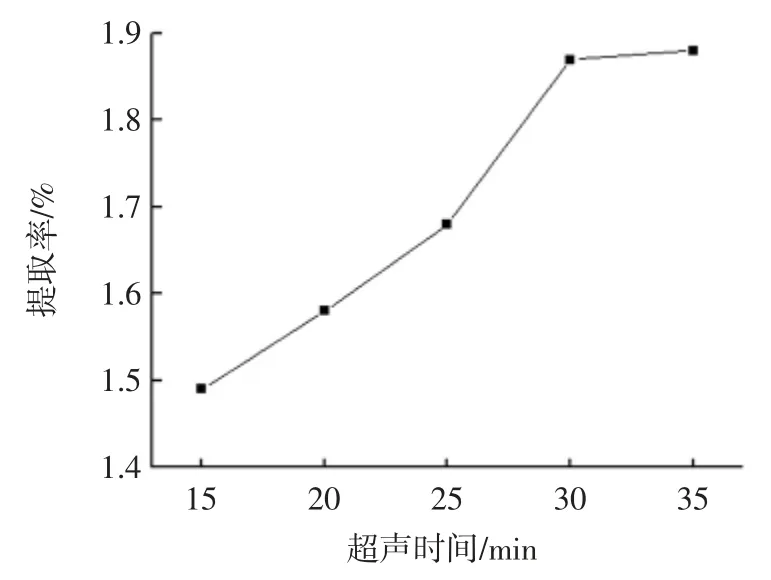
图4 超声时间对提取的影响Fig.4 Effect of extraction time on extraction
2.2 正交设计试验及结果分析
2.2.1 试验安排及结果
选用L1(644)正交表安排试验,得到不同水平下黄酮的提取率,分析黄酮提取的最佳工艺,各个因素对黄酮提取率的强弱影响,以及模型预测的提取率数值。试验安排及结果见表2。
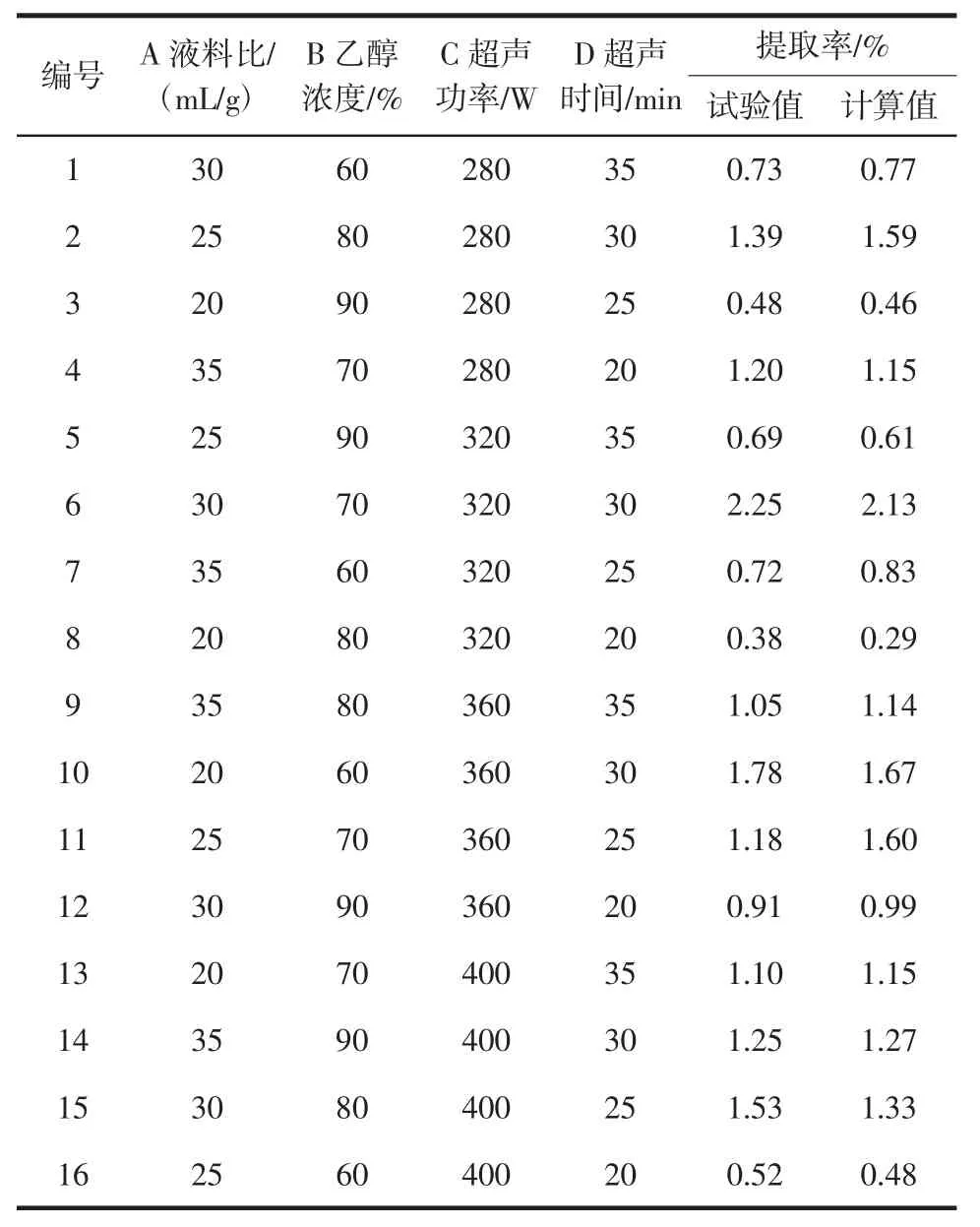
表2 L16(44)正交试验安排及结果Table 2 L16(44)orthogonal experimental design and results
2.2.2 极差及方差分析
将表2 中数据进行极差分析,结果见表3。
由表3 可知,极差 D>B>A>C,提取率受到各因素交叉影响的同时,也有着因素影响的强弱顺序,超声时间对黄酮提取率影响最为显著,其次是乙醇浓度,再者是液料比、超声功率。由表3 得出,不同水平情况中,料液比 k3> k4> k2>k1,选择 A3为最佳水平,乙醇浓度 k2> k3> k1>k4,选择 B2为最佳水平,超声功率 k3> k4>k2>k1,选择 C3为最佳水平,超声处理时间 k3> k2> k4>k1,选择D3为最佳水平,可得到最佳水平组合为:液料比为30 mL/g,乙醇浓度为70%,超声功率为360 W,超声时间为30 min。将表2 中数据进行方差分析,结果见表4。
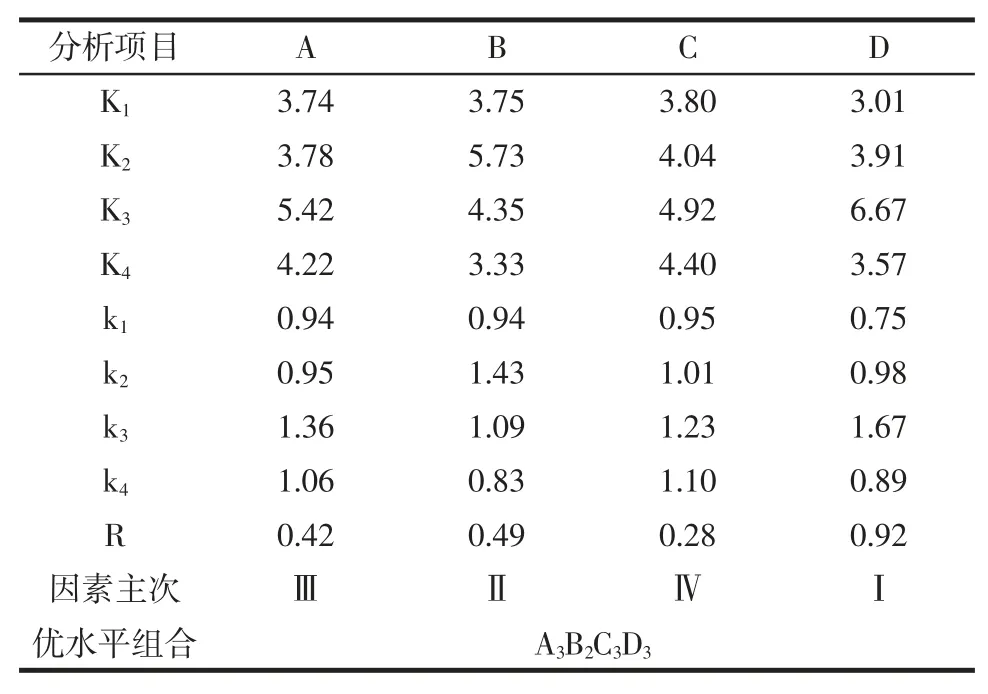
表3 正交试验结果极差分析Table 3 Orthogonal experiment result range analysis
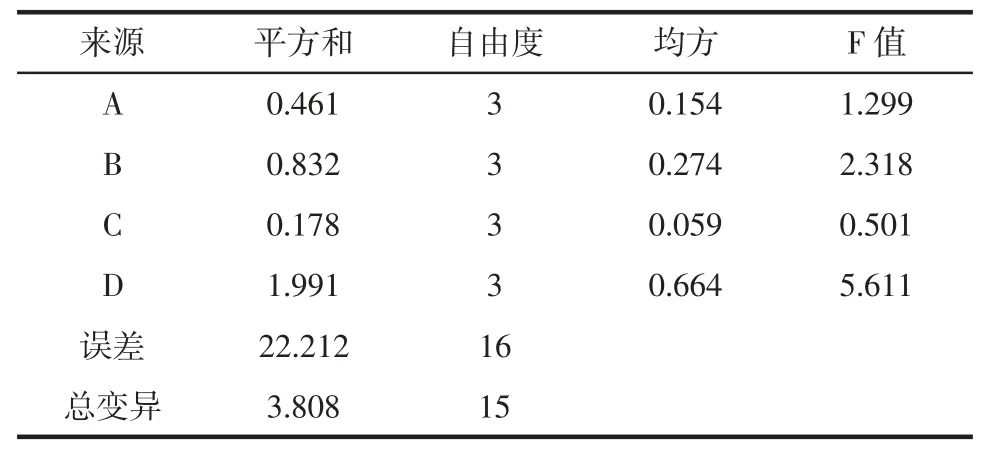
表4 正交试验结果方差分析Table 4 Variance analysis of the orthogonal experience results
由表4 得出,D 的F 值最大,对杏鲍菇黄酮提取率影响最大;B 的F 值排第二,说明其对杏鲍菇黄酮提取率影响排第二;A 的F 值排第三、C 的F 值最小。以上说明影响次序依次为D>B>A>C,方差分析所得出的因素影响强弱与极差分析所得出的结论相同,可双重验证超声时间对黄酮提取率的影响明显[18]。
2.2.3 数据建模分析
按照下列二次多项式模型将液料比、乙醇浓度、超声功率、超声时间,以及各因素的交叉乘积等影响因素作为自变量,黄酮提取率作为因变量,用普通多项式回归方法,对试验数据进行拟合。
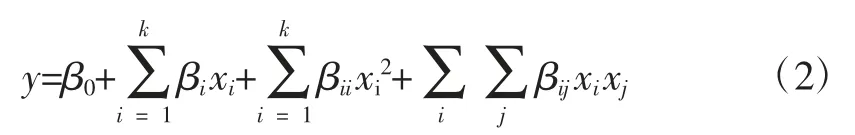
式中:y 作为因变量是黄酮提取率;β0、βi、βii、βij是影响因素的系数;xi、xj作为各个影响因素是自变量。方程(2)即为描述因变量(黄酮提取率)y 与自变量(液料比、乙醇浓度、超声功率、超声时间一次方、二次方及其相互作用)的经验模型[19]。对式(2)进行分析,可以预测正交试验的不同水平条件下杏鲍菇黄酮的提取率。
利用统计学软件SPSS 13.0[20]对试验结果进行普通回归分析,得杏鲍菇黄酮提取率的二次拟合模型回归方程为:

式中:y 为黄酮提取率;x1、x2、x3、x4分别为液料比、乙醇浓度、超声功率和超声时间。该模型的复相关系数R 为0.934,标准误差SD 为0.299,数据说明数学模型拟合程度较好。通过计算得知试验拟合误差小,并且数学模型具有较高的稳定性,预测能力较强,可以利用此模型对杏鲍菇粉末中黄酮提取率进行分析和预测,模型[式(3)]对各提取条件下黄酮提取率的计算值见表2。为便于观察,将计算值与试验值相关图绘于图5,模型值误差(Err)分布图绘于图6。
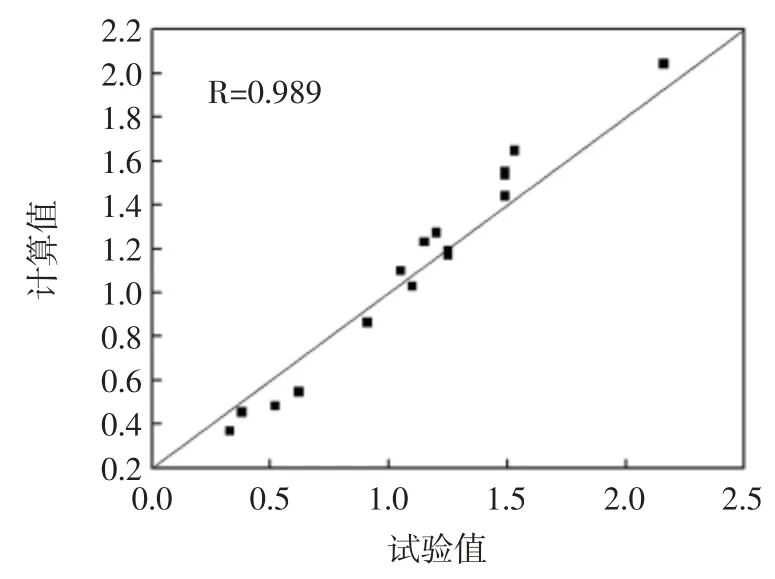
图5 模型值与预测值相关图Fig.5 Plot of Cal.values and experimental values
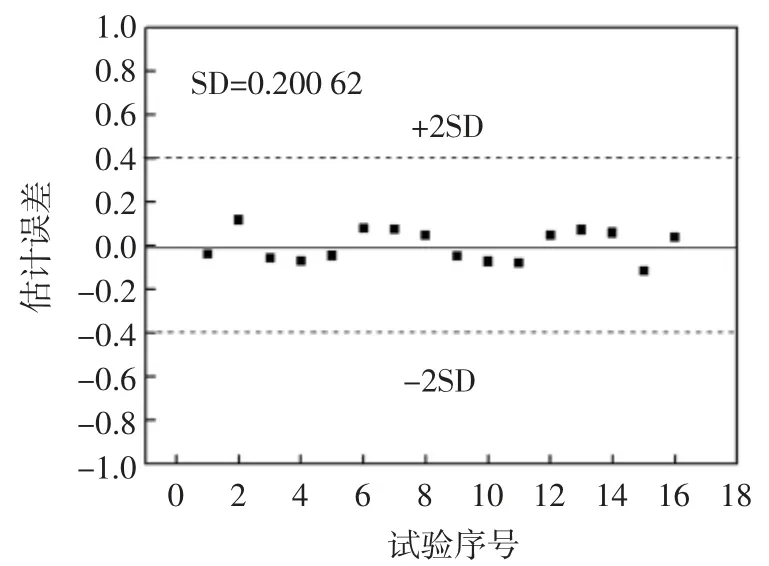
图6 模型值残差分布图Fig.6 Residuals scattered between the Exp.and Cal.of model
图5 显示,全部模型计算值与正交得出的试验值十分相近,同样图6 显示所有样本的误差都分布在零附近,处于2 倍SD 以内。说明杏鲍菇黄酮提取率的模型预测值与试验值十分接近,误差较小,此模型对黄酮提取率估计的准确性较高,可以利用该模型对杏鲍菇黄酮提取进行分析并为试验提供参考。利用上述模型对上述初步确定的提取条件下的黄酮提取率进行了预测,结果为2.23%,接近表2 中提取率最大值,说明正交试验分析得出的最佳提取条件是基本正确的。
2.3 最优条件的确定
正交试验及模型分析,得出乙醇溶液为溶剂,超声波辅助提取杏鲍菇黄酮的最合理提取工艺:液料比为30 mL/g、乙醇浓度为70%、超声功率为360 W、超声时间为30 min。为验证提取工艺是否正确,在此试验条件下做平行试验3 次,得到杏鲍菇黄酮的提取率分别为2.28%、2.32%、2.38%,平均值为2.33%,试验数据稳定,重现性较好,具有一定的现实意义,黄酮的收率高,再次说明正交试验得出的黄酮提取工艺是可取的。
3 结论
采用超声波辅助提取杏鲍菇中的黄酮,分析液料比、乙醇浓度、超声功率和超声时间4 个单因素对黄酮提取率影响。通过正交设计试验得到了超声波辅助提取杏鲍菇黄酮的合理工艺为液料比30 mL/g、乙醇浓度70%、超声功率360W、超声时间30 min。在最佳提取下,得到的黄酮的最高得率为2.33%,工艺稳定可行,具有一定的参考价值。
