功能化磁性吸附材料制备及其在食品重金属检测中的应用
2020-05-08瞿静毕晓彤张爱琳王丽刘翠翠
瞿静,毕晓彤,张爱琳,王丽,刘翠翠
(天津农学院食品科学与生物工程学院,天津300384)
近年来,随着工农业迅猛发展,人类赖以生存的环境遭到了破坏,重金属污染所带来的危害越来越得到重视。研究显示,重金属主要经食物链进入人体并蓄积,通过破坏蛋白质活性、毒害细胞来影响人体正常新陈代谢[1-2]。比如Cu 的过量摄入会导致主动脉和大血管弹性蛋白含量降低,从而易于发生动脉瘤和血管破裂[2];再如,Se 摄入过多则会增加贫血的风险,并损害肝脏[3-5]。
目前,基于重金属的检测方法主要有原子吸收光谱法、电感耦合等离子体原子发射光谱法、电感耦合等离子体质谱法等仪器分析方法[3,6-8]。由于重金属在食品中的残留水平较低,样品分析前往往需要分离富集处理。巯基作为路易斯碱对多种重金属有较强的亲和作用,经常作为功能基团修饰于碳纳米管、硅胶、有机聚合物及矾土等表面用于污水及食品中重金属的富集[9]。L-半胱氨酸属于巯基化合物的一种,且同时含有氨基和羧基反应活性基团,利于化学修饰,是用于重金属分离富集材料修饰的理想功能配体。比如Liu等[2]以L-半胱氨酸为功能单体,硅球为载体,制备L-半胱氨酸功能化重金属吸附材料,该材料对多种重金属具有很好的吸附效果。遗憾的是,通过传统硅胶材料分离富集重金属往往需要离心、过滤甚至液固萃取等步骤,操作冗繁,且不利于吸附材料再生及循环使用。本研究以Fe3O4作为载体,L-半胱氨酸(含巯基)作为功能单体,设计合成L-半胱氨酸功能化Fe3O4磁性复合材料,构建固相萃取-石墨炉原子吸收光谱法,为食品中重金属残留提供新颖、高效、便捷、灵敏的检测手段。
1 材料与方法
1.1 仪器与试剂
1.1.1 仪器
石墨炉原子吸收光谱仪(AA-6880):日本岛津公司;超声波清洗器(KQ3200E):昆山舒美超声仪器有限公司;加热磁力搅拌器(EMS-9B):上海隆拓仪器设备有限公司;箱式电阻炉(SX2-4-10):上海右一仪器有限公司;恒温培养摇床(THZ-300):上海沪粤明科学仪器有限公司;电热鼓风干燥箱(DHG-9030A):上海精宏实验设备有限公司;透射电子显微镜(JEM-2100):日本电子株式会社;X 射线光电子能谱仪(PHI1500-VersProbe):日本 Ulvac-Phi 公司。
1.1.2 材料与试剂
大米、虾仁:市购;乙二醇、聚乙二醇-600、六水合三氯化铁、乙酸钠(分析纯),硅酸四乙酯、(3-氨丙基)三甲氧基硅烷、二甲基甲酰胺、L-半胱氨酸、二环己基碳二亚胺、无水乙醇、异丙醇、氨水(以上全部为分析纯):上海麦克林生化科技有限公司;Cd2+/Cu2+标准储备液(1.000 0 mg/mL,光谱纯):上海阿拉丁生化科技股份有限公司。
1.2 样品预处理及标准溶液配制
1.2.1 样品处理
采用微波消解法对标准物质虾仁、大米样品进行消化。将样品粉碎处理,分别准确称取0.5 g 放入消解内管底部,加入5 mL 浓硝酸,将盖子旋紧后再反向旋转30°,放入微波消解仪中,消解样品经赶酸处理后溶于10 mL 超纯水,并调pH 6.5,备用。微波消解升温程序如表1 所示。

表1 微波消解升温程序Table 1 Microwave digestion temperature program
1.2.2 Cd2+/Cu2+标准工作液制备
分别移取Cd2+/Cu2+标准储备液(1.000 0 mg/mL)1.000、0.750、0.625、0.500、0.250、0.125、0.050、0 mL 于25 mL 容量瓶,超纯水定容,得到浓度为 400、300、250、200、100、50、20、0 μg/L 的标准溶液,0.1 mol/L 硝酸或氨水调节pH 6.5,于冰箱中4 ℃保存。
1.3 试验方法
1.3.1 L-半胱氨酸功能化磁性Fe3O4微球的制备
1.3.1.1 磁性Fe3O4材料的制备
本研究采用水热合成法制备Fe3O4磁性微球[10],具体操作步骤如下:取 2.7 g FeCl3·6H2O 及 80 mL 乙二醇于100 mL 圆底烧瓶中,室温(25 ℃)磁力搅拌得到均一溶液;依次加入7.2 g 乙酸钠及2.0 mL 聚乙二醇-600,混合液继续搅拌30 min 后,转移至100 mL 聚四氟乙烯高温反应釜,并置于预先加热到210 ℃的马弗炉中反应10 h,待反应完毕后关闭马弗炉电源,冷却到室温(25 ℃)。黑色产物由铷铁矿收集,并以无水乙醇清洗至少3 次,45 ℃烘干备用。
1.3.1.2 氨基化磁性Fe3O4微球的制备
称取100.0 mg 上述Fe3O4磁性微球超声分散于72 mL 异丙醇中,依次缓慢逐滴加入5.0 mL 蒸馏水、0.3 mL 氨水,超声15 min 后,继续依次逐滴加入1.0 mL正硅酸乙酯及0.5 mL(3-氨丙基)三甲氧基硅烷;混合溶液在25 ℃,1 500 r/min 的磁力搅拌条件下反应6 h,产物由铷铁矿收集,由无水乙醇反复超声清洗3 次,45 ℃烘干备用。
1.3.1.3 L-半胱氨酸功能化磁性Fe3O4微球的制备
称取100 mg 上述氨基化Fe3O4磁性微球及142 mg L-半胱氨酸加入到20 mL 无水二甲基甲酰胺中,接着加入290 mg 二环己基碳二亚胺,混合物于室温(25 ℃)1 500 r/min 磁力搅拌24 h。产物由铷铁矿收集,由无水乙醇反复超声清洗3 次,45 ℃烘干备用。
1.3.2 重金属吸附与脱附
量取 20 mL Cd2+/Cu2+标准溶液(20 μg/L~400 μg/L)置于50 mL 圆底烧瓶中,用0.1 mol/L 硝酸溶液或者氨水调节pH 3.5~7。然后,将10 mg 所制备的吸附材料加入到上述溶液中,室温(25 ℃)下于摇床140 r/min 进行吸附过程。5 min~40 min 后,利用外加磁场收集吸附材料,上清通过石墨炉原子吸收光谱法(graphite furnace atomic absorption spectrometry,GFAAS)测定。为了将材料负载的Cd2+及Cu2+洗脱下来,选用2 mL 0.5 mol/L HNO3作为洗脱剂,洗脱方式为超声洗脱3 min。利用外加磁场收集吸附材料,并通过GFAAS 对洗脱液中的Cd2+及Cu2+进行定量。石墨炉温度程序见表2。

表2 石墨炉温度程序(高密石墨管)Table 2 Graphite furnace temperature program(high-density graphite tube)

续表2 石墨炉温度程序(高密石墨管)Continue table 2 Graphite furnace temperature program(highdensity graphite tube)
2 结果与分析
2.1 材料表征
通过透射电镜(transmission electron microscopy,TEM)对所制备材料形貌结构进行表征,结果如图1所示。

图1 透射电镜图Fig.1 Transmission electron microscopy images
Fe3O4磁性材料呈现规则的球形,直径大概300 nm。氨基化Fe3O4呈现典型的“核-壳”结构,硅胶层厚度约30 nm。为了证明L-半胱氨酸功能化成功,通过X-射线光电子能谱(X-ray photoelectron spectroscopy,XPS)对材料进行分析,结果显示S 元素负载比率达到8.2%(原子百分比)。
2.2 吸附选择性试验
本试验分别考察了L-半胱氨酸功能化磁性材料对 100 mg/L 的不同重金属离子(包括 Cu2+、Pb2+、Mn2+、Cd2+、Cr6+及 V5+)的吸附效果。结果显示,L-半胱氨酸功能化磁性材料对Cd2+和Cu2+的吸附效果比较好,能达到 95%以上,而对 Pb2+、Mn2+、Cr2+及 V2+的吸附效果较差,说明该材料对重金属Cd2+和Cu2+有一定的选择性。
2.3 吸附溶液pH 值优化
吸附溶液pH 值通常决定着吸附剂表面的带电情况以及重金属的存在形式,因此pH 值对吸附效率有着重要影响[11]。本研究考察了不同吸附液pH 值对Cd2+和Cu2+吸附效果的影响,结果如图2 所示。

图2 吸附溶液pH 值对去除效率的影响Fig.2 Effect of pH value on the the adsorption efficiencies of target ions
随着pH 值由3.5 逐渐增大,目标离子吸附效率随之升高,pH 6.5 时,吸附效率达到最大。进一步增加pH值,吸附效率反而下降。因此选择pH6.5 作为吸附溶液最佳pH 值。
2.4 吸附时间优化
吸附时间对吸附效率的影响如图3 所示。

图3 吸附时间对吸附效率的影响Fig.3 Effect of contact time on the adsorption amount of target ions
随着时间延长,吸附效率逐渐提高;30 min 时,吸附效率达到最大,并趋于平衡。原因可能是在吸附初始阶段,吸附剂表面含有大量的目标离子识别位点,随着吸附过程的进行,识别位点逐渐减少,与溶液中未吸附的金属离子间达到平衡[12]。
2.5 吸附等温试验研究
饱和吸附量是评价吸附材料吸附性能的重要参数,因为它直接关系着材料得应用性能。本试验考察了10 mg 材料对不同初始浓度的目标离子的吸附量,结果如图4 所示。
如图4a 所示,当Cd2+和Cu2+标准溶液初始浓度较低时,吸附材料识别位点是相对过量的,Cd2+和Cu2+几乎被完全吸附,随着Cd2+和Cu2+初始浓度增加,目标离子相对于吸附材料过量,吸附量趋于稳定,Cd2+和Cu2+的最大饱和吸附量分别为238.1、227.3 mg/g。
Langmuir 和Freundlich 等温吸附模型被用于探讨吸附机理,方程表述分别如下:

图4 吸附等温试验研究图Fig.4 Study on adsorption isotherm experiment
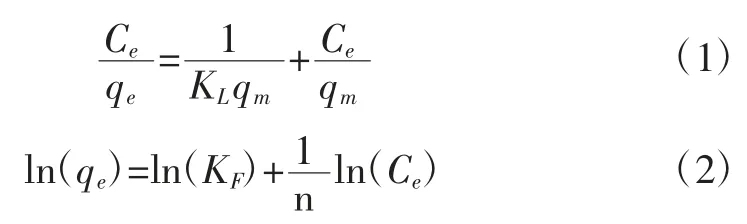
式中:qe为吸附容量,mg/g;Ce为平衡浓度,mg/L;qm为最大吸附容量,mg/g;KL为 Langmuir 模型常数,L/mg;KF和 n 为 Freundlich 模型参数。
图4b 是以Ce为横坐标,以Ce/qe为纵坐标的Langmuir 模型对磁性材料等温吸附Cd2+和Cu2+的线性方程拟合。图4c 是以LnCe为横坐标,以Lnqe为纵坐标得到的Freundlich 模型对磁性材料等温吸附Cd2+和Cu2+的线性方程拟合。Langmuir 与Freundlich 等温吸附模型参数列于表3。
结果显示,Cd2+和Cu2+的吸附过程符合Langmuir模型,拟合的相关性系数R2大于0.99,说明半胱氨酸功能化磁性材料对Cd2+和Cu2+的吸附属于单层吸附。
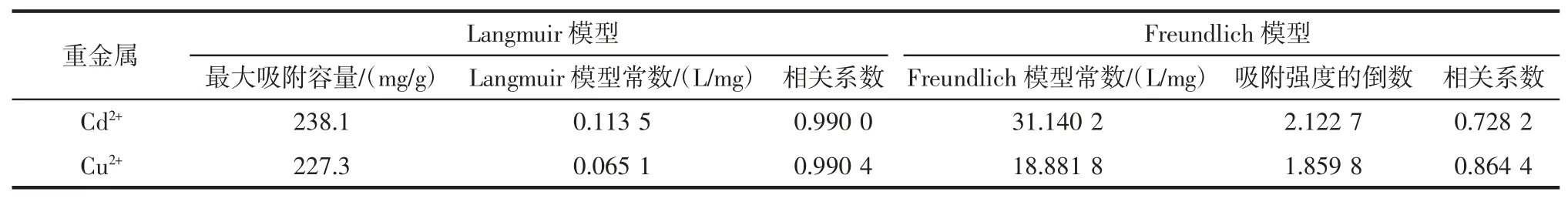
表3 Langmuir,Freundlich 的吸附等温线参数Table 3 Isotherm model parameters for adsorption of Cd2+and Cu2+by Cys-Si-MNPs
2.6 方法构建
配制浓度为 0.1、0.2、0.5、1、2、5、10 μg/L 的 Cd2+和Cu2+标准工作液。通过合成材料进行吸附,用硝酸溶液洗脱后,由GFAAS 测定,得到浓度与响应值之间的标准工作曲线。Cd2+和 Cu2+元素的线性范围均为:0.2 μg/L~5.0 μg/L,相关系数 R2>0.997 0。将空白溶液平行测定11 次,按照3 倍标准偏差除以标准曲线斜率计算得到的 Cd2+和 Cu2+的检出限分别为 0.12、0.13 μg/L。
方法的精密度是通过对1.0 μg/L Cd2+和Cu2+标准溶液连续平行测定11 次,按照相对标准偏差进行计算,得到Cd2+和Cu2+精密度分别为4.0%及3.8%,证明本方法有较好的重复性和稳定性。
2.7 食品样品分析
为了考察本方法的实用性,选取大米和虾作为食品样品基质进行添加回收试验。取样品5g,添加100μL Cd2+和 Cu2+标准溶液(50、100、200 μg/L),混匀,按照1.2.1 方法进行微波消解处理。消化液经材料吸附、洗脱后采用GFAAS 对样品中Cd2+和Cu2+进行检测,结果如表4 所示。

表4 食品样品中Cd2+和Cu2+的测定结果Table 4 The determination results of Cd2+and Cu2+in foods of rice and shrimp
从表4 中可以看出目标金属离子的回收率在87.0%~94.0%之间,相对标准偏差小于6.0%(n=3)。
3 结论
本研究成功合成了L-半胱氨酸功能化磁性材料,透射电镜表征结果显示该材料呈现规则的“核-壳”结构,并对Cd2+和Cu2+表现出选择性吸附效果。以该材料作为吸附剂,系统优化了吸附条件,并构建了基于GFAAS 的 Cd2+和 Cu2+检测方法,Cd2+和 Cu2+的检出限分别为0.12、0.13 μg/L。最后,选择大米、虾仁作为实际样品对该方法实用性进行验证,目标金属离子的回收率大于87.0%。这些结果表明本研究所构建的方法是灵敏可靠的,可以用于食品中Cd2+和Cu2+的分离与检测。
