蛹虫草多糖的提取工艺优化及其抗氧化活性研究
2020-05-08吴杨洋亓小妮谢苗李晓迪陈韵杜秀菊
吴杨洋,亓小妮,谢苗,李晓迪,陈韵,杜秀菊,*
(1.聊城大学生命科学学院,山东聊城252000;2.聊城市水城中学,山东聊城252000)
蛹虫草(Cordyceps militaris)又名北虫草、北冬虫夏草等,属于真菌门,子囊菌亚门,核菌纲,球壳目,麦角菌科,虫草属,是一种具有多种药理功能的食药用菌[1]。蛹虫草含有虫草素、虫草多糖、虫草多肽和核苷类等生物活性成分[2],其中多糖是其主要的活性物质之一[3],具有抗肿瘤、抗氧化、抗菌活性、降血糖和提高免疫力等[4-8]生物活性,具有很高的药用和保健价值。
目前,多糖主要的提取方法有热水浸提法、超声波辅助提取法、微波辅助提取法和酶辅助提取法等[9-10],其中热水浸提法是最为常用的方法。热水浸提法工艺简单、操作简便、成本低等优势[11],所以本研究采用热水浸提法。
在单因素试验的基础上,结合响应面试验对蛹虫草的提取工艺进行优化。对蛹虫草多糖(Cordyceps militaris polysaccharides,CMP)进行不同浓度的乙醇分级得到 CMP20、CMP40、CMP60 和 CMP80,并对不同多糖组分含量(总糖、还原糖和蛋白含量)及体外抗氧化活性(总还原力、DPPH 自由基和羟自由基的清除率)进行比较,为将来的药用和保健产品的开发提供一定的科学依据。
1 材料与方法
1.1 材料与试剂
蛹虫草:沈阳市于洪区海荣食用菌种植基地。
浓硫酸、苯酚、磷酸氢二钠、磷酸二氢钠、水杨酸、硫酸亚铁、过氧化氢、三氯乙酸、三氯化铁、铁氰化钾、抗坏血酸(VC):天津市风船化学试剂科技有限公司;无水乙醇:烟台远东精细化工有限公司;DPPH:美国Sigma 公司;牛血清蛋白:Solarbio 公司;以上试剂均为分析纯。
1.2 仪器与设备
多功能粉碎机(PJ-04A):海助邦贸易有限公司;可见分光光度计(721 型):上海佑科一起仪表有限公司;高效离心机(JKYG5J05):贝克曼库尔特商贸有限公司;旋转蒸发仪(RE-2000B):上海亚荣生化仪器厂;循环水式多用真空泵(SHZ-D-III):郑博科仪器设备有限公司。
1.3 试验方法
1.3.1 多糖的制备
蛹虫草→烘干→粉碎过100 目筛→95 %酒精浸泡(2 次,24 h/次)→抽滤→滤渣烘干→取样加水搅匀→热水浸提→抽滤→浓缩至1/4→醇沉(80%)→4 ℃静置过夜→离心(3 000×g,10 min)→烘干→蛹虫草粗多糖(CMP)。
1.3.2 单因素试验
1.3.2.1 提取时间对提取得率的影响
取 1 g 蛹虫草粉,固定液料比 30 ∶1(mL/g)和提取温度 80 ℃的条件下,考察不同时间(60、90、120、150、180 min)对蛹虫草多糖提取得率的影响,确定最佳提取时间。
1.3.2.2 提取温度对提取得率的影响
取 1 g 蛹虫草粉,固定液料比 30 ∶1(mL/g)和提取时间 120 min 的条件下,考察不同温度(50、60、70、80、90 ℃)对蛹虫草多糖提取得率的影响,确定最佳提取温度。
1.3.2.3 液料比对提取得率的影响
取1 g 蛹虫草粉,固定提取温度80 ℃和提取时间120 min 的条件下,考察不同液料比[10 ∶1、20 ∶1、30 ∶1、40 ∶1、50 ∶1(mL/g)]对蛹虫草多糖提取得率的影响,确定最佳液料比。
1.3.3 响应面试验
根据单因素试验获得的结果。采用Design-Expert 8.0.6.1 软件中的Box-Benhnken 组合设计法,将A 提取温度(℃)、B 液料比(mL/g)、C 提取时间(min)作为自变量,提取得率为响应值,进行试验分析,得到蛹虫草多糖提取的最优工艺参数。试验设计因素与水平见表1。

表1 响应面设计因素与水平Table 1 Factors and levels in response surface design
1.3.4 多糖乙醇分级
取蛹虫草粉200 g,在最优的条件下获得蛹虫草粗多糖(CMP)。取一定量的CMP,加适量水复溶,充分溶解后边搅拌边加入乙醇至浓度为20%,4 ℃静置过夜,离心(7 000 r/min,10 min),收集沉淀,烘干得到CMP20;离心后的溶液继续加入乙醇至浓度分别为40%、60%和80%,按上述步骤进行处理,分别得到CMP40、CMP60 和 CMP80[12]。
1.3.5 多糖组分含量的测定
参考张惟杰[13]的方法测定总糖含量,还原糖含量;参考路苹等[14]的方法测定蛋白质含量。
多糖含量/%=总糖含量/%-还原糖含量/%
1.4 多糖抗氧化活性的测定
1.4.1 总还原力
参考Zhao 等[15],田淑雨等[16]的方法。取不同浓度的样品液1.0 mL,磷酸盐缓冲液(phosphate buffer saline,PBS)2 mL(pH 6.6,0.2 mol/L),2 mL 的 1%铁氰化钾溶液于试管中,混匀,50 ℃下反应20 min 后加入10%三氯乙酸溶液 2 mL,离心(7 000 r/min,10 min)。分别取2.5 mL 上清液、超纯水和1.0 mL 0.1%三氯化铁溶液于试管中,混匀后在室温(25 ℃)下静置10 min。在700 nm 波长下测其吸光值为A。以VC作为阳性对照。设3 个平行试验,取均值。
1.4.2 DPPH 自由基清除能力
参照 Sirine 等[17]、Du 等[18]的方法,并稍作修改。取1.0 mL 不同质量浓度的样品液于试管中,加入1.0 mL DPPH 无水乙醇溶液(0.2 mmol/L),混匀,常温下避光反应30 min 后,在517 nm 处测吸光值。以VC作为阳性对照。设3 个平行试验,取均值。DPPH 自由基清除率I(%)的公式为:
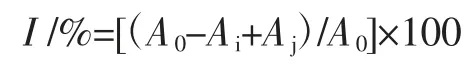
式中:Ai为样品液和DPPH 混合液的吸光值;Aj为样品液和无水乙醇混合液的吸光值;A0为DPPH 和无水乙醇混合液的吸光值。
1.4.3 羟自由基清除能力
参照 Smirnoff 等[19]、Chen 等[20]方法,并稍作修改。取1.0 mL 不同质量浓度的样品液,30 % H2O2溶液(4 mmol/L,1 mL),FeSO4溶液(4 mmol/L,1 mL),水杨酸无水乙醇溶液(4 mmol/L,1 mL)于试管中,混匀,37 ℃下避光反应 30 min 后离心(7 000 r/min,10 min),在510 nm 处测上清液的吸光值。以VC作为阳性对照。设3 个平行试验,取均值。羟自由基清除率I(%)的公式为:

式中:Ai为样品液和水杨酸的吸光度值;Aj为无水乙醇替换水杨酸的吸光值;A0为蒸馏水替换多糖溶液的吸光值。
1.5 数据处理
所有数据重复3 次,试验结果的均值±标准偏差,采用SPSS 软件进行处理;响应面试验相关数据分析采用Esign-Expert 8.0.6.1 软件。
2 结果与分析
2.1 单因素试验
2.1.1 提取时间对多糖得率的影响
提取时间对蛹虫草多糖提取得率的影响见图1。
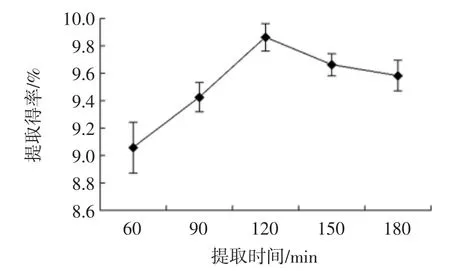
图1 提取时间对蛹虫草多糖提取得率的影响Fig.1 Effect of extraction time on the yield of C.militaris polysaccharides
在提取时间小于120 min 时,提取得率随时间的增加有明显增加;在120 min 时,提取得率最高。超过120 min 后,提取得率出现小幅度的下降。因此,最佳提取时间在120 min 左右。
2.1.2 提取温度对多糖得率的影响
提取温度对蛹虫草多糖提取得率的影响见图2。
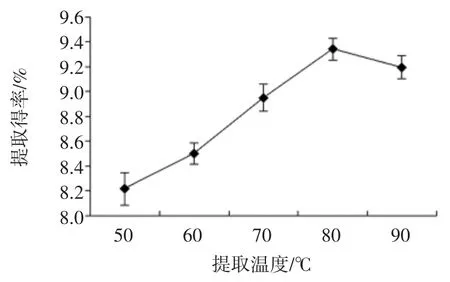
图2 提取温度对蛹虫草多糖提取得率的影响Fig.2 Effects of extraction temperature on the yield of C.militaris polysaccharides
提取温度在50 ℃~80 ℃内,提取得率随着温度的升高而增大;当提取温度超过80 ℃时,提取得率出现下降的趋势,这可能是由于温度不断升高,导致多糖部分水解[21]。因此,最佳提取温度应控制在80 ℃左右。
2.1.3 液料比对多糖得率的影响
液料比对蛹虫草多糖提取得率的影响见图3。

图3 液料比对蛹虫草多糖提取得率的影响Fig.3 Effects of water to raw material ratio on the yield of C.militaris polysaccharides
液料比的大小对蛹虫草多糖多糖提取得率有一定的影响,随着液料比增大多糖得率增大在30 ∶1(mL/g)时达到最大值,之后随着液料比的增大蛹虫草多糖提取得率降低。因此,最佳液料比为30 ∶1(mL/g)。
2.2 响应面试验
2.2.1 响应面试验设计与结果
根据单因素试验结果,采用Design-Export 软件中的Box-Benhnken 组合设计法确定蛹虫草多糖提取得率设计方案。选取提取温度(A)、液料比(B)和提取时间(C)3 个因素,试验设计与结果见表2。
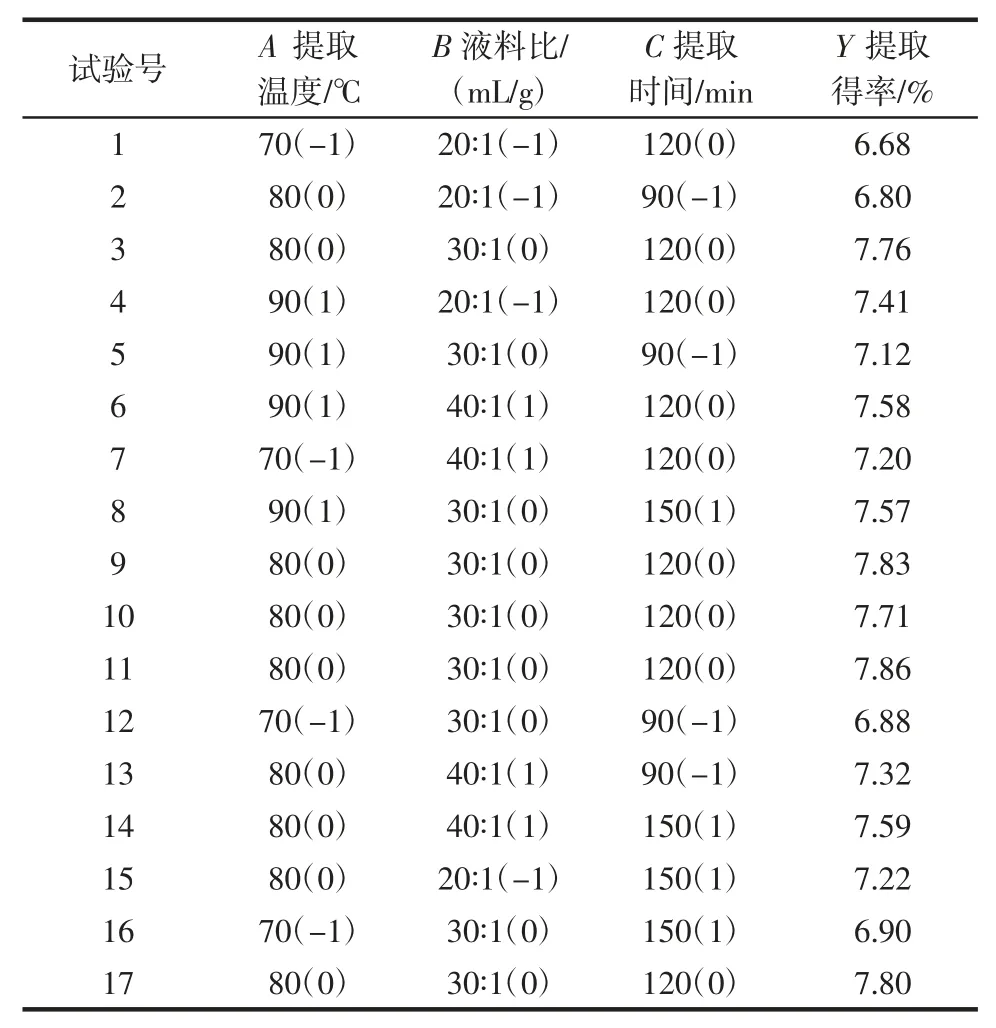
表2 响应面试验设计与结果Table 2 The designs and results of Box-Behnken test
2.2.2 模型方程建立与显著性检验
采用Design-Expert 软件对试验结果进行分析,拟合回归方程为:Y=7.79+0.25A+0.20B+0.15C-0.088AB+0.11AC-0.038BC-0.34A2-0.23B2-0.33C2。其回归模型方差分析结果见表3。
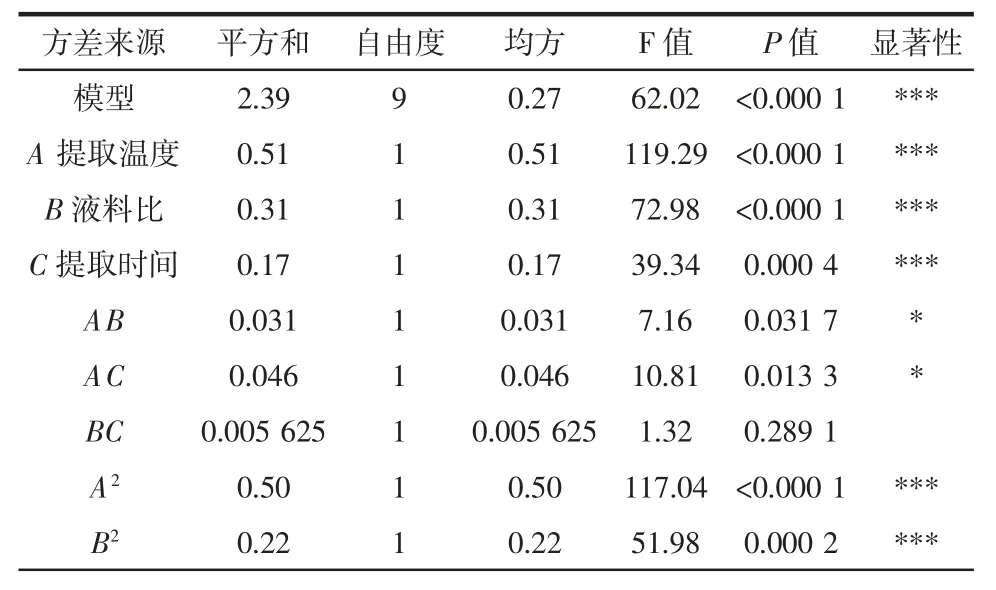
表3 方差分析结果Table 3 The regression model of variance analysis results
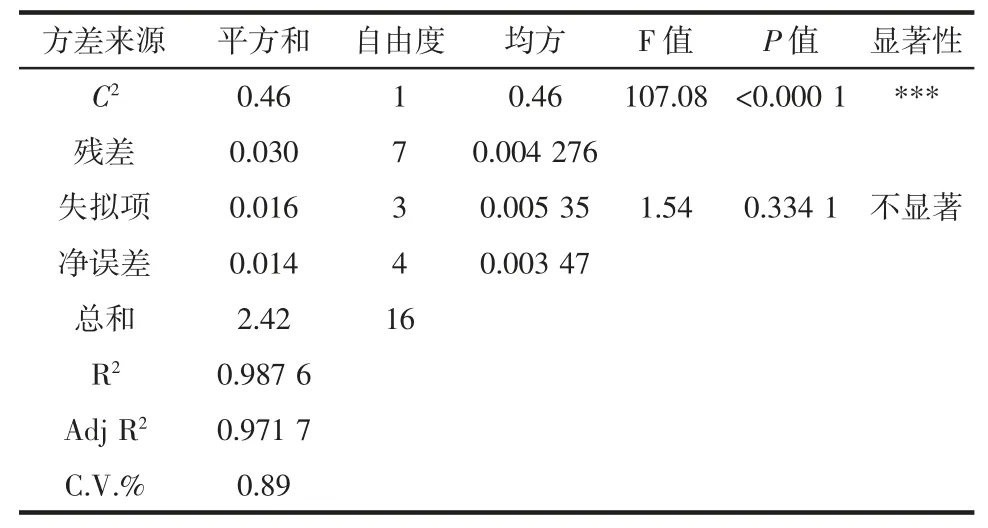
续表3 方差分析结果Continue table 3 The regression model of variance analysis results
由表3 可知,该模型P<0.001,表明回归模型极显著;回归模型的失拟项P=0.334 1>0.05 不显著,表明选用的二次回归模型是适当的;模型相关系数R2=0.987 6,校正确定系数Adj R2=0.971 7,说明试验测定值和预测值之间的相关性较高。CV=0.89<10%,说明试验的可行度和精确度高。由表3 的P 值可知,提取时间、液料比和提取温度对蛹虫草多糖的提取得率均达到极显著水平(P<0.001)。
2.2.3 交互作用影响结果
根据二次方程模型分别作出试验因素间交互作用立体曲面图和等高线图,考察在某个因素固定不变的情况下,其他两个因素的交互作用对蛹虫草多糖提取得率的影响见图3。
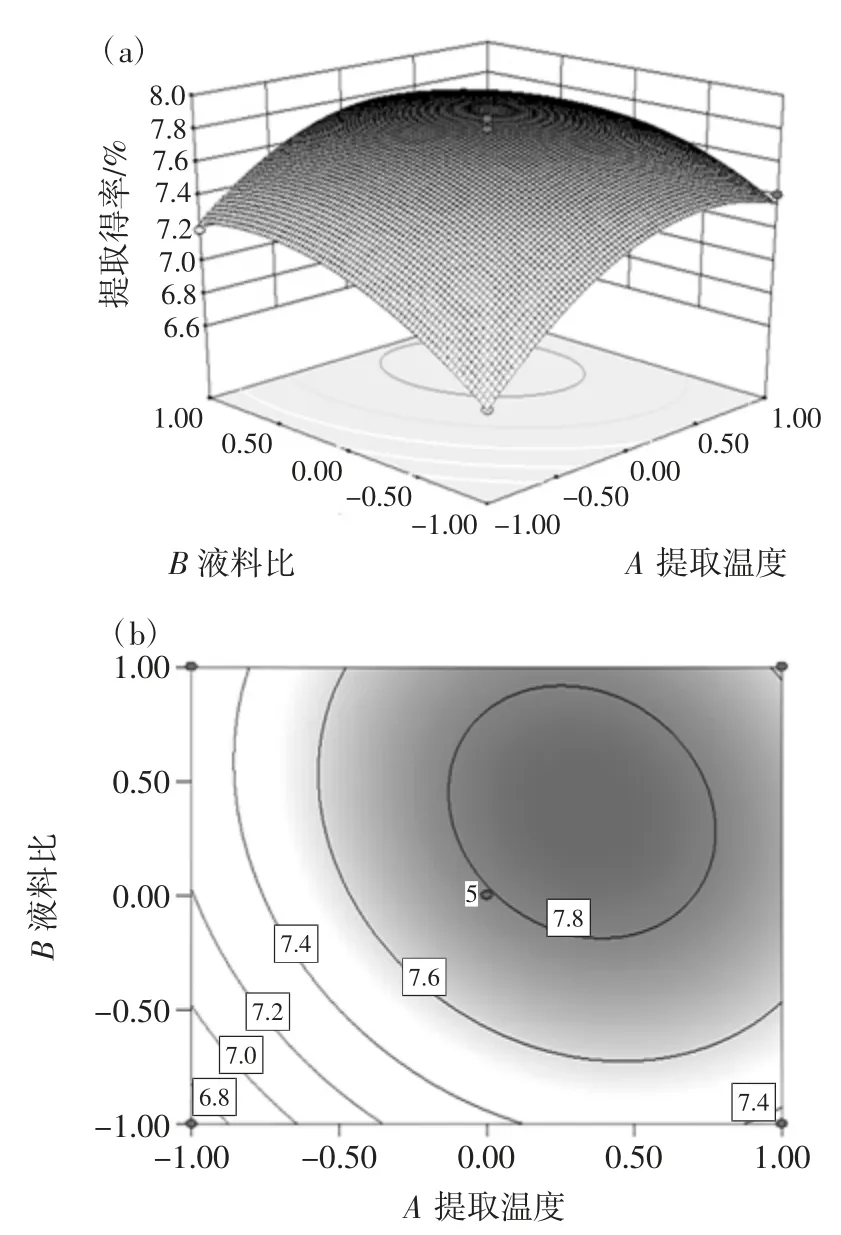
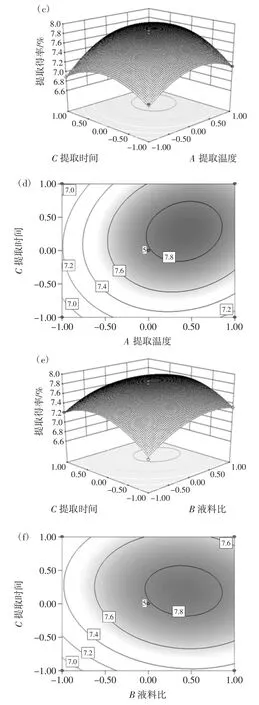
图3 提取温度、液料比和提取时间对蛹虫草多糖提取得率的影响Fig.3 The effects of extracyion temperature,water to raw material ratio and extraction time on the C.militaris polysaccharides extraction yield
等高线的形状为椭圆表示因素的交互作用显著,圆形则表示交互作用不显著[22]。立体曲面图都呈开口向下的抛物面,说明温度、液料比和时间在本试验数据范围内,对蛹虫草多糖的提取得率均存在最优值。利用二次方程模型分别对参数进行求导,得到最佳条件为温度83.63 ℃、液料比33.40 ∶1(mL/g)和时间127.78 min,此时的预测蛹虫草提取得率为7.89%。为方便实际操作,将工艺参数修正为温度84 ℃、液料比33 ∶1(mL/g)和时间 128 min,在此条件下,经 3 次平行试验,得蛹虫草多糖提取得率平均值为7.83%,与理论预测值的相对误差为0.77%,误差较小,说明响应面优化蛹虫草多糖提取工艺是有效可行的。
2.3 不同多糖组分含量的比较
在最优条件下得到蛹虫草粗多糖(CMP),CMP 经过不同浓度乙醇分级得到CMP20、CMP40、CMP60 和CMP80,其得率、组分含量见表4。
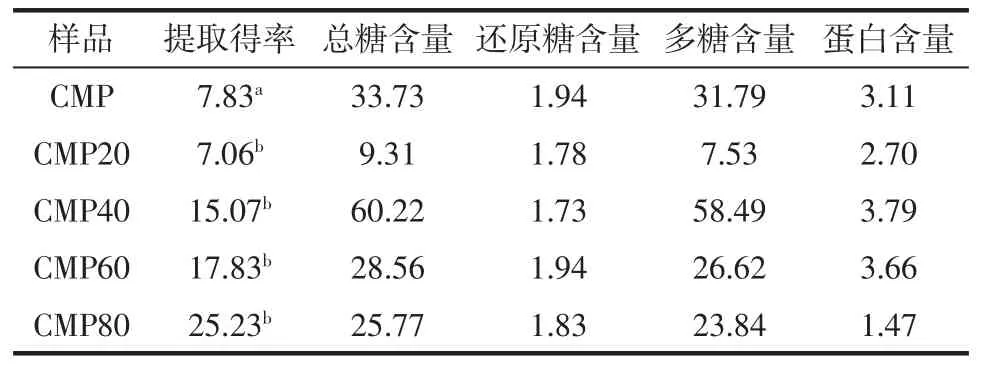
表4 不同蛹虫草多糖提取得率与组分含量的比较Table 4 Extraction yields,components content of various polysaccharides from C.Militaris %
CMP 的提取得率、多糖和蛋白含量分别为7.83%,31.79%和3.11%;CMP80 得率最高,蛋白含量最低,分别为 25.23 %和1.47 %;CMP40 多糖含量最高(58.49%)。
2.4 不同多糖抗氧化活性的比较
不同蛹虫草多糖抗氧化活性的比较见表5。
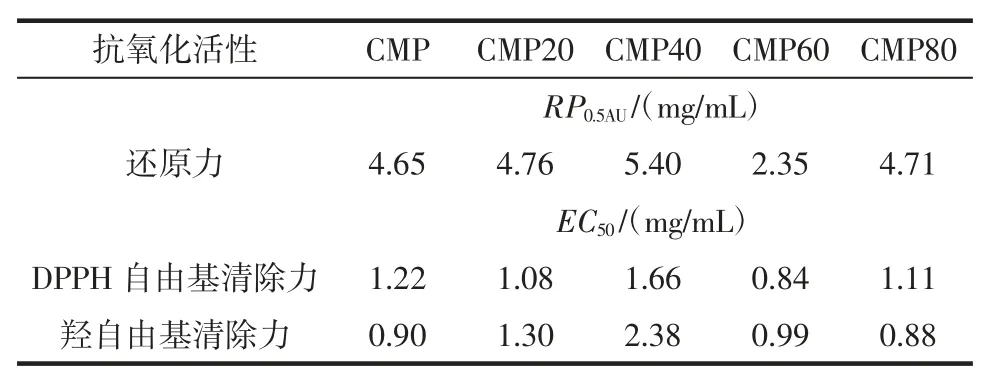
表5 不同蛹虫草多糖抗氧化活性的比较Table 5 EC50 values and RP0.5AU values of various polysaccharides from C.militaris in antioxidant activity
2.4.1 总还原力
还原力通常被用来作为测定多糖抗氧化活性的重要指标[23]见图4 和表5。
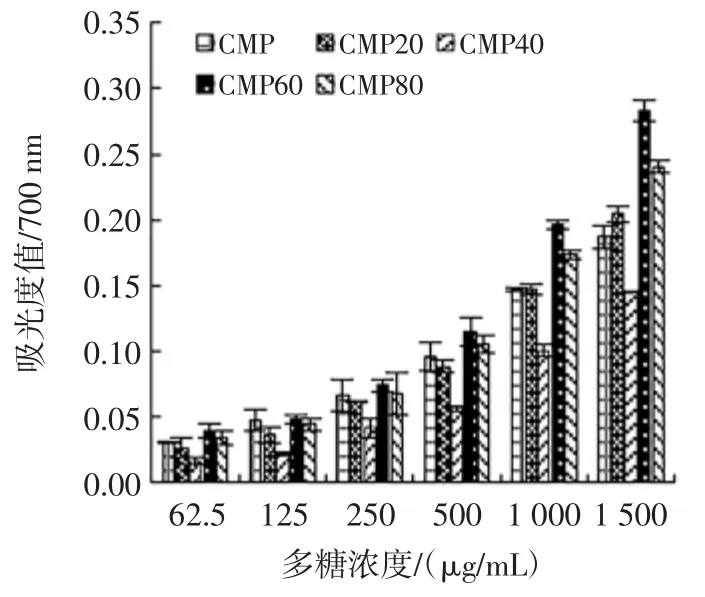
图4 不同蛹虫草多糖的还原力Fig.4 The reducing powerof various C.militaris polysaccharides
当样品浓度在 62.5 μg/mL~1 500 μg/mL 范围内,5 种多糖均呈现浓度效应依赖性,随浓度的增大,还原力越强;5 种多糖的还原力大小顺序为:CMP60>CMP>CMP20>CMP80>CMP40,CMP60 还原力最大,CMP40最小,RP0.5AU分别为 2.35 mg/mL 和 4.76mg/mL。
2.4.2 清除DPPH 自由基的能力
不同多糖DPPH 自由基的清除率和EC50 值见图5 和表 5。

图5 不同蛹虫草多糖的DPPH 自由基清除率Fig.5 The scavenging rates of DPPH radical of various C.militaris polysaccharides
当样品浓度在 62.5 μg/mL~1 500 μg/mL 范围内,随着浓度的增加,5 种多糖的清除力均表现出增强趋势,表明5 种多糖均有抗氧化活性;5 种多糖对于DPPH 自由基的清除率高低顺序为:CMP60>CMP20>CMP>CMP80>CMP40,CMP60 清除 DPPH·的能力最强,CMP40 最弱,EC50分别为 0.84(mg/mL)和 1.66(mg/mL)。
2.4.3 清除羟自由基的能力
不同多糖羟自由基的清除率和EC50值见图6 和表5。

图6 不同蛹虫草多糖的羟自由基清除率Fig.6 The scavenging rates of hydroxyl radical of various C.militaris polysaccharides
当样品浓度在 62.5 μg/mL~1 500 μg/mL 范围内,5种多糖的清除率均呈现明显的浓度依赖性,表明5种多糖均具有羟自由基清除活性;5 种多糖对于羟自由基的清除活性高低顺序为:
CMP80 > CMP > CMP60 > CMP20 > CMP40,其中CMP80 清除·OH 的能力最强,CMP40 最弱,EC50分别为 0.90 mg/mL 和 2.38 mg/mL。
3 结论
采用响应面法对蛹虫草多糖(CMP)提取得率进行优化,考察提取温度、液料比、提取时间对蛹虫草提取得率的影响,得到最佳工艺条件为:提取温度84 ℃、液料比 33 ∶1(mL/g)和提取时间 128 min,在此条件下,CMP 实际提取得率为7.83%,与预测值的误差较小。因此,此优化模型具有一定的参考价值。
在最优提取条件下,获得CMP,并进行乙醇分级沉淀,得到 CMP20、CMP40、CMP60 和 CMP80。CMP20、CMP40、CMP60 和 CMP80 的得率分别为:7.06 %、15.07%、17.83%和25.23%。其中,CMP80 的得率最高,蛋白含量最低(仅为1.47%);CMP40 多糖含量最高,蛋白含量同样最高,分别为58.49%和3.79%。
抗氧化试验结果表明,5 种蛹虫草多糖均具有一定的抗氧化活性,且具有一定的浓度依赖性。其中,CMP60 的还原力和DPPH 自由基的清除率均最高,RP0.5AU、EC50分别为 2.35 mg/mL 和 0.84 mg/mL;CMP80的羟自由基的清除率最高,EC50分别为0.88 mg/mL;CMP40 在还原力、清除DPPH 自由基和羟自由基能力均为最弱。
