三斑海马蛋白ACE抑制肽的制备及其二级结构的研究
2020-05-08石杰宿瑞奇张文婷陈健
石杰,宿瑞奇,张文婷,陈健
(海南大学食品科学与工程学院,海南海口570228)
近年来,高血压日益成为影响世界上多数国家30%成年人的流行疾病。作为一种严重的慢性疾病,它能引起动脉硬化、中风、心肌梗塞等高危疾病。同时,高血压患者也呈现低龄化发展趋势[1]。因此,寻求有效治疗高血压的方法迫在眉睫。血管紧张素转化酶(angiotensin I-converting enzyme,ACE)(EC 3.4.15.1) 是一种锌金属肽酶,通过肾素-血管紧张素系统(renin-angiotensin system,RAS)和激肽释放酶激肽系统(kallikrein kinin system,KKS)对血压起调节作用[2]。基于ACE作用原理,现已研发了一些合成的ACE 抑制剂,包括卡托普利(captopril),赖诺普利(lisinopril),依那普利(enalapril)和阿拉普利(alacepril)。它们对治疗高血压具有显著疗效,但也伴随着咳嗽、味觉紊乱、皮疹、血管神经性水肿等明显的副作用[3]。因此,开发无毒、经济、安全有效的ACE 抑制剂显得尤为重要。
三斑海马(Hippocampus trimaculatus Leach)是一种隶属于海龙科的海洋硬骨鱼,主要分布在亚热带、热带的浅海区域[4]。近年来的研究表明其体内富含甾体类、蛋白质、脂肪酸、磷脂类等活性成分,特别是蛋白质含量高达67.90%~73.56%(干重)[5-6]。三斑海马作为亚洲地区传统的海洋中药材,具有抗疲劳、抗肿瘤、抗炎、抗衰老等生理功效[5-6],因而具有广阔的开发和应用前景。
众所周知,海马作为海洋药源性和观赏性动物,具有极高的中医药价值。现有研究主要是海马种群分布[7]、水溶性[8]或脂溶性[9]成分分析、长链碱[4]、糖脂[10]等,关于海马蛋白提取的研究比较少。目前,人们已从多种海洋生物蛋白中分离得到ACE 抑制肽,如鲑鱼[3]、蜥蜴鱼[11]、太平洋鳕鱼[12]等,这些研究表明海洋生物蛋白可作为提取ACE 抑制肽的重要来源。然而,关于海马ACE 抑制肽的分离纯化尚未见到报道。
本试验以三斑海马为原料,以ACE 抑制活性为指标。通过酶解,连续色谱分离,并对反相高效液相色谱分离得到的ACE 抑制活性最高组分进行质谱鉴定,成功分离得到一种ACE 抑制肽,并分析其二级结构。本研究为三斑海马蛋白的提取,开发治疗高血压的功能性食品提供了一定的理论依据。
1 材料与方法
1.1 材料与试剂
三斑海马干品:海南龙盛生物科技发展有限公司;血管紧张素转化酶(ACE)(来源于兔肺,2.0 U/mg)、马尿酰-组氨酰-亮氨酸(HHL):美国 Sigma 公司;碱性蛋白酶(2×106U/g)、葡聚糖凝胶 G-25:北京索莱宝科技有限公司;乙腈(色谱纯):赛默飞世尔科技(中国)有限公司;三氟乙酸(trifluoroacetic acid,TFA)(色谱纯):上海麦克林生化科技有限公司。
1.2 仪器与设备
真空干燥箱(AY-DZF-6210):上海尚群电子科技有限公司;恒流泵(HL-2):苏州江东精密仪器有限公司;电子天平(AUW220):厦门群隆仪器有限公司;电脑自动部分收集器(DBS-160F):上海精科实业有限公司;数显恒温水浴锅(HH-4):江苏盛蓝仪器制造有限公司;冷冻干燥机(ALPHA 1-2):北京五洲东方科技发展有限公司;紫外可见分光光度计(UV757CTR):上海仪电分析仪器有限公司;反相高效液相色谱仪(Agilent 1260):美国安捷伦科技有限公司;圆二色光谱仪(Chirascan):英国应用光物理公司。
1.3 方法
1.3.1 脱脂三斑海马粉末的制备
将三斑海马干品用蒸馏水洗净,并去除内脏等,电热恒温鼓风干燥箱中60 ℃烘干至恒重,粉碎,过60 目筛。称取一定质量的三斑海马粉末置于烧杯中,按料液比1 ∶6(g/mL)加入乙酸乙酯,恒温磁力搅拌器上脱脂30 min,抽滤,收集滤液,重复脱脂过程3 次,将脱脂处理的三斑海马粉末于烘箱中40 ℃蒸干乙酸乙酯。
1.3.2 三斑海马酶解产物的制备
参照徐克寒等[13]的方法,使用碱性蛋白酶,在其最适温度和pH 值条件下,制备三斑海马酶解产物。称取适量脱脂三斑海马粉末,按料液比1 ∶15(g/mL)加入去离子水,混匀,调节pH 值至9.5,按1.0%加酶量,60 ℃酶解6 h,沸水浴10 min 灭酶,终止反应。酶解液冷却至 25 ℃,抽滤收集滤液,离心(5 000 r/min,20 min),取上清液,冷冻干燥成粉末,-20 ℃隔光隔氧保存。
1.3.3 分离和纯化ACE 抑制肽
1.3.3.1 透析
对三斑海马酶解液进行透析处理。4 ℃条件下,将酶解液于置于磁力搅拌器上透析72 h,每隔6 h~8 h 换一次超纯水,透析完后冷冻干燥得到透析产物,-20 ℃隔光隔氧保存。
1.3.3.2 Sephadex G-25 凝胶柱分离纯化
选用Sephadex G-25 凝胶对透析产物进行分离纯化,将预处理好的葡聚糖凝胶采用自然沉降法装填至1.6 cm×90 cm 的玻璃层析柱中,平衡4 h~5 h,调节流速至0.3 mL/min,透析产物溶于超纯水配成50 mg/mL溶液,过0.45 μm 针孔式滤膜,上样体积2 mL,用超纯水洗脱,自动部分收集器每10 min 收集一管,检测波长280 nm,按峰分别多次收集洗脱液,冷冻干燥,-20 ℃隔光隔氧保存。
1.3.3.3 反相高效液相色谱分离纯化
将Sephadex G-25 凝胶层析分离得到的ACE 抑制活性最强组分以超纯水(含0.1%TFA)溶解,配成30 mg/mL 溶液,过 0.22 μm 针孔式滤膜,以反相高效液相色谱仪分离纯化,按峰分别多次收集洗脱液,冷冻干燥,测定各组分峰ACE 抑制活性。
色谱条件:ODS HYPERSIL C18(10 mm×250 mm,5 μm)色谱柱;上样量:100 μL;洗脱流速:3 mL/min;柱温:25 ℃;检测波长:215 nm;流动相 A:超纯水(含0.1%TFA);流动相 B:乙腈(含 0.1 % TFA);洗脱条件:0~10 min,10%B,10 min~50 min,10%~42%B。
1.3.4 测定ACE 抑制活性
参照Ko 等[14]的方法测定ACE 抑制活性,稍做修改后使用。取50 μL 待测样品溶液和150 μL 8.3 mmol/L HHL 溶液(含 0.3 mol/L NaCl,pH 8.3)于 2 mL 离心管中,混匀,37 ℃水浴预热 5 min 后,向离心管中加入 50 μL 0.025 U/mL ACE 溶液(ACE 溶于含 0.3 mol/L NaCI 硼酸缓冲液,pH 8.3),混匀,于 37 ℃水浴 1 h 后,加入 250 μL 1 mol/L HCl 溶液终止反应,混匀。再加入1.5 mL 乙酸乙酯萃取反应生成的马尿酸,混匀,离心(3 000 r/min,10 min),移取 1 mL 上清液于 5 mL 离心管中,真空浓缩3 h 蒸干乙酸乙酯,再加3 mL 去离子水复溶,混匀,于228 nm 波长处测定吸光度值。按下式计算ACE 抑制率。
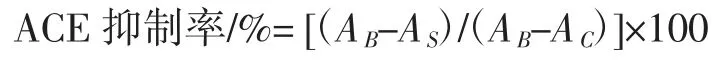
式中:AS为样品组的吸光度值;AB为空白组的吸光度值;AC为对照组的吸光度值。
1.3.5 鉴定ACE 抑制肽的氨基酸序列和分子量
委托生工生物工程(上海)股份有限公司鉴定反相高效液相色谱纯化得到的ACE 活性最高组分的氨基酸序列和分子量。样品溶于0.1%甲酸水溶液,自动进样器上样于LTQ Orbitrap Velos Pro 质谱仪。仪器使用前经丁螺环酮标准校准液校正。正离子检测,离子源为ESI,喷雾电压:1.8 kV,离子传输毛细管温度:250 ℃,扫描范围:50 m/z ~750 m/z,质谱扫描方式为信息依耐采集工作模式,碎裂方式为碰撞诱导解离。使用Mascot 2.3 软件从海马数据库中自动匹配得到多肽序列。
1.3.6 圆二色光谱分析
委托生工生物工程(上海)股份有限公司使用圆二色光谱法分析纯肽的二级结构。取适量样品溶于20 mmol/L 磷酸盐缓冲液(pH 7.2),使其浓度为0.2 mg/mL,取200 μL 溶液上样于圆二色光谱仪,使用石英比色皿,在 25 ℃、190 nm~260 nm 条件下扫描,带宽1.0 nm,扫描速率120 nm/min,磷酸盐缓冲液作为空白,实验重复三次。采用CDNN 软件计算α 螺旋,β 折叠,β 转角和无规则卷曲的含量。
1.3.7 傅里叶变换红外光谱
在红外灯照射下,取适量ACE 抑制活性最强的层析分离组分,与KBr 粉末混匀,充分研磨后压成透明薄片,通过傅里叶变换红外光谱仪,在4 000 cm-1~400 cm-1内测定ACE 抑制活性最强的层析分离组分红外吸收光谱。
1.3.8 试验数据处理
采用SPSS 21.0 分析试验数据,试验数据以平均值±标准差()表示,Origin Pro 9.1 软件作图,采用ANOVA 分析数据间差异,P<0.05,表示差异有显著意义。
2 结果与分析
2.1 三斑海马酶解产物的制备
多项研究表明,碱性蛋白酶酶解食源性蛋白质得到的产物具有潜在的生物活性,如抗氧化活性[15-16]和ACE 抑制活性[17-18]。这些多肽的生物活性归因于碱性蛋白酶具有内切肽酶的性质。此外,碱性蛋白酶酶解蛋白质产生的短肽序列,可解释这些生物活性,包括ACE 抑制活性[19-20]。试验中选用碱性蛋白酶酶解三斑海马制备富含ACE 抑制肽的酶解产物,其IC50值为(0.81±0.12)mg/mL。因为酶解产物具有ACE 抑制活性,证明了碱性蛋白酶酶解蛋白质所得产物的ACE 抑制活性。
2.2 三斑海马蛋白ACE抑制肽的分离和纯化
2.2.1 透析
酶解物和透析产物的IC50值见表1。

表1 酶解物和透析产物的IC50 值Table 1 The IC50 values of hydrolysate and dialysis product
试验中对酶解液进行透析处理,透析完成后冷冻干燥,并测定透析产物的ACE 抑制活性,相比酶解产物而言,透析产物具有更强的ACE 抑制活性,其IC50值为(0.44±0.26)mg/mL。以上结果表明,从三斑海马蛋白中分离纯化ACE 抑制肽是可行的。
2.2.2 Sephadex G-25 凝胶柱分离纯化
葡聚糖凝胶层析,又称分子排阻层析,是一种依据待分离物质的分子量大小进行分离的技术[21]。葡聚糖凝胶层析谱图见图1。
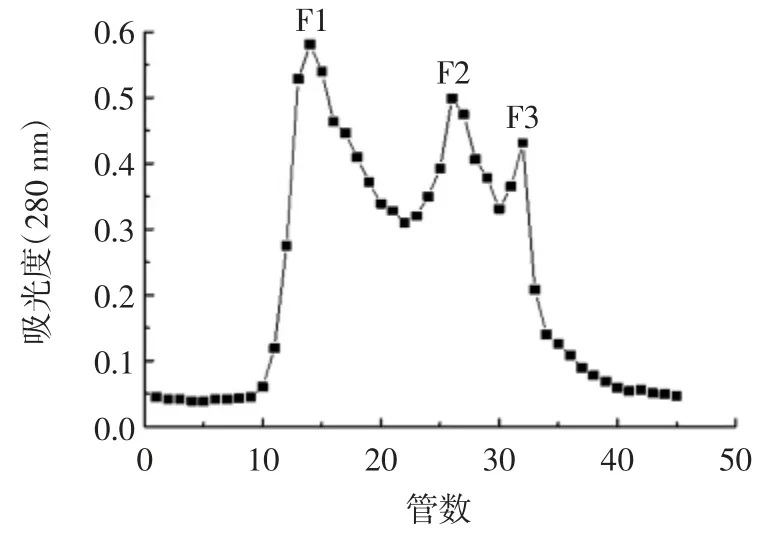
图1 葡聚糖凝胶层析谱图Fig.1 Elution profile of sephadex G-25 gel filtration chromatography
如图1 所示,透析产物经葡聚糖凝胶G-25 进一步分离纯化,得到3 个吸附峰,分别标记为F1,F2 和F3。将各组分配成1 mg/mL 溶液,并测定其ACE 抑制活性,如图2 所示。
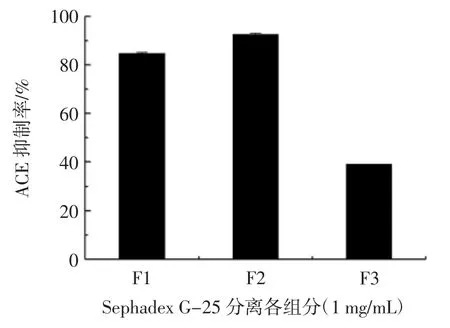
图2 Sephadex G-25 分离各组分 ACE 抑制率(,n=3)Fig.2 The ACE-inhibiting activity of each fraction separated by sephadex G-25 gel filtration chromatography(,n=3)
组分F2 的ACE 抑制率最高,为(92.51± 0.49)%,IC50值为(0.11± 0.08)mg/mL。相比透析产物,其 ACE抑制活性明显增强,因此F2 用于进一步分离纯化。
2.2.3 反相高效液相色谱分离纯化
反相高效液相色谱是一种依据物质在固定相和流动相中分配系数、吸附能力等亲和能力的不同而将物质分离的色谱方法,具有分析速度快,分离效果好和灵敏度高等特点[21]。
试验中采用RP-HPLC 对葡聚糖G-25 凝胶分离得到的ACE 抑制活性最高组分F2 进一步分离纯化,如图3 所示。
F2 经反相高效液相色谱分离后,得到6 个具有ACE 抑制活性的峰,分别标记为 F2-1,F2-2,F2-3,F2-4,F2-5 和F2-6。由图3 可知,洗脱过程中产生了大量多肽,样品中存在的亲水性盐氯化钠可能影响了分离效果。分别测定各峰ACE 抑制活性,结果如图4所示。
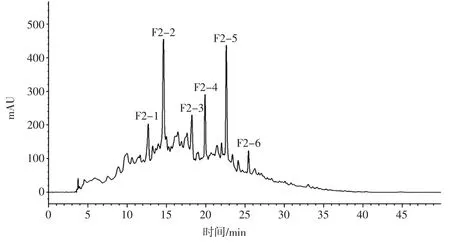
图3 F2 经反相高效液相色谱纯化色谱图Fig.3 Purification of F2 by reversed-phase high performance liquid chromatography
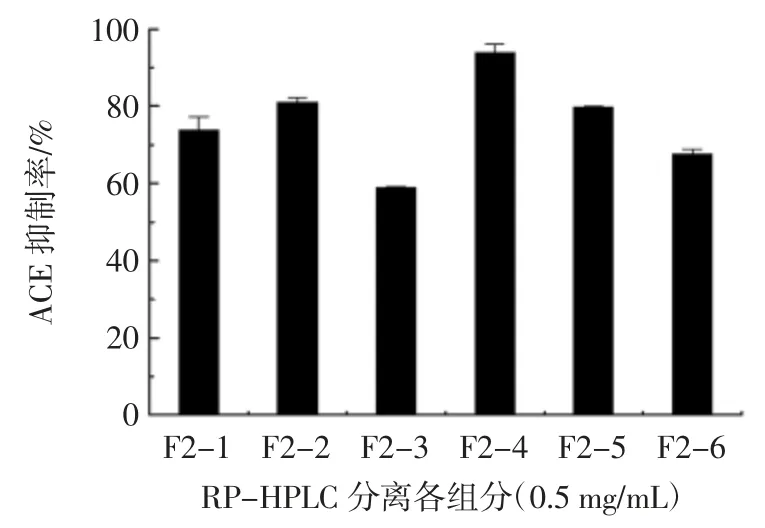
图4 F2 经 RP-HPLC 分离各组分 ACE 抑制率(,n=3)Fig.4 The ACE-inhibiting activity of each fraction separated by RP-HPLC(,n=3)
组分 F2-4 的 ACE 抑制活性最强,0.5 mg/mL 的F2-4 的 ACE 抑制率为 (93.91 ± 2.18)%,IC50值为(0.005 7± 0.000 9)mg/mL。因此,F2-4 用于鉴定 ACE抑制肽分子量和氨基酸序列。
2.4 ACE抑制肽分子量和氨基酸序列的鉴定
试验通过电喷雾串联质谱(electrospray ionizationtandem mass spectrometry,ESI-MS/MS)鉴定反相高效液相色谱(reversed-phase high performance liquid chromatography,RP-HPLC)分离得到的ACE 抑制活性最强组分F2-4 的氨基酸序列和分子量,如图5 所示,多肽序列为 Pro-Ala-Gly-Pro-Arg-Gly-Pro-Ala(PAGPRGPA),分子量为 721.39 Da。
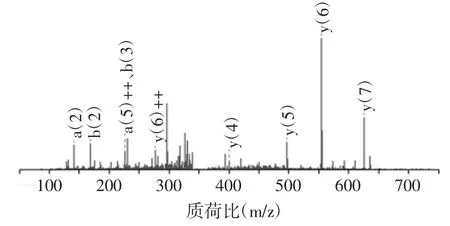
图5 F2-4 二级质谱图Fig.5 The secondary mass spectrum of F2-4
不同来源的海洋鱼类蛋白ACE 抑制肽见表2。
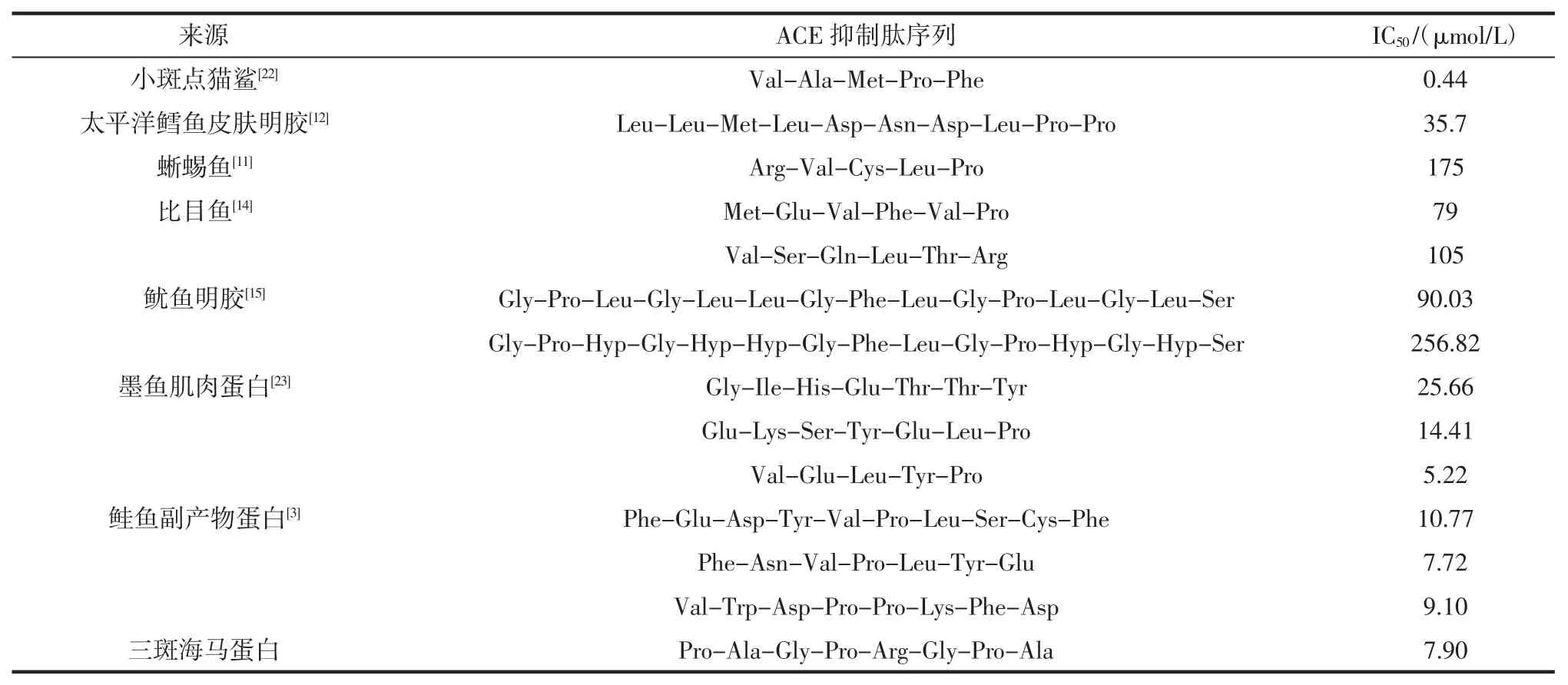
表2 不同来源的海洋鱼类蛋白ACE 抑制肽Table 2 Marine fish protein ACE inhibitory peptide from different resources
如表2 所示,近年来,人们从各种来源的海洋鱼类蛋白中分离出多种ACE 抑制肽。相比较而言,从三斑海马蛋白中分离得到的ACE 抑制肽具有相近或更强的ACE 抑制活性。
生物活性肽通常含有3~20 个氨基酸,低分子量的多肽比高分子量的多肽更有可能成为生物活性肽[22]。ACE 抑制剂通常含有1 或2 个分子功能受体,如锌结合配体,1 个氢链供体和羧基端基基团[24]。考虑到多肽结构和ACE 抑制活性的关系,通常,多肽C 末端有芳香族氨基酸,如脯氨酸(Pro)、苯丙氨酸(Phe)或酪氨酸(Tyr),N 末端有脂肪族氨基酸,如缬氨酸(Val)或异亮氨酸(Ile),具有较强抑制活性[25]。Wu[26]等人通过计算分析提出ACE 抑制肽模型。他们认为,N 末端含有疏水性氨基酸残基,中间带有正电荷氨基酸,C 末端带有芳香族氨基酸残基的多肽显示更强的ACE 抑制活性。尽管ACE 抑制肽的结构活性关系还没完全建立,这些多肽具有一些共同的结构特征。实验成功从三斑海马蛋白中分离得到一种ACE 抑制肽,其多肽序列中含有三个脯氨酸(Pro)和两个丙氨酸(Ala),均为疏水性氨基酸,可能对ACE 抑制活性具有促进作用。
2.5 圆二色光谱分析
圆二色谱已经被广泛应用于研究蛋白质二级结构、动力学和折叠。二级结构,如α 螺旋,β 折叠和β转角在波长190 nm~260 nm 范围内有圆二色性[27]。α螺旋占优势的蛋白质在193 nm 附近有正椭圆率,222 nm和208 nm 处有负椭圆率。β 折叠占优势的蛋白质在218 nm 有负椭圆率,195 nm 有正椭圆率。无序蛋白质在高于210 nm 时有很低的椭圆率,195 nm 附近有负椭圆率[28]。多肽远紫外圆二色谱图如图6 所示。
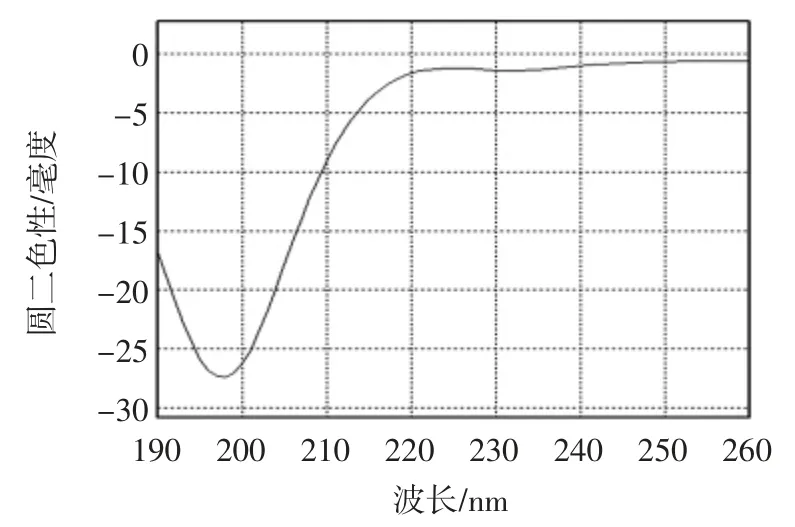
图6 多肽远紫外圆二色谱图Fig.6 The far-UV circular dichroism spectrum of the purified peptide
圆二色谱图显示其在198 nm 附近有一个负峰,217 nm~225 nm 波长范围内有一个肩峰,无典型的α螺旋和β 折叠的结构特征。多肽二级结构预测见表3。

表3 多肽二级结构预测Table 3 The prediction of the purified peptide secondary structure
试验中测定了4 种不同的二级结构,分别为α 螺旋,β 折叠,β 转角和无规则卷曲。如表3 所示,多肽由6.0% α 螺旋,31.5% β 折叠,31.4% β 转角和 35.6%无规则卷曲组成。试验结果与Rhiannon[29]等的结果类似。
2.6 红外光谱分析
层析分离组分F2 的红外光谱图如图7 所示。
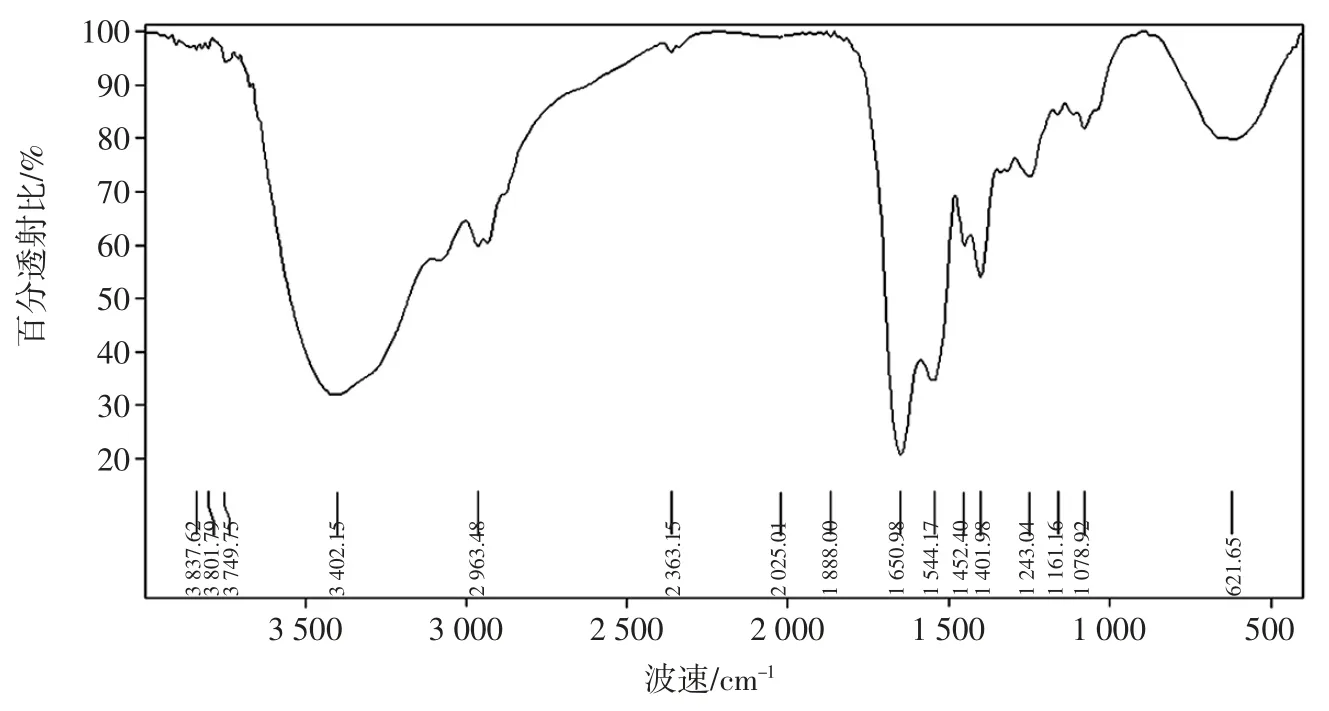
图7 层析分离组分F2 红外光谱图Fig.7 The FT-IR spectrum of F2
3 402.15 cm-1附近,强且宽的特征吸收峰是由OH 伸缩振动引起的,而2 963.48 cm-1处的吸收峰是由C-H 伸缩振动引起的。1 650.98 cm-1处最强的吸收峰是由酰胺基团中C=O 不对称伸缩振动引起的。1 544.17 cm-1处较强的吸收峰与酰胺基团中NH 伸缩振动有关。在1 401.98 cm-1处的吸收峰是由胺基基团中CN 伸缩振动引起的。上述结果表明F2 中存在肽键。
3 结论
本试验通过碱性蛋白酶酶解三斑海马蛋白制备含有ACE 抑制肽的酶解物,研究了酶解物、透析产物、葡聚糖凝胶分离各组分及反相高效液相色谱纯化各组分的ACE 抑制活性,并对反相液相色谱分离得到的ACE 抑制活性最强最分进行结构鉴定,成功从三斑海马蛋白中分离得到一种ACE 抑制肽:Pro-Ala-Gly-Pro-Arg-Gly-Pro-Ala(分子量:721.39 Da),其 IC50值为(0.005 7±0.000 9)mg/mL,具有较强的ACE 抑制活性。圆二色谱分析显示其无规则卷曲含量较高。本试验为三斑海马蛋白多肽的开发利用提供了一定的理论基础。
