柱层析法纯化藻胆蛋白的紫外-可见光谱特征研究与机理分析
2020-05-07汪家权赵冰冰张发宇
武 康,汪家权,赵冰冰,方 艳,张发宇
1. 合肥工业大学资源与环境工程学院,安徽 合肥 230009 2. 合肥工业大学土木与水利工程学院,安徽 合肥 230009 3. 合肥工业大学电子科学与应用物理学院,安徽 合肥 230009
引 言
近年来,随着社会经济的快速发展,河流湖泊的富营养化程度愈发严重,主要表现为夏季蓝藻大规模爆发,政府要花大量资金打捞蓝藻,如何实现蓝藻减量化、资源化和无害化是亟待解决的重要问题之一。 目前的解决方案是把蓝藻作为反应物消化掉,如好氧堆肥、产沼气、制备蓝藻基活性炭、生产生物塑料制品等。 这些方法虽在一定程度上缓解了蓝藻的处置难题,但存在被动消化、附加值不高、经济效益低等问题。
巢湖蓝藻体内有丰富的藻胆蛋白,高纯度的藻胆蛋白具有良好的抗衰老性、抗癌性和荧光免疫性等[1]。 提取与纯化高纯度藻胆蛋白既能实现主动消化、高附加值资源化的目的,又可以推动进一步对藻胆蛋白特性的研究[2]。 紫外-可见吸收光谱法已被证明可以在提取纯化藻胆蛋白过程中发挥重要作用。 这是由于藻胆蛋白(藻红蛋白、藻蓝蛋白、别藻蓝蛋白)在紫外-可见波段(200~700 nm)除了具有一般的蛋白吸收峰(280 nm)外,还各自具有其相应的最大特征吸收峰[3]。 如藻红蛋白在565 nm有强吸收峰,藻蓝蛋白在620 nm有强吸收峰,别藻蓝蛋白在650 nm有强吸收峰。 通过对比测试样品的吸收峰强度及位置变化,即可定性定量比较测试样品的各组分浓度差异。 紫外-可见吸收光谱法成为藻胆蛋白提取纯化过程中评价提取纯化效果强有力的表征手段。 本研究以巢湖新鲜蓝藻为实验原料,以CellufineA-500与羟基磷灰石为柱层析填料,结合两种填料对应的洗脱峰在洗脱曲线上的特点,在前人研究的基础上,充分利用藻红蛋白、藻蓝蛋白、别藻蓝蛋白与一般蛋白质的紫外-可见光谱特性的差别,研判洗脱峰组分的动态变化。 通过研究进一步掌握收集高纯度藻胆蛋白的时机,深入揭示了两种柱层析填料纯化藻胆蛋白的机理,为蓝藻高附加值资源化提供一定的理论支撑。 目前提取新鲜蓝藻的生物质及相应理论的研究尚属稀缺,因此开展的对藻胆蛋白纯化实验的光谱学分析将会为今后多维度深层次综合利用蓝藻以及研究其他提取生物质实验的理论提供一定的思路和参考。
1 实验部分
1.1 样品采集
巢湖新鲜藻泥,采自于合肥市巢湖西湖区水体距表层15 cm处。 直接打捞,经四层纱布过滤除去部分水分后,带回实验室-18 ℃冷冻保存备用。
1.2 仪器与试剂
紫外-可见分光光度计(TU-1950),北京普析通用公司; 高速冷冻离心机(KDC-160HR),安徽中科中佳科学仪器有限公司; 电子天平(FA2004N),上海民桥精密科学仪器有限公司; 恒温磁力搅拌器(85-2A),江苏金城国胜仪器厂。
常用试剂: 磷酸盐缓冲试剂(PBS),NaCl,NaOH,盐酸,(NH4)2SO4(以上试剂均为分析纯); CellufineA-500,GE公司; 羟基磷灰石(CHT-B),Biocanal公司。
1.3 工艺流程
蓝藻藻泥→反复冻融提取→过滤→离心分离制备粗提液→一步盐析→离心收集上清液→二步盐析→透析脱盐→柱层析(CellufineA-500,羟基磷灰石)分离纯化→收集洗脱组分→紫外-可见吸收光谱法分析。
1.4 表征方法
根据藻胆蛋白的紫外-可见吸收特性,使用紫外-可见吸收光谱法表征提取纯化藻胆蛋白过程中物质含量相应变化。 藻胆蛋白在紫外-可见波段(200~700 nm)除了具有一般的蛋白吸收峰(280 nm)外,还各自具有相应的最大特征吸收峰。 对洗脱曲线在不同洗脱峰下根据峰的强度、面积大小选择相应的取样点,对取样点对应的各溶液进行200~700 nm全波长扫描,得到各洗脱峰的光谱扫描变化图,以此表征分析各组分随着时间的动态变化。
2 结果与讨论
2.1 CellufineA-500分离藻胆蛋白的紫外-可见光谱分析
图1为使用CellufineA-500作为柱层析填料,用以分离藻胆蛋白的典型洗脱峰的信号图。 在加入缓冲液之后,会分别出现对应的洗脱峰。 根据不同洗脱峰的强度、面积大小选择相应的取样点。 将取样点相应的各溶液稀释后进行200 nm~700 nm全波长扫描。 由于取样点按照时间节点有序排列,故得到各洗脱峰的光谱扫描变化图,以此分析各洗脱峰的组分及其含量动态变化,如图2所示。
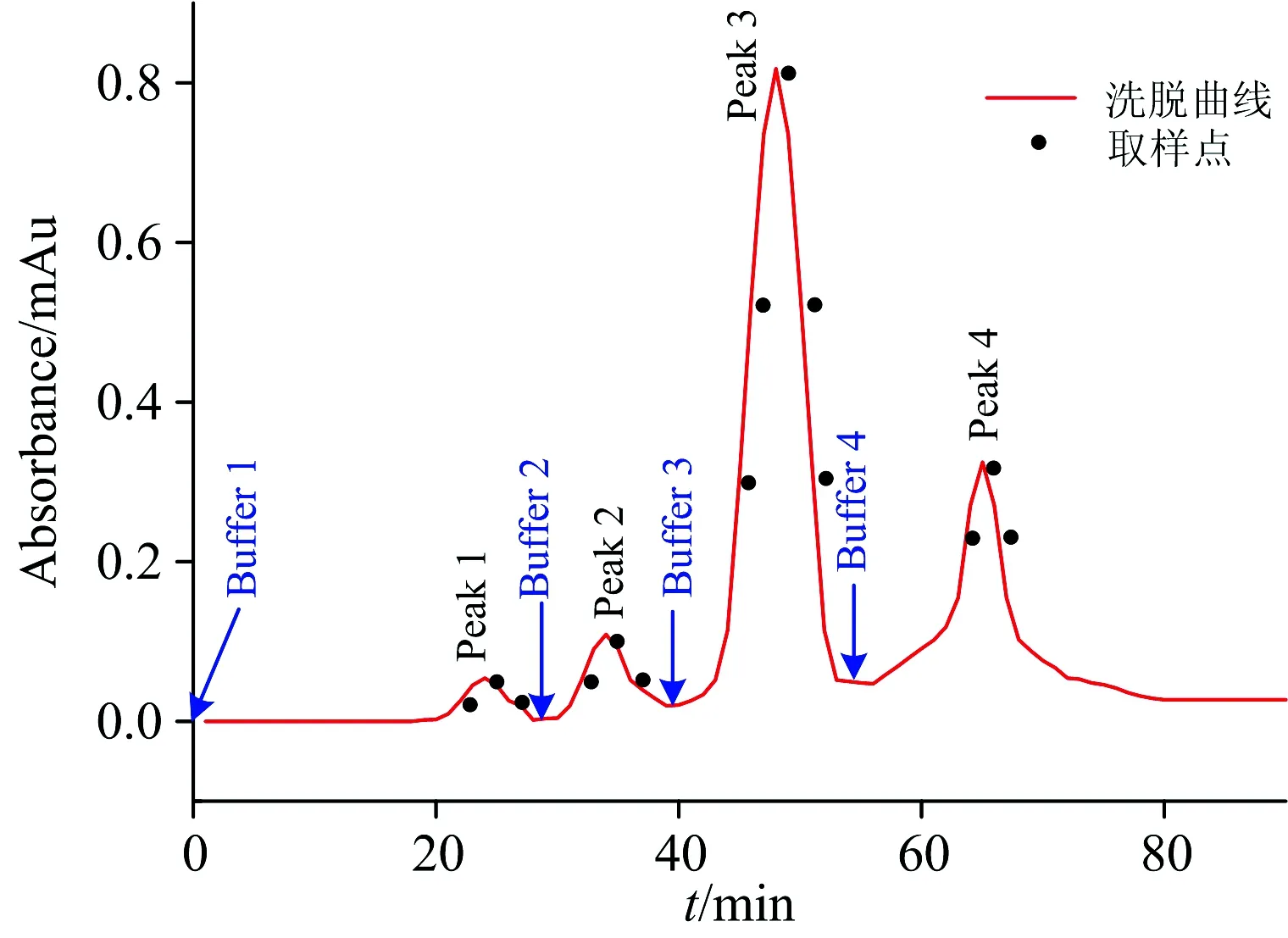
图1 Cellufine A-500分离藻胆蛋白的典型洗脱峰图
2.1.1 洗脱峰Ⅰ的紫外-可见光谱图变化分析
图2(a)为图1中Peak 1中所选取的取样点进行200~700 nm全波长扫描后所绘制的光谱图。 如图中所示,取样点A,B和C在280及414 nm均有吸收峰,这表明Peak 1所对应的物质为杂蛋白及类胡萝卜素[4],且杂蛋白的浓度较高。 由于CellufineA-500是阴离子交换填料,Buffer 1为平衡缓冲液,故洗脱下来的杂蛋白和类胡萝卜素与填料不发生吸附作用,应为阳离子或者电中性分子。 类胡萝卜素的吸收峰为414 nm,则表明类胡萝卜素的主要成分为链孢红素。 类胡萝卜素积累的前提之一是高强度的光线,对应着夏季巢湖蓝藻的大量爆发。 此外,图2(a)中浓度关系为: B>A>C,对应着图1中Peak 1取样点B的峰值。
2.1.2 洗脱峰Ⅱ的紫外-可见光谱图变化分析
图2(b)为图1中Peak 2中所选取的取样点进行200~700 nm全波长扫描后所绘制的光谱图。 如图中所示,取样点A,B和C除了在268 nm有最大吸收峰外,在540及565 nm均有强吸收峰,这表明Peak 2所对应的物质为藻红蛋白[5]、杂蛋白及部分核酸; 且由于核酸的存在,最大吸收峰波长由280 nm蓝移至268 nm处。 藻红蛋白浓度不高且难以大量富集,提取纯化价值不大,应考虑作为杂蛋白去除。 Buffer 2为添加低浓度盐的缓冲液,这表明此时去除的物质与填料发生弱吸附作用,应为带少量负电荷的物质,如核酸、藻红蛋白等,这也表明藻红蛋白的等电点高于藻蓝蛋白。 对比A,B和C三点变化趋势,可看出268 nm处的峰强度降低后,导致565 nm处的峰强度超过268 nm处,藻红蛋白的纯度略有上升,这表明核酸比藻红蛋白优先被去除。
2.1.3 洗脱峰Ⅲ的紫外-可见光谱图变化分析
图2(c)为图1中Peak 3中所选取的取样点进行200~700 nm全波长扫描后所绘制的光谱图。 如图中所示,取样点A,B,C,D和E除了在277 nm有强吸收峰外,在620 nm有最大吸收峰以及358 nm有副吸收峰,与图3中藻蓝蛋白标准光谱图中典型的最大吸收峰(620 nm处)和蛋白质吸收峰(277 nm处)一致,表明Peak3所对应的物质为高纯度藻蓝蛋白; 对比A,B,C,D和E取样点的变化趋势,可看出620 nm处的峰强度先上升然后保持稳定最后下降,这表明藻蓝蛋白的浓度先上升后下降,且在C点处达到最大。 B,C和D点藻蓝蛋白纯度均超过4.0,这表明B点到D点为高纯度藻蓝蛋白的最佳收集段; 但B点纯度最高,达到4.26,与浓度变化略有不同。 为了探究其中缘由,在Peak 3出峰时间(43~53 min)间隔半分钟测藻蓝蛋白与别藻蓝蛋白相对含量,如图4所示。
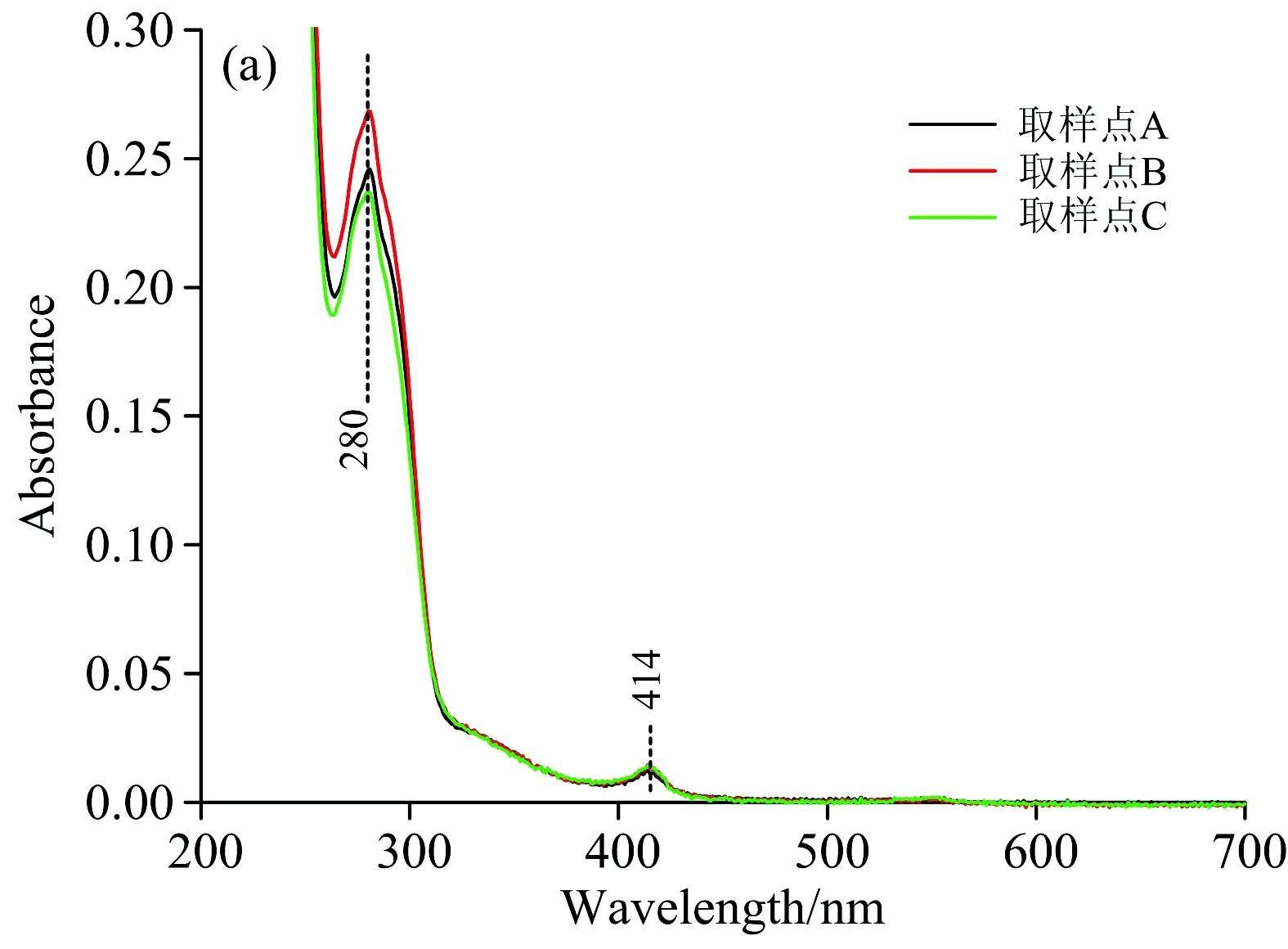
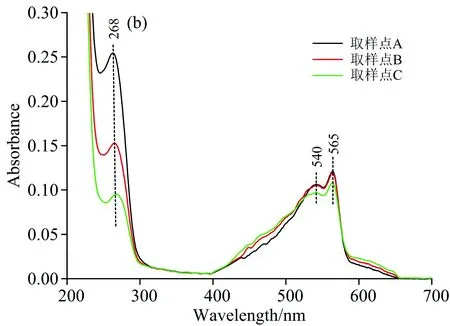
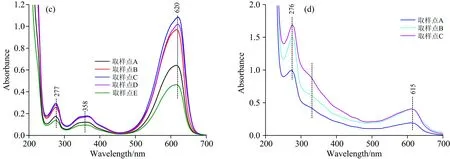
图2 各洗脱峰取样点的紫外-可见吸收光谱变化图
图4中藻蓝蛋白的相对含量先上升后下降,最高达到95.2%,且相对集中分布于前半段,这表明藻蓝蛋白与别藻蓝蛋白未能完全分离,从而制约了藻蓝蛋白纯度的进一步提高。 由于Buffer 3的离子强度进一步提升,非吸附作用特别强的组分均会被洗脱下来,故藻蓝蛋白与别藻蓝蛋白应带有较多负电荷,且数量接近。 由于藻蓝蛋白与别藻蓝蛋白的浓度比约为2∶1, 故藻蓝蛋白会相对集中的被分离出,但不能完全排除别藻蓝蛋白的干扰。
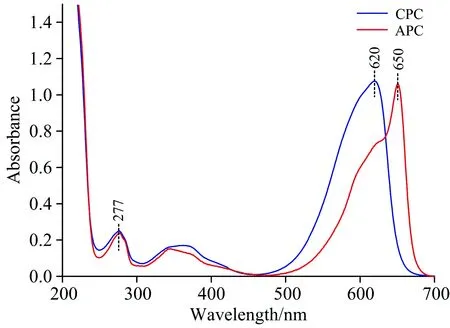
图3 藻蓝蛋白与别藻蓝蛋白的标准光谱图
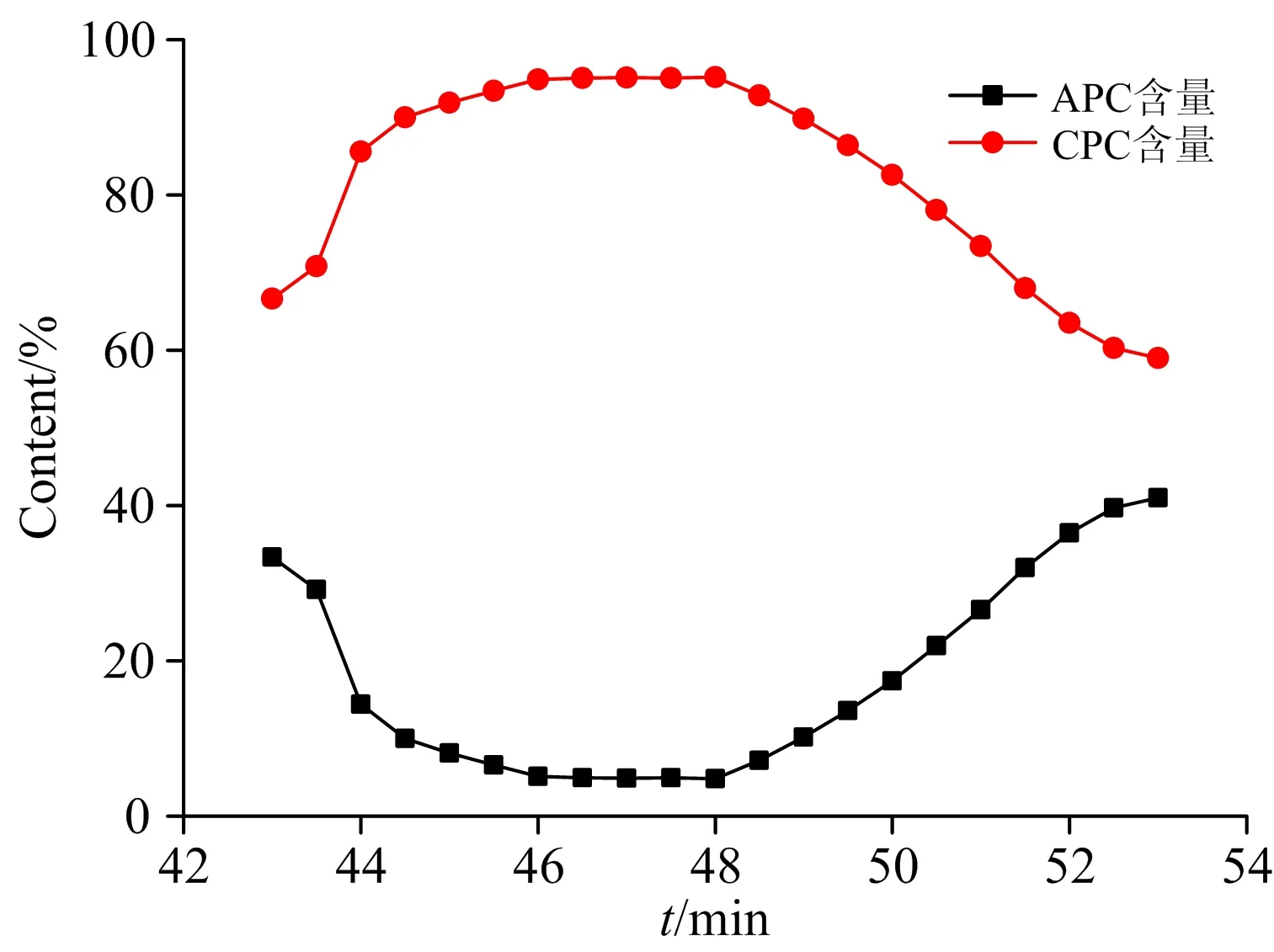
图4 Ⅲ峰藻蓝蛋白与别藻蓝蛋白相对含量变化图
2.1.4 洗脱峰Ⅳ的紫外-可见光谱图变化分析
图2(d)为图1中Peak 4中所选取的取样点进行200~700 nm全波长扫描后所绘制的光谱扫描图。 如图中所示,取样点A,B和C除了在276 nm有最大吸收峰外,还在615 nm有强吸收峰,这表明Peak4所对应的物质为杂蛋白及低纯度藻蓝蛋白。 由于Buffer 4的离子强度进一步升高,吸附作用强的组分一般也会被洗脱下来,此时洗脱的组分应带有大量负电荷。 对比A,B和C取样点的变化趋势,可看出藻蓝蛋白吸收峰波长由620 nm蓝移至615 nm处,而276 nm处吸收峰的强度增加。 这表明低纯度藻蓝蛋白先于杂蛋白被洗脱,这可能是由于这部分杂蛋白等电点更低、带有更多负电荷所导致。
2.2 羟基磷灰石分离藻胆蛋白的紫外-可见光谱分析
图5为使用羟基磷灰石作为柱层析填料,用以分离藻胆蛋白的典型洗脱峰的信号图。 如图5在加入缓冲液之后,会分别出现对应的洗脱峰。 根据不同洗脱峰的强度、面积大小选择相应的取样点。 然后将取样点相应的各溶液稀释后进行200~700 nm全波长扫描。 由于取样点按照时间节点有序排列,故得到各洗脱峰的光谱扫描变化图,以此分析各洗脱峰的组分及其含量动态变化,如图5所示。
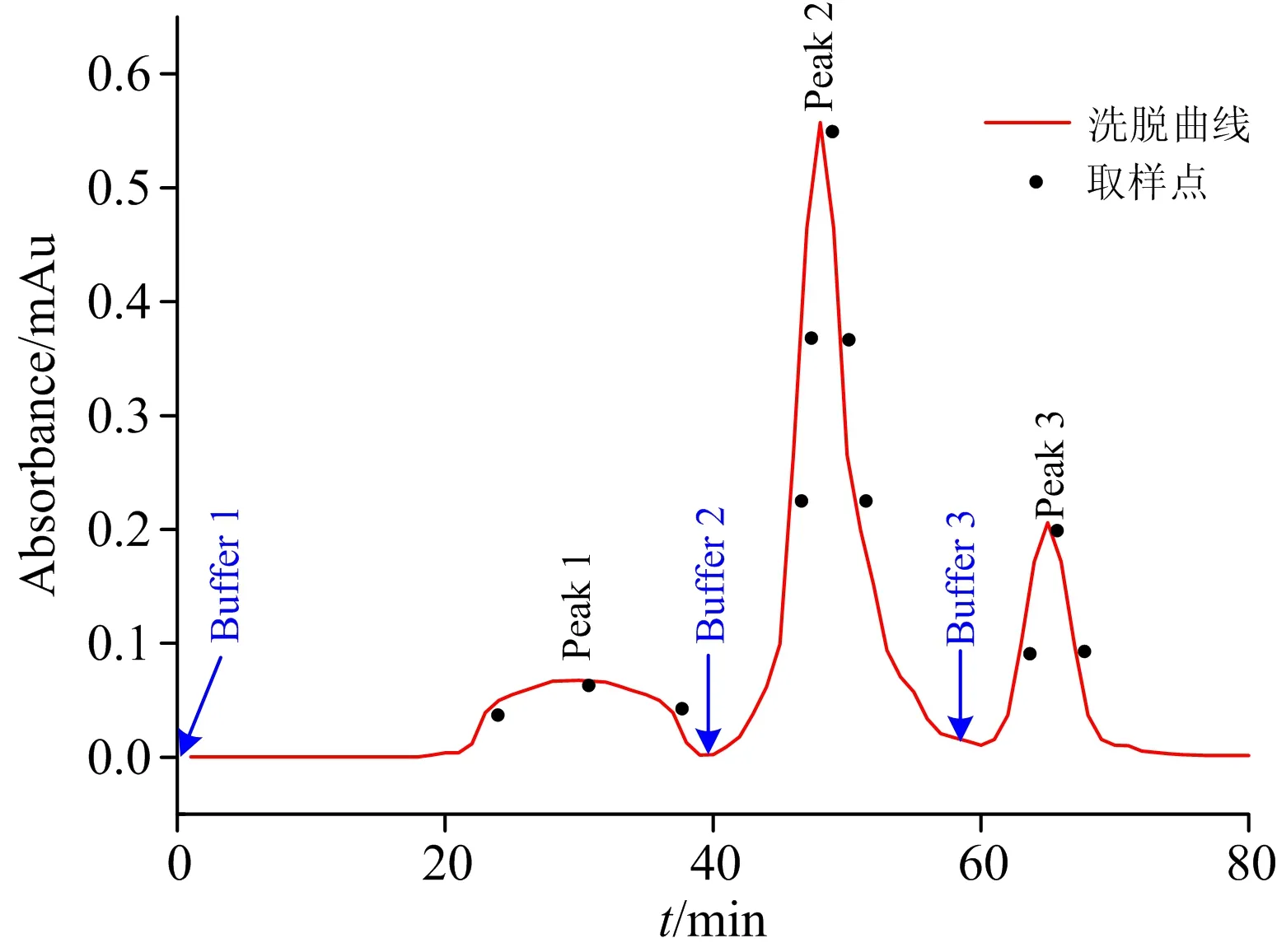
图5 羟基磷灰石分离藻胆蛋白的典型洗脱峰图
2.2.1 洗脱峰Ⅰ的紫外-可见光谱图变化分析
图6(a)为图5中Peak 1中所选取的取样点进行200~700 nm全波长扫描光谱图。 如图中所示,取样点A,B和C在260 nm(272 nm)处均有最大吸收峰,在414,540及565 nm均有吸收峰,表明Peak 1所对应的物质为杂蛋白、核酸、少量类胡萝卜素和藻红蛋白,且杂蛋白与核酸的含量较高。 由于羟基磷灰石是金属螯合亲和填料,Buffer 1为平衡缓冲液,故洗脱下来的杂蛋白、核酸、藻红蛋白和类胡萝卜素与填料不发生螯合反应,应为碱性蛋白质或正离子。 此外,图6(a)中B点260,540与565 nm峰的强度均高于A与C点,这表明在B点处藻红蛋白与核酸浓度高于两边,对应着图5中Peak 1取样点B峰值。
2.2.2 洗脱峰Ⅱ的紫外-可见光谱图变化分析
图6(b)为图5中Peak 2中所选取的取样点进行200~700 nm全波长扫描的光谱图。 如图中所示,取样点A,B,C,D和E在620 nm(615 nm)处均有最大吸收峰,在278及358 nm均有吸收峰,与图3中藻蓝蛋白标准谱图中典型的最大吸收峰和蛋白质吸收峰一致,这表明Peak 2所对应的物质为高纯度藻蓝蛋白。 由于Buffer 2增加了磷酸盐缓冲液浓度,故会竞争性地置换结合蛋白质,使与钙离子形成较弱配位键的组分发生解吸反应。 因此,藻蓝蛋白应为酸性蛋白质,与钙离子可发生较弱的螯合反应。 此外,图6(b)中A和E两点最大吸收峰为615 nm处,这可能是由于A和E两点尚存在少量杂蛋白; 随着纯度的增加,最大吸收峰逐渐红移至620 nm处。 到C点时纯度最高,可达4.62,高于CellufineA-500柱纯化的藻蓝蛋白,为了探究其中缘由,在Peak 2出峰时间(44~55 min)间隔半分钟测藻蓝蛋白与别藻蓝蛋白相对含量,如图7所示。
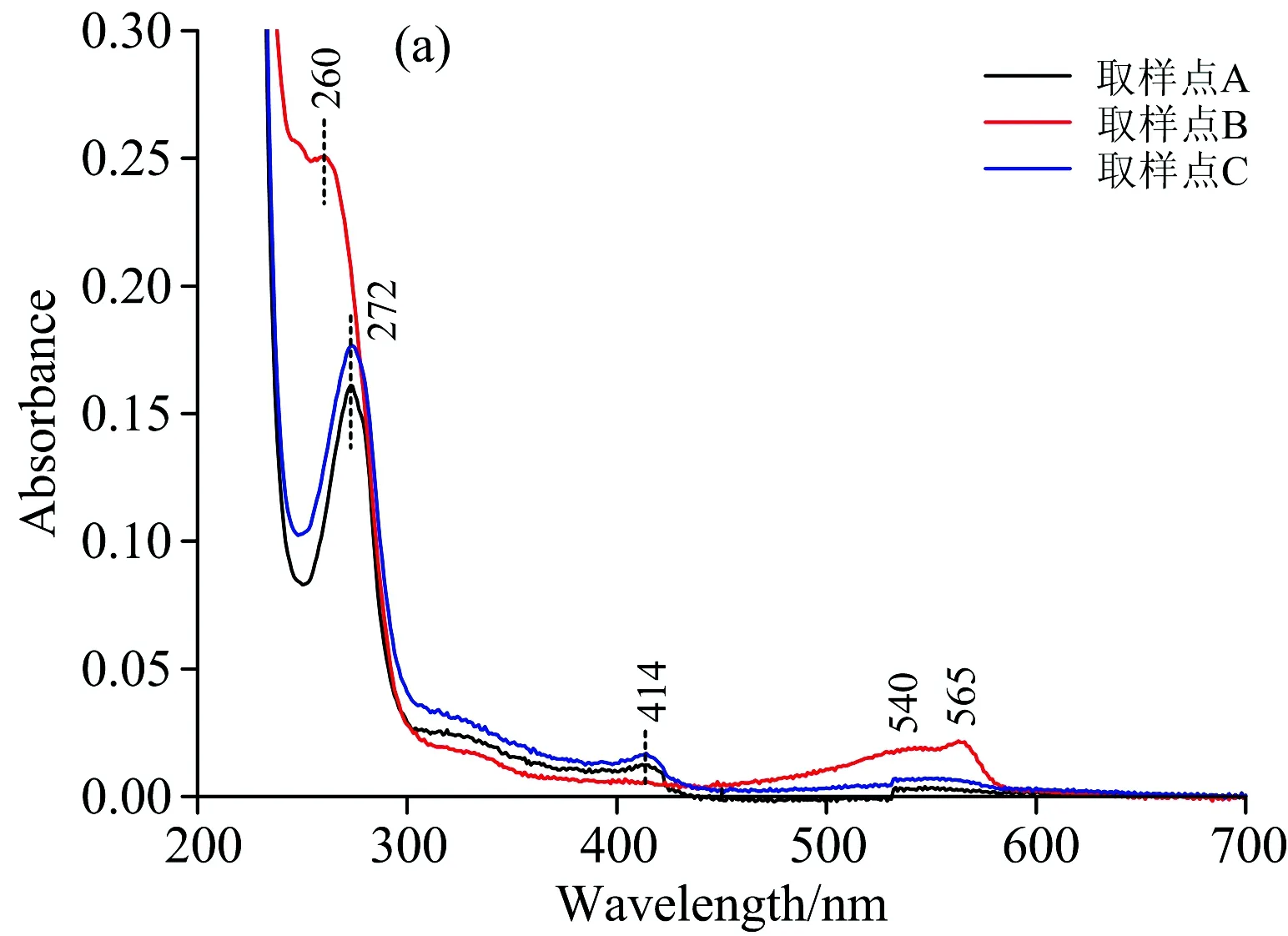
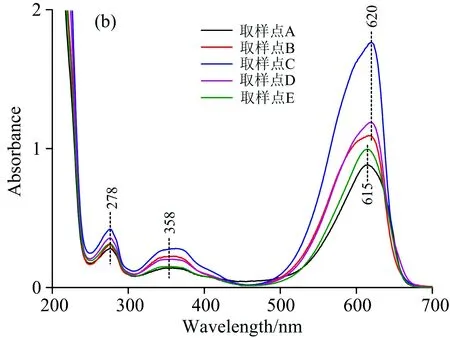
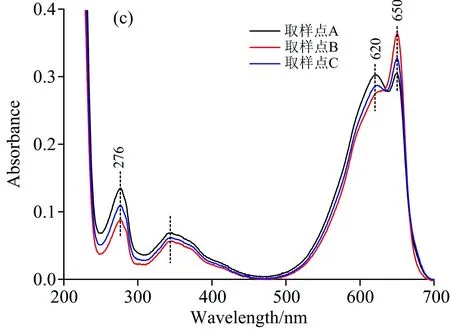
图6 各洗脱峰取样点的紫外-可见吸收光谱变化图
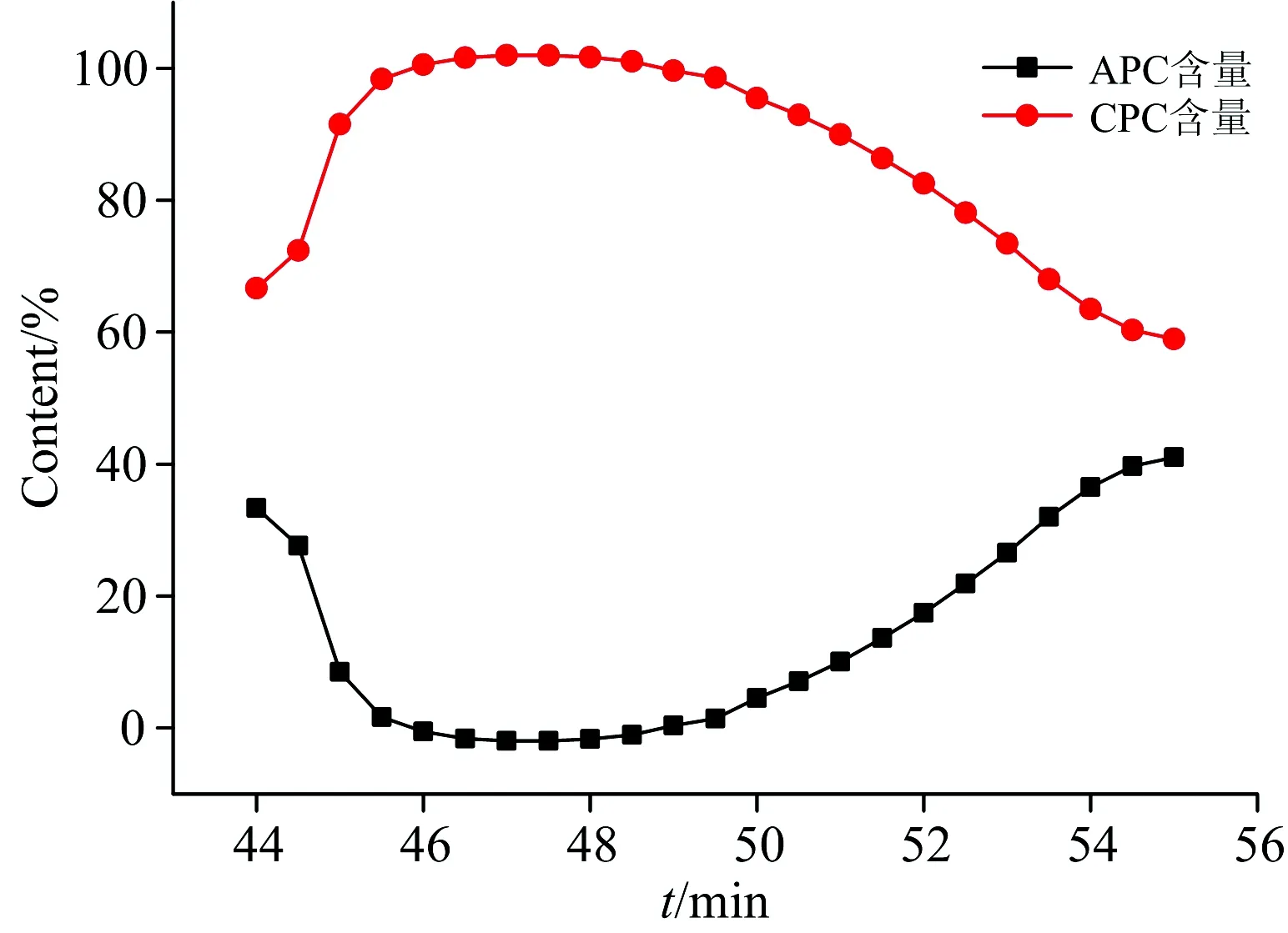
图7 Ⅱ峰藻蓝蛋白与别藻蓝蛋白相对含量变化图
图7中藻蓝蛋白的相对含量先上升后下降,最高达到100%,且于46~50 min内均可以保持,表明这段时间内藻蓝蛋白与别藻蓝蛋白能够完全分离,从而较大程度上提高了藻蓝蛋白的纯度。 分析认为由于配位键的存在,使得金属螯合亲和色谱的特异性高于阴阳离子交换色谱,因此羟基磷灰石的纯化分辨率大于CellufineA-500,故能完全分离藻蓝蛋白和别藻蓝蛋白。
2.2.3 洗脱峰Ⅲ的紫外-可见光谱图变化分析
图6(c)为图5中Peak 3中所选取的取样点进行200~700 nm全波长扫描后所绘制的光谱图。 如图中所示,取样点A,B和C在650与620 nm处有显著吸收峰,在276 nm处有相应蛋白吸收峰,与图3中别藻蓝蛋白标准谱图中典型的最大吸收峰(650 nm处)和蛋白质吸收峰一致,这表明Peak 3所对应的物质为别藻蓝蛋白与少量藻蓝蛋白。 由于Buffer 3进一步增加了磷酸盐缓冲液浓度,故会竞争性地置换结合蛋白质,显著降低柱容量,使与钙离子形成较强配位键的组分也发生解吸反应。 因此,别藻蓝蛋白应为酸性蛋白质,与钙离子可发生较强的螯合反应,配位键强度大于藻蓝蛋白与钙离子生成的配位键。 此外,图6中A和C两点在620 nm处均有强吸收峰,而非B点处的副吸收峰,这可能是由于藻蓝蛋白与别藻蓝蛋白的浓度比约为2∶1,故A和C处两点尚存在少量藻蓝蛋白,使得在620 nm处的吸收峰强度增加; 随着纯度的增加,620 nm处的吸收峰强度逐渐下降,而650 nm处的吸收峰强度逐渐上升。 到B点时纯度最高,可达4.33,而CellufineA-500却无法达到这种分离效果,这是由于二者纯化机理不同所导致的。
3 结 论
CellufineA-500填料能够有效地将藻红蛋白、核酸、类胡萝卜素与杂蛋白从藻胆蛋白初步纯化液中去除,最终获得纯度为4.2的试剂级藻蓝蛋白,但不能完全分离藻蓝蛋白和别藻蓝蛋白; 羟基磷灰石填料不仅能够有效地将藻红蛋白、核酸、类胡萝卜素与杂蛋白从藻胆蛋白初步纯化液中去除,还能够有效分离藻蓝蛋白和别藻蓝蛋白,同时获得试剂级藻蓝蛋白和试剂级别藻蓝蛋白。
运用紫外-可见吸收光谱变化图逐一分析各洗脱峰,能够有效鉴别各洗脱峰的组分和分离变化过程,动态演绎了两种柱层析填料分离杂质、纯化藻蓝蛋白和别藻蓝蛋白的过程,阐明了两种柱层析填料的作用机理。 本工作对藻胆蛋白纯化实验的光谱学分析将会为今后多维度深层次综合利用蓝藻以及研究其他提取生物质实验的理论提供一定的思路和参考。
