控制变量思想在化学习题解答中的应用
2020-05-07姚明站
姚明站
(江苏省苏州市高新区第一中学 215009)
在科学研究和问题解决时,对影响事物变化规律的条件或因素加以人为控制,只改变某个变量(即实验变量),而保证其它的变量(即无关变量)不变,以便在研究过程中,找到事物变化发展的规律,最终解决所研究问题的方法称为控制变量法.控制变量法的模型可用如图1来表示:
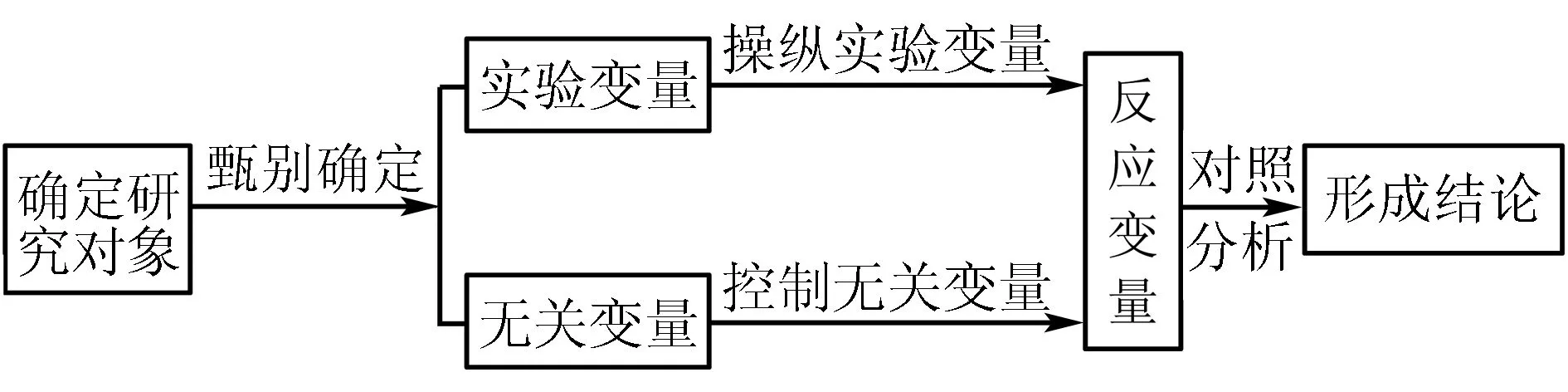
图1
一、化学平衡图像题解答中的应用
例1(2018·北京高考第27题)近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储.过程如图2所示.
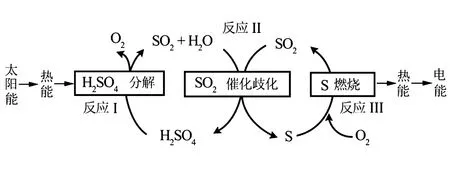
图2
(1)反应Ⅰ:

ΔH1=+551kJ·mol-1
反应Ⅲ:

ΔH3=-297kJ·mol-1
反应Ⅱ的热化学方程式:____.
(2)对反应Ⅱ,在某一投料比时,两种压强下,H2SO4在平衡体系中物质的量分数随温度的变化关系如图3所示.p2____p1(填“>”或“<”),得出该结论的理由是____.
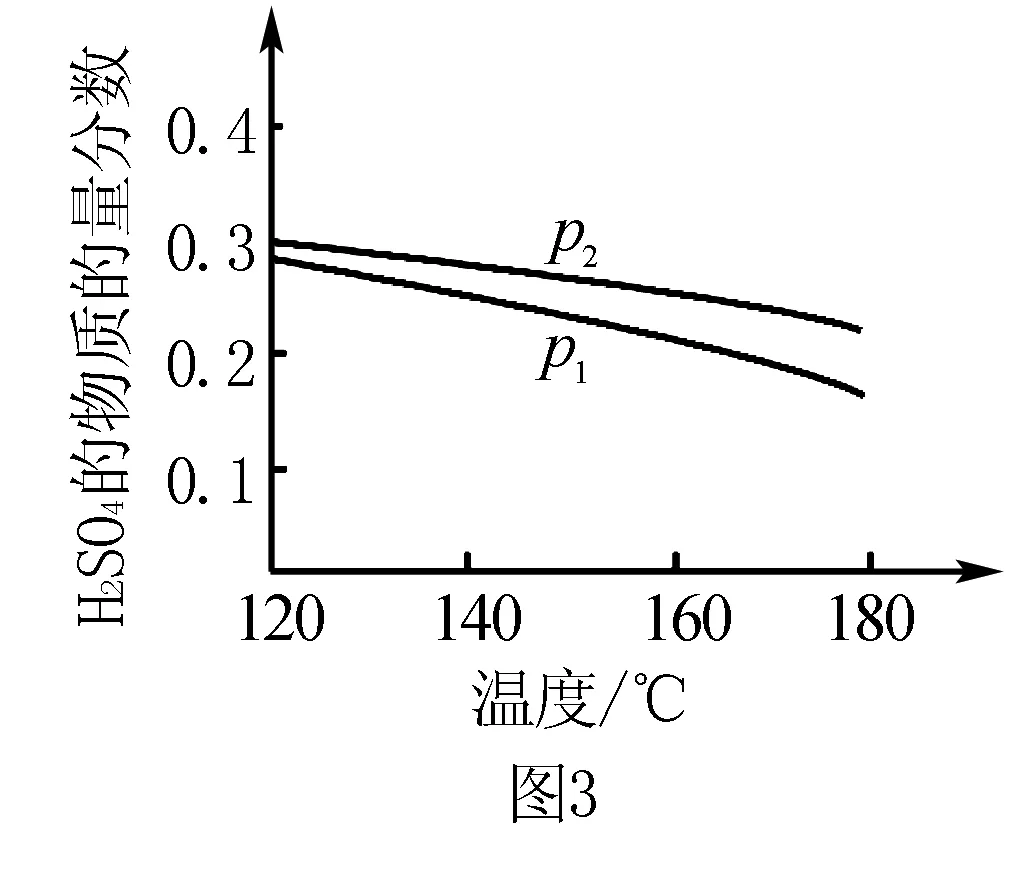
图3
解析根据盖斯定律写出反应2的热化学方程式为
3SO2(g)+2H2O(g)=2H2SO4(l)+S(s)
ΔH=-254 kJ·mol-1
第(2)问在此基础上,由已知图像研究压强与H2SO4物质的量分数因果关系的问题.而图像则给出了温度、压强两个因素对H2SO4物质的量分数的影响曲线,由控制变量法规则,可采用“定一议二”法分析解答,即控制温度(无关变量)相同时,分析压强(实验变量)与H2SO4物质的量分数(反应变量)的因果关系.对横坐标作辅助线(即等温线),根据勒夏特列原理,增大压强平衡正向移动,H2SO4物质的量分数增大可知,p2>p1.
小结:分析多个因素对化学反应平衡(速率)的影响时,注意“求同存异”,确定相同的因素,研究某一因素的不同所导致的结果的变化,从而得到相应的结论.
二、化学实验题解答中的应用
例2(2018·北京高考第27题)题干前半部分同例1.
(3)I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下.将ⅱ补充完整.


(4)探究ⅰ、ⅱ反应速率与SO2歧化反应速率的关系,实验见表1.分别将18 mL SO2饱和溶液加入到2mL下列试剂中,密闭放置观察现象.(已知:I2易溶解在KI溶液中)
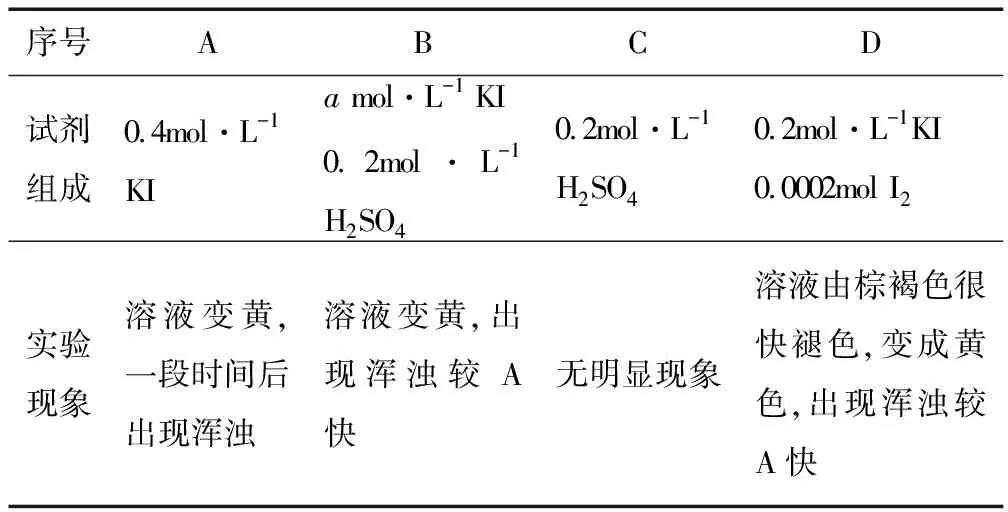
表1
①B是A的对比实验,则a=____.
②比较A、B、C,可得出的结论是____.
③实验表明,SO2的歧化反应速率D>A,结合ⅰ、ⅱ反应速率解释原因:____.
解析第(4)问是探究ⅰ、ⅱ反应速率与SO2歧化反应速率的关系,而两个反应中反应物和生成物众多,也就是影响反应速率的因素众多,需要通过控制变量法,只改变其中一个条件而其它条件不变来研究.
①B是A的对比实验,采用控制变量法,B比A多加了0.2mol·L-1H2SO4,A与B中KI浓度应相等,则a=0.4.
②对比A与B,加入H+可以加快SO2歧化反应的速率;对比B与C,单独H+不能催化SO2的歧化反应;比较A、B、C,可得出的结论是:I-是SO2歧化反应的催化剂,H+单独存在时不具有催化作用,但H+可以加快歧化反应速率.
③对比D和A,D中加入KI的浓度小于A,D中多加了I2,反应ⅰ消耗H+和I-,反应ⅱ中消耗I2,D中“溶液由棕褐色很快褪色,变成黄色,出现浑浊较A快”,反应速率D>A,由此可见,反应ⅱ比反应ⅰ速率快,反应ⅱ产生H+使c(H+)增大,从而反应ⅰ加快.
小结:探究类化学实验试题的解题策略如下:
(1)确定变量:解答这类题目时首先要认真审题,理清影响实验探究结果的因素有哪些.
(2)定多变一:在探究时,应该先确定其他的因素不变(无关变量),只变化一种因素(实验变量),看这种因素与探究的问题(反应变量)存在怎样的关系;这样确定一种以后,再确定另一种,通过分析每种因素与所探究问题之间的关系,得出所有影响因素与所探究问题之间的关系.
(3)数据有效:解答时注意选择数据(或设置实验)要有效,且变量统一,否则无法做出正确判断.证明一个问题时,为了防止干扰,一般都需要做对比试验、空白试验.
三、平衡综合题解答中的应用
化学平衡类题中,经常会遇到两个或几个平衡体系进行对比分析的试题,究其本质是几个因素对同一反应平衡移动影响的问题研究,一般是先引入“等效平衡”的概念,再利用“等效平衡”思想进行分析解决问题,但引入的新概念晦涩难懂,教的煞费苦心,学生往往不领情.笔者认为,可以从控制变量的角度借助思维导图来分析指导这类题的解答.
例3(2016·江苏高考)一定温度下,在3个体积均为1.0L的恒容密闭容器中反应:

达到平衡(见表2).下列说法正确的是( ).
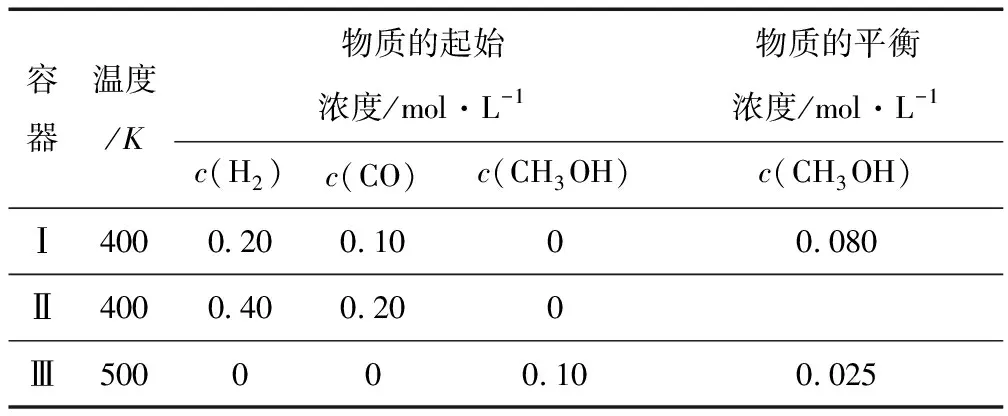
表2
A.该反应的正反应放热
B.达到平衡时,容器Ⅰ中反应物转化率比容器Ⅱ中的大
C.达到平衡时,容器Ⅱ中c(H2)大于容器Ⅲ中c(H2)的两倍
D.达到平衡时,容器Ⅲ中的正反应速率比容器Ⅰ中的大
解析引导学生分析时绘制思维导图如图4所示.

图4
由A、D两项设问可知,须对Ⅰ、Ⅲ两容器进行对比分析.Ⅰ与Ⅲ起始量不同且温度不同,变量较多,不能进行直接比较,可采用控制变量法进行分析对比.如图4所示,容器Ⅲ(从逆反应开始)与容器Ⅲ′(从正反应开始),起始状态不同,但两者的投入量相当,可以建立完全相同的平衡体系,比较Ⅰ、Ⅲ就变成了比较Ⅰ和Ⅲ′,由容器Ⅰ转化为容器Ⅲ′只需要改变温度一个变量.因平衡时甲醇的浓度:Ⅰ>Ⅲ,且温度:Ⅰ<Ⅲ,即升高温度平衡逆向移动,该反应正向为放热反应,A正确;当其他条件不变时,升高温度反应速率加快,达到平衡时,容器Ⅲ中的正反应速率比容器Ⅰ中的大,D正确.
同理,Ⅰ、Ⅱ两容器进行对比时,温度相同,气体物质的量和压强均增大,可假想一个“中间状态”容器Ⅰ′,其体积是Ⅰ的2倍,充入起始物质亦是Ⅰ的2倍,这时Ⅰ与Ⅰ′达平衡时反应物转化率、c(H2)相同,由Ⅰ′转化为Ⅱ只需要增大压强一个变量,平衡压强平衡正向移动,达到平衡时,容器Ⅰ中反应物转化率比容器Ⅱ中的小,B错误;Ⅱ与Ⅲ变量更多不能直接进行比较,若以Ⅰ作为参照控制变量即可进行比较.由B项的分析可知,Ⅱ中c(H2)小于Ⅰ中c(H2)的2倍,而Ⅲ和Ⅰ对比,平衡逆向移动,Ⅲ比Ⅰ中c(H2)大,故达到平衡时,容器Ⅱ中c(H2)小于容器Ⅲ中c(H2)的2倍,C错误.
小结:解答此类题时可利用“等效平衡”思想,假想一个“中间状态”,以达控制变量的目的.“中间状态”的构建要利用缩放思想,该方法适用于起始投入物质的物质的量之间存在一定的倍数关系的平衡体系.它指的是将反应容器的体积扩大(或缩小)一定的倍数,使起始物质的浓度相同,则在一定条件下,可建立相同的平衡态.然后在此基础上进行加压或减压(实验变量只剩压强),使其还原为原来的浓度,依据勒夏特列原理分析在改变压强过程中,平衡移动方向,得知相关量的变化规律.
四、同分异构体数目判断中的应用
例4(2016·新课标Ⅱ卷)分子式为C4H8Cl2的有机物共有(不含立体异构)( ).
A.7种 B.8种 C.9种 D.10种
解析判断取代产物同分异构体数目,其分析方法是分析有机物的结构特点,确定不同位置的氢原子种数,再确定取代产物同分异构体数目.分子式为C4H8Cl2的有机物可看成是丁烷C4H10中的2个氢原子被2个氯原子取代,涉及等效氢、氯原子、氯原子位置三个变量,如若采用控制变量思想——“定多移一”,可快速有序地判断,否则极易漏写或多写.
分析如下:
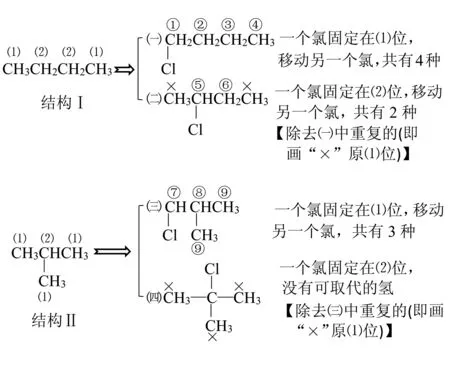
确定二氯丁烷的同分异构体数目,可先固定一个氯原子位置,再移动另一个氯原子位置,特别需要注意不要重复——可归纳为“定一移一,莫回头”(两个取代基相同,须“莫回头”).
