晚期卵巢上皮性癌行脾切除术的安全性及可行性分析
2020-05-07赵卫东吴大保
卫 莹 赵卫东 朱 靖 周 颖 申 震 吴大保
卵巢上皮性癌(卵巢癌)是威胁女性健康的主要恶性肿瘤之一。2018年,大约有22 2401例新发的卵巢癌患者,其中约75%的患者在确诊时已处于晚期,即国际妇产科联盟分(international federation of gynecology and obstetrics ,FIGO)分期 IIIC和IV期。大量前瞻性临床试验及回顾性研究[1-2]均表明,满意的减瘤手术(术后残留灶直径≤ 1 cm)可以显著提高患者的生存率,术后残余病灶的大小是影响预后的独立及重要因素之一。上腹部手术是晚期卵巢癌减瘤手术的重点及难点,约80%不能满意减瘤的患者为上腹部病灶困难切除。根据美国最新国立综合癌症网络卵巢-输卵管-腹膜癌指南,为实现满意的肿瘤细胞减灭,可以考虑切除肿瘤累及的相关腹部器官,包括脾切除术。近年来,卵巢癌脾转移的检出率逐渐提高,这类患者的诊治已经引起了妇科肿瘤医师的重视。本研究旨在分析脾切除术在晚期卵巢癌患者减瘤手术中的安全性及可行性,现报道如下。
1 资料与方法
1.1 一般资料 选择2018年4月至 2019年9月在中国科学技术大学附属第一医院(安徽省立医院)行肿瘤细胞减灭术的156例晚期卵巢癌患者,将21例行脾脏切除的患者纳为研究对象,回顾性分析21例患者的基本临床资料、病理检查结果、手术情况、术后并发症、术后化疗时间及住院时间等。病理切片均经2位妇科病理医师分别复核,以确认肿瘤是否侵犯脾脏组织。
1.2 方法
1.2.1 脾切除手术 ①切除大网膜:分离粘连于横结肠的大网膜,沿横结肠上方彻底打开网膜囊,沿胃网膜血管弓下缘切除大网膜。②游离脾:分离与脾相连的脾肾韧带、脾膈韧带、脾结肠韧带、脾胃韧带,结扎胃短血管。③于胰腺后方分离出脾血管,予结扎。④于左侧膈下间隙放置1根双套管引流。
1.2.2 相关定义 ①满意的肿瘤细胞减灭术:为卵巢癌术后残留灶直径≤1 cm。②胰瘘(国际胰瘘协作组ISGPF):胰周引流管引流液增多或手术3 d后引流液中淀粉酶含量高于血清中3倍以上。A级胰瘘是生化性的,没有后遗症;没有临床影响,与延迟出院无关。B级胰瘘需要治疗干预,通常维持胰周引流,需要特殊治疗,包括部分或全部肠外营养、肠内营养、抗菌药物和生长抑素类似物。B级胰瘘通常导致延迟出院。C级胰瘘临床表现严重,常与重复手术和术后病死率有关[3]。
1.3 观察指标 术后,常规预防感染、抗凝治疗,观察、记录患者有无腹痛、发热、腹部体征、引流液颜色及性状,监测血常规、怀疑有胰瘘的患者及时行引流液淀粉酶浓度测定,必要时,行上腹部超声或CT检查。排除胰瘘的患者在进食2~3 d后逐步拔除双套管。
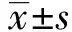
2 结果
2.1临床特征 21 例患者中,年龄30~74岁,平均(52.62±9.96)岁;术前血清糖类抗原125水平82.86~13 33 6 U/mL,中位数为1 023(385.65,4 207)U/mL;术前血清人附睾蛋白4水平79~1 874 pM,中位数为666(292,860) pM。
2.2 影像学特点 21例患者中,10例术前影像学检查提示脾区肿瘤,其中2例术前正电子发射体层摄影术检查提示脾区有肿瘤,8例CT检查提示脾区肿瘤,其他11例术前CT检查未提示脾区肿瘤。见表1。

表1 21例患者肿瘤累及情况
2.3 病理特点 按照国际妇产科联盟(FIGO,2014)年的分期标准,ⅢC期 12例,Ⅳ期9例。病理类型:21例均为高级别卵巢浆液性腺癌,其中 2 例合并肉瘤样变。术后病理:18 例提示切除的脾组织受卵巢癌细胞侵犯,其中 2 例为脾实质转移,11例为脾门部浸润,5例为脾被膜浸润,3 例脾未见转移,但网膜连接脾处见肿瘤累及。
2.4 手术情况
2.4.1 手术范围 21例患者中,16例为初次行肿瘤细胞减灭术,3例为复发卵巢癌患者行再次肿瘤细胞减灭术,2例为新辅助化疗3~4个疗程后,行中间肿瘤细胞减灭术。具体手术范围包括脾切除的子宫附件、大网膜等在内的多器官联合切除。
2.4.2 手术相关指标 21例患者,手术时间150~708 min,中位数为400(315,507.50)min,脾切除时间病历中未单独记录;腹水量0~10 000 mL,中位数为2 000(500,4 250)mL;术中出血量300~5 000 mL,中位数为1 500(1 000,2 000)mL;20 例患者均接受了输血治疗,输血量600~2 500 mL,中位数为1 300(800,1 950)mL;住院时间10~52 d,平均(28.29±11.45)d;术后初次化疗距手术时间7~37 d,平均(17.33±9.10)d。
2.5 术后病变残留情况 19例行初次及再次肿瘤细胞减灭术的患者通过脾切除及切除其他部位肿瘤,均获得了满意的肿瘤细胞减灭术,其中,无肉眼残留灶10 例;残留灶直径<1 cm 9例,分布于小肠系膜、肠管表面及胸腔内。2例中间型肿瘤细胞减灭术患者术后亦无肉眼残存病灶。
2.6 术后并发症及处理 21例患者中,4例(19.05%)发生胰瘘,均经保守治疗(禁食、补液、生长抑素等治疗)治愈,其中1例因脾门巨大肿块(约6 cm)压迫胰尾部,无明显界限导致胰瘘,术后出现胃底瘘;1例术后因胆囊动脉出血再次进腹止血;11例出现一侧或双侧胸腔积液,4例诊断为肺部感染,经抗感染治疗后好转;3例出现腹腔感染,感染主要细菌为大肠埃希菌;2例发生肺栓塞,经抗凝等治疗后好转;7例出现消化道瘘,其中1例因行全结肠切除,术后出现吻合口瘘,经冲洗、禁食、补液、抑酸抑酶等保守治疗后痊愈,1例因膈肌手术导致的十二指肠瘘行手术修补,保守治疗后好转。21例患者术后均出现血小板升高,最高者达1 197×109/L,20例患者出现血白细胞升高,最高达28.83×109/L,除部分患者合并肺部感染或腹腔感染者予以抗感染治疗外,均无特殊治疗,并恢复正常。
3 讨论
卵巢癌患者因缺乏有效的筛查手段,在确诊时多为晚期。脾脏因其特殊的解剖特点,在上腹部转移中较多见,其受累及主要分为实质性、脾门和被膜的累及[4]。脾实质转移越来越受到妇科肿瘤专家的重视,根据2014年发布的 FIGO 分期,脾实质转移已划分为IVB期。除了脾实质外,脾门转移也是影响预后的重要因素,与较短的生存期相关[4-5]。
卵巢癌手术中行脾切除的主要原因与脾转移、脾周浸润和术中损伤等有关[6],因手术技术的提高,现术中损伤已很少见。本研究中,脾切除率为 13.5%,与国外研究[7]结果(14%)基本一致,均为术中探查发现肿瘤累及脾脏而行手术切除。术后病理中,脾门累及较多见(11 例),脾被膜浸润 5 例,脾实质转移2 例,另外 3 例,术后病理虽未见脾转移,但网膜连接脾脏处见肿瘤累及,且病灶较大,肉眼上难以区分界限,此情况下,为达满意减瘤,仍建议行脾切除。事实上,卵巢癌脾脏转移可能比估计的更为普遍。既往有尸检研究[8]发现,卵巢癌患者脾脏转移率高达20%。因此,脾脏切除不应在仅有脾实质转移时才进行,脾门或巨大的网膜转移肿瘤,或脾被膜转移难以单独切除时就必须要切除脾脏,从而达到满意的肿瘤细胞减灭术。
在追求满意减瘤的同时,同时需权衡患者的手术耐受能力及发生各类并发症的可能[9]。胰瘘被认为是脾切除术后伴或不伴远端胰腺切除术的主要并发症,直接决定脾切除术后的并发症发生率,合并远端胰腺切除后胰瘘的发生率明显增高[10-11]。本研究21例患者中,有4例(19.05%)出现B级胰瘘,无一例C级胰瘘。对于胰瘘的处理,首选保守治疗,包括禁食、胃肠外营养、生长抑素、持续有效引流及冲洗等,一般待引流量减少,且引流液淀粉酶结果正常后,方可进食,观察引流无异常后,拔除引流管,但这种方法治疗时间较长,患者无法及时化疗,影响患者预后。本研究中,3例胰瘘患者在保守治疗后,监测引流液淀粉酶浓度持续下降,无感染等其他合并症情况下适量进食,无异常且淀粉酶无明显增高可拔除引流管行化疗。3例胰瘘患者均保守治疗成功,并及时完成化疗,恢复良好,此种方法值得推荐。胰瘘并发胃底瘘,国内外报道极少,本研究1例胰瘘并发胃底瘘,考虑系引流不畅导致胰液长期外渗至胃底。国内研究[12]报道胃底瘘可能系胃左血管处理不当,影响血供造成,因病例数少,有待进一步研究。避免遗漏的关键在于熟悉解剖,术中注意胰尾的保护,如需行远端胰腺切除,有效的结扎主胰管,术后引流管的在位及引流通畅等。除胰瘘外,几乎所有患者出现血小板增多和白细胞增多,无一例出现严重性的脾切除后感染。除胸部或腹部感染外,余未行特殊干预后均恢复正常。本研究结果表明,脾切除术后并发症通过适当的防治措施是可控的,不会延误患者术后化疗。
因此,无论是初次还是再次肿瘤细胞减灭术,术前充分评估,术中仔细探查,对于脾脏受累的患者,能耐受手术,只要能达到满意的减瘤术,就应行脾切除术,术后规范化管理,及时发现并治疗并发症,让脾切除术不再成为卵巢癌满意减瘤手术的障碍。
