秦巴山区魔芋白绢病病原菌的鉴定及生物学特性的测定
2020-05-07崔月贞郝兴顺魏芳勤张春辉王晓娥陈永刚蒙天竣
崔月贞,郝兴顺*,魏芳勤,张春辉,王晓娥,陈永刚,蒙天竣,李 旭
(1.陕西省汉中市农业科学研究所,陕西 汉中 723000;2.甘肃省庆阳市西峰区农业技术推广中心,甘肃 庆阳 745000)
魔芋为多年生草本植物,因富含葡甘露聚糖,故其具有重要的药用和保健功效,成为重要的经济作物之一[1],在国内外市场潜力巨大,具有广阔的开发应用前景[2]。随着魔芋生产规模的扩大、企业数量的增加和产业链的延伸,魔芋产业成为云南、贵州和陕西等地农民脱贫致富奔小康和地方财政增收的骨干经济项目[3-4]。
陕西省秦巴山区为我国最大的魔芋主产区域之一,而汉中位于秦巴腹地,该地海拔约500 m,属亚热带湿润季风性气候,年降水量800~1000 mm,年均气温约14 ℃,土壤疏松肥沃,适宜魔芋半野生生活习性,是大力发展绿色、无公害魔芋产业的天然理想场所[5-6]。但是,近年来随着秦巴山区魔芋种植面积的不断扩大,重茬严重,导致土传性病害严重发生,特别是魔芋白绢病持续加重,造成魔芋减产20%~40%[7],且一直呈上升趋势,严重影响了病魔芋产量和经济效益,成为制约秦巴山区魔芋生产发展和产业化开发的主要因素之一[8]。目前,关于湖北、云南和贵州等地区的魔芋白绢病原菌生物学特性、分类地位和药剂防治等均有相关研究[9-10],而关于秦巴汉中魔芋白绢病的研究较少。因此,本研究拟对分离自秦巴汉中魔芋白绢病病原菌进行形态观察及16 S rDNA序列鉴定,并对其进行生物学特性测定,以期为秦巴山区该病害的诊断和综合防治提供依据。
1 材料与方法
1.1 供试材料
供试魔芋病样于2018年采自陕西汉中种子魔芋种植区。供试培养基为马铃薯琼脂培养基(PDA)。供试魔芋苗为盆栽条件下1年龄的繁育苗,品种为花魔芋(Amorphophalluskonjac)。
1.2 试验方法
1.2.1 病原菌的分离与致病性测定 采用常规组织分离法,选取具有症状典型的新鲜魔芋标本,从病斑、病健交界处用刀片切取约0.5 cm2的病组织块,75%乙醇消毒10 s,然后0.1%的升汞消毒1 min,再用无菌水清洗3次后置于平板上培养,对分离物进行纯化培养和4 ℃保存备用。
致病性测定:采用致伤接种法,将魔芋种子播种于直径25 cm的塑料花盆中,在温度为20~30 ℃的室内培育植株至4叶时,选用健康长势均匀的魔芋植株,用消毒后的昆虫针在茎基部制造微伤口,将分离物在PDA培养基上培养5 d后打成直径6 mm的菌饼接种于伤口处,以无菌平板培养基为对照,保湿48 h,室温培养,3次重复,连续观察魔芋植株发病情况并记录数据。出现典型症状后对发病植株进行再分离,按照柯赫氏法则[11]确定病原菌。
1.2.2 病原菌的形态学和16 S rDNA-ITS序列分析鉴定 病原菌的形态学鉴定:将菌株接于PDA培养基上25 ℃培养10~15 d观察菌丝和菌核,并在显微镜下拍照[12]。
16 S rDNA-ITS 序列分析:提取病原菌基因组DNA,将病原菌接种于PDA液体培养基,于27 ℃、180 r/min摇床振荡培养5~6 d后收集菌丝,称取0.1 g至研钵,加入0.3 mL 10%(w/v)的Chelex-100无菌溶液,充分研磨后,转移至1.5 mL离心管,在旋涡混合器上振荡5 s后沸水浴10 min ,冷却至室温后12000 r/min离心10 min,取上清液可作为PCR扩增模板,或-20 ℃保存备用。扩增引物为ITS1和ITS4,扩增条件为:95 ℃预变性5 min,95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸8 min,30个循环;最后在72 ℃下延伸10 min,终止反应。50 μL扩增反应体系:2×Power Taq Mixture 25.0 μL,ITS1和ITS4(10 μmol/L)各2.0 μL,DNA模板 2.0 μL,ddH2O 19.0 μL,0.8%凝胶电泳检测。将具有特异性条带的扩增产物送至北京华大基因生物有限公司进行测序,将测序结果在GenBank数据库中进行比对并构建系统发育树,确定该病原菌的分类学地位。
1.2.3 生物学特性测定 将病原菌分别置于不同温度、pH值、碳源和氮源条件下培养,测量菌落直径,具体方法参考文献[13]。
1.2.4 数据分析 采用Clustal X 1.8 和Mega 4.0 软件构建系统发育树,采用SPSS 19.0软件进行数据分析,采用Excel 2010制图。
2 结果与分析
2.1 田间症状
田间发病初期,魔芋茎基部出现水渍状病斑,且呈不规则下陷,可在病斑周围土壤中长出放射状的白色菌丝,病斑渐渐呈浅褐色腐烂流水,后期深褐色组织逐渐软腐下陷,引起植株倒苗死亡。
2.2 病原菌的分离及致病性测定
选取多个具有典型症状的病斑进行分离培养,共得到3株真菌分离物,依次编号为M1、M2和M3,对其进行致病性测定,用针刺接种法分别回接到健康魔芋植株上,5~6 d后,M3开始发病,症状与田间症状一致,对照无症状(图1)。根据柯赫氏法则,从病斑处再次分离病原物并接种测定,确定菌株M3为魔芋白绢病致病菌,并对其进行后续研究。
2.3 病原菌的形态学鉴定
病原菌M3在PDA平板上25 ℃培养4 d后,菌落近圆形,初为白色放射状菌丝发达,背面呈淡浅黄色,5 d后开始形成菌索,初为浅黄色,渐渐形成菜籽状菌核,直径为1.2~2.3 mm,颜色逐渐加深,至茶褐色,具有蘑菇气味。电子显微镜下,菌丝具有隔膜,多在分支处(图2)。
2.4 基于rDNA-ITS序列的系统发育学分析
提取病原菌M3的基因组DNA,经PCR扩增和测序,获得rDNA-ITS序列为553 bp,所测序列在GenBank中进行同源序列比对,下载相似性99%以上的序列,经过多重序列比较后,构建了系统发育树,菌株M3与罗耳阿太菌Atheliarolfsii(KY640625.1)序列相似性为100%,且发育树聚在一起(图3),结合形态学特征,进一步鉴定病原菌M3为罗耳阿太菌Atheliarolfsii。

图1 魔芋白绢病症状及致病性测定
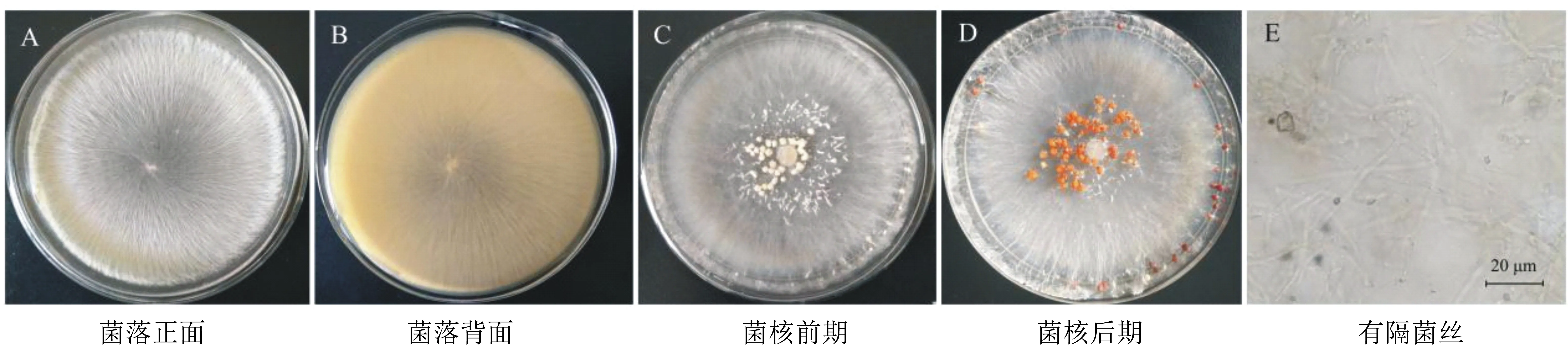
图2 病原菌M3形态特征
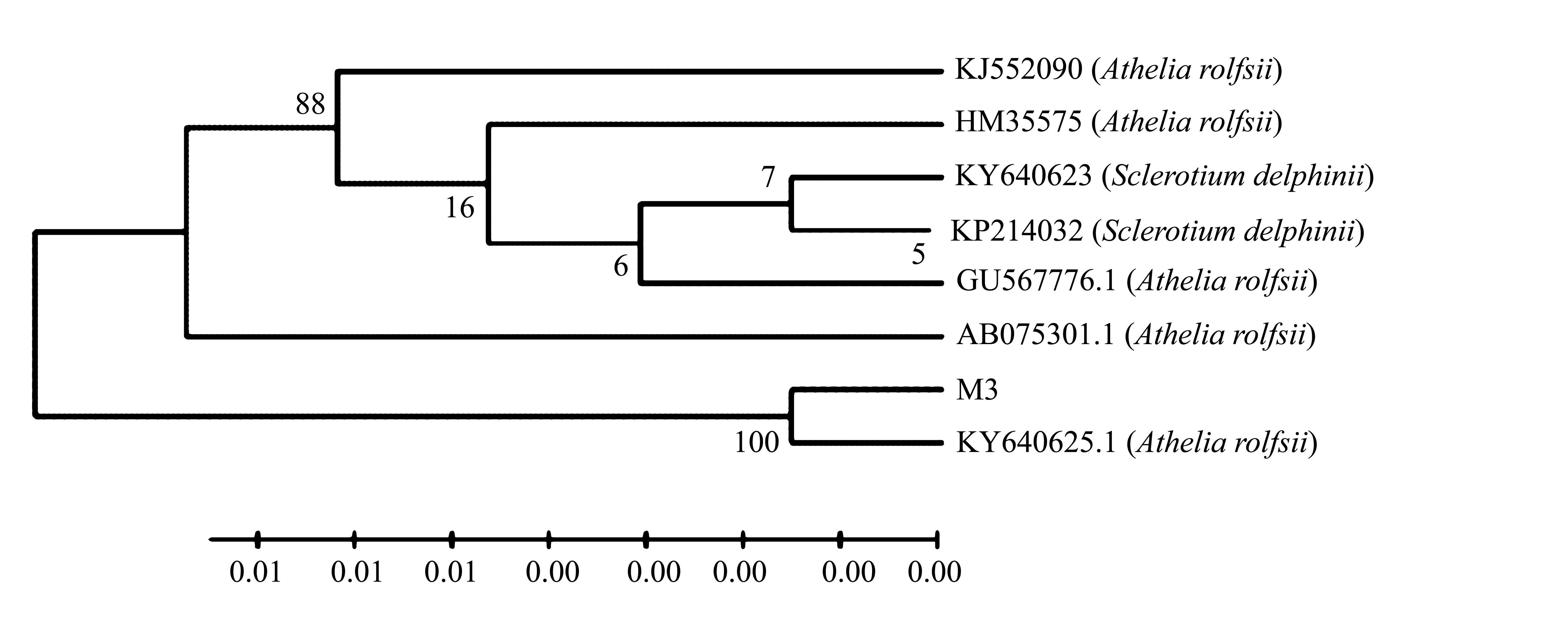
图3 病原菌M3系统发育树
2.5 病原菌的生物学特性
2.5.1 不同温度对病原菌菌丝生长的影响 病原菌M3的生长温度为8~36 ℃,5~28 ℃时病原菌随着温度的升高,生长速度不断加快,28 ℃时达到最大值,菌落平均直径达8.49 cm,28 ℃以后菌落生长显著下降(P<0.05)。由此可知,病原菌M3的最适生长温度为26~28 ℃(图4)。
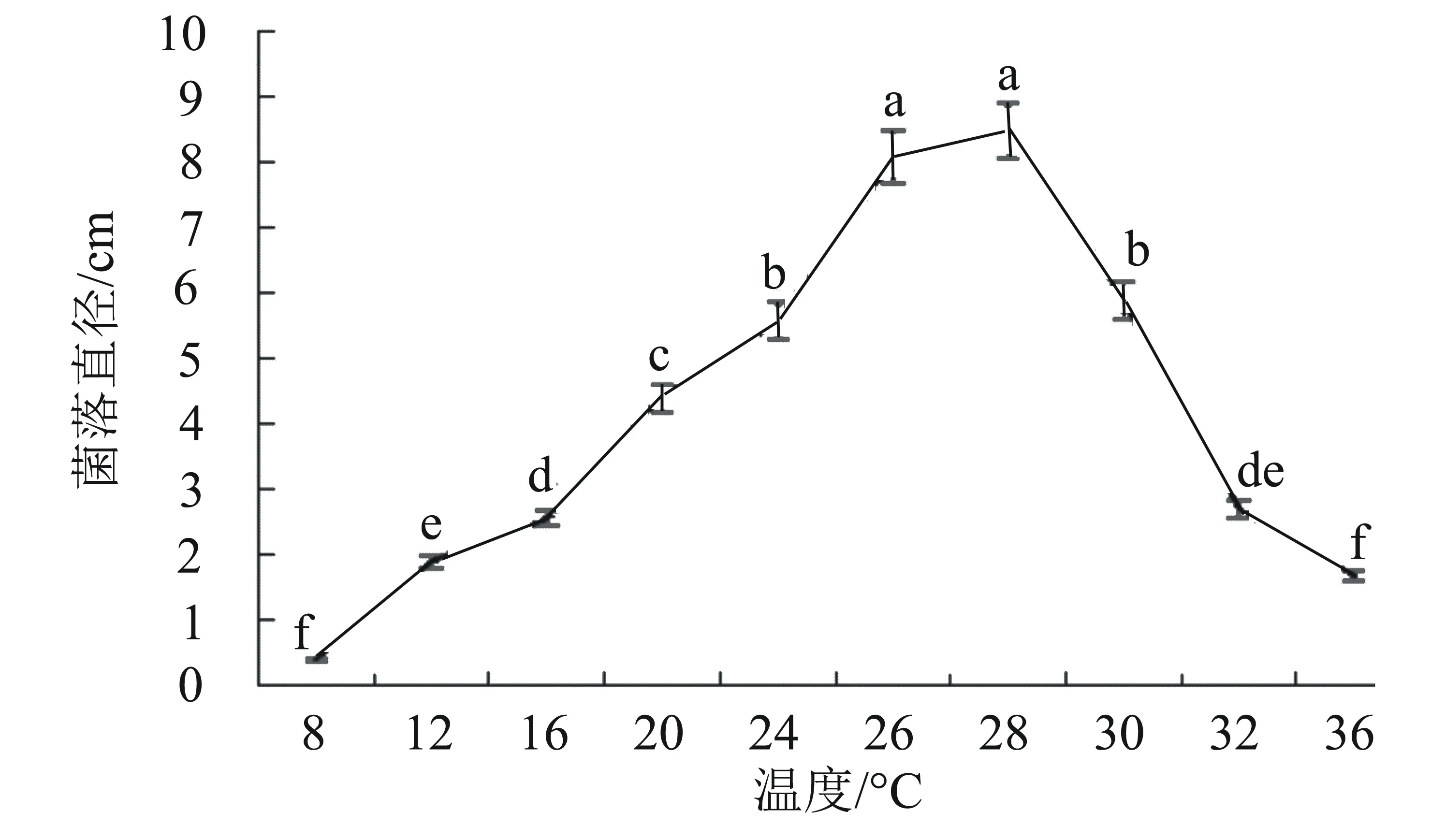
图4 温度对菌株M3菌丝生长的影响
2.5.2 不同pH值对病原菌菌丝生长的影响 病原菌M3在pH值为4~11的培养基上均可生长,菌落直径在pH=7时最大,其次为pH=8,菌落直径分别为7.65 cm和7.51 cm,显著大于其他pH值的培养基(图5)。

图5 不同pH值对菌株M3菌丝生长的影响
2.5.3 不同碳源对病原菌菌丝生长的影响 病原菌M3的最适碳源为麦芽糖,菌落生长速度最快,直径达8.28 cm,显著大于其他处理;其次为麦芽糖和蔗糖,菌落直径分别为7.33 cm和7.24 cm,两者之间差异不显著(P>0.05);其他碳源对病原菌生长影响的顺序为果糖>糊精>可溶性淀粉>乳糖,其中果糖和糊精之间差异不显著(P>0.05)(图6)。
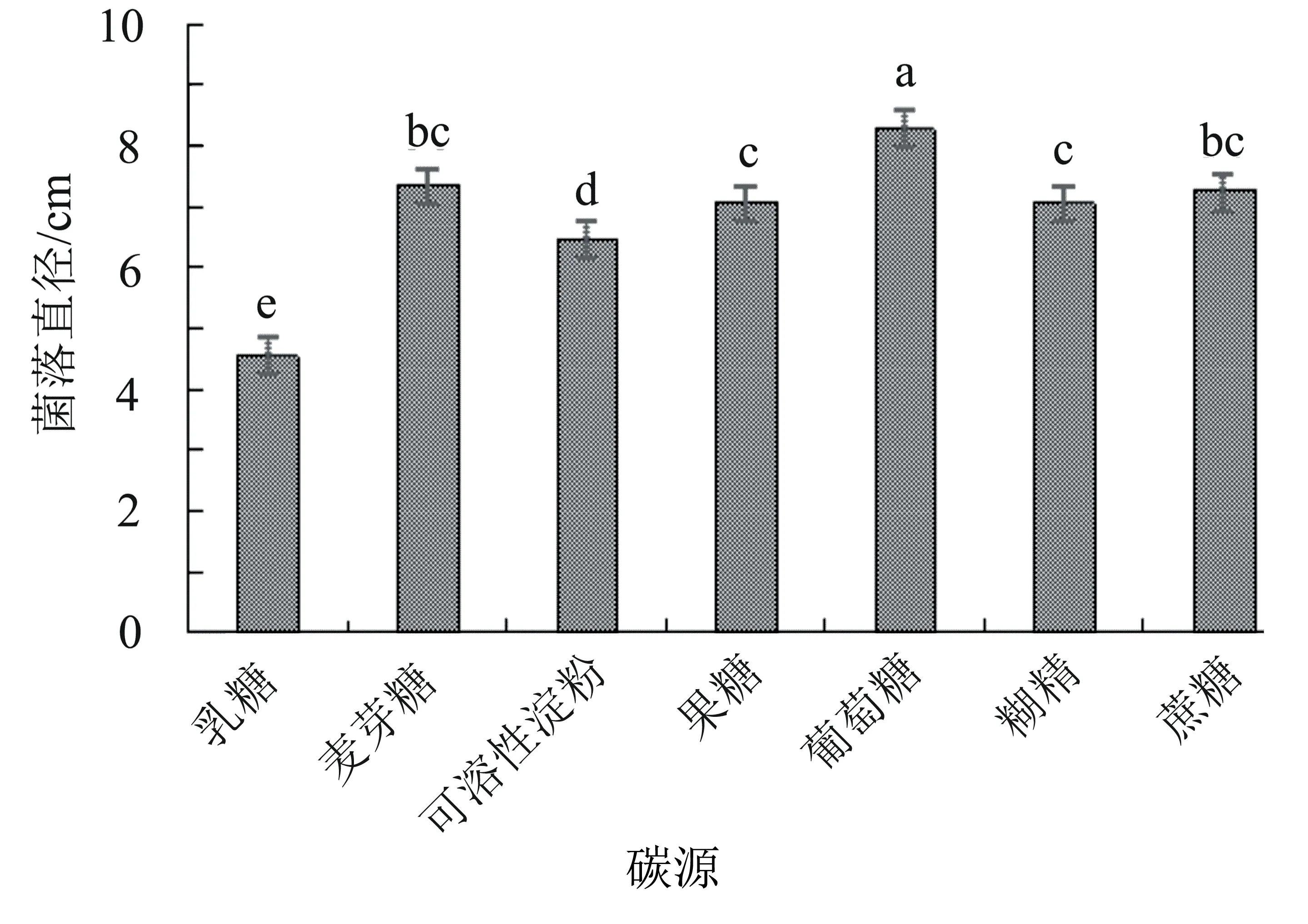
图6 碳源对菌株M3菌丝生长的影响
2.5.4 不同氮源对病原菌菌丝生长的影响 病原菌M3的最适氮源为酵母粉,菌落直径达7.09 cm,显著大于其他处理(P<0.05);其次为蛋白胨和硫酸铵,菌落直径分别为5.85 cm和5.81 cm,两者之间差异不显著;其他碳源对菌落生长影响的顺序为牛肉膏>硝酸钾>硝酸铵,其中牛肉汁和硝酸钾之间差异不显著(图7)。
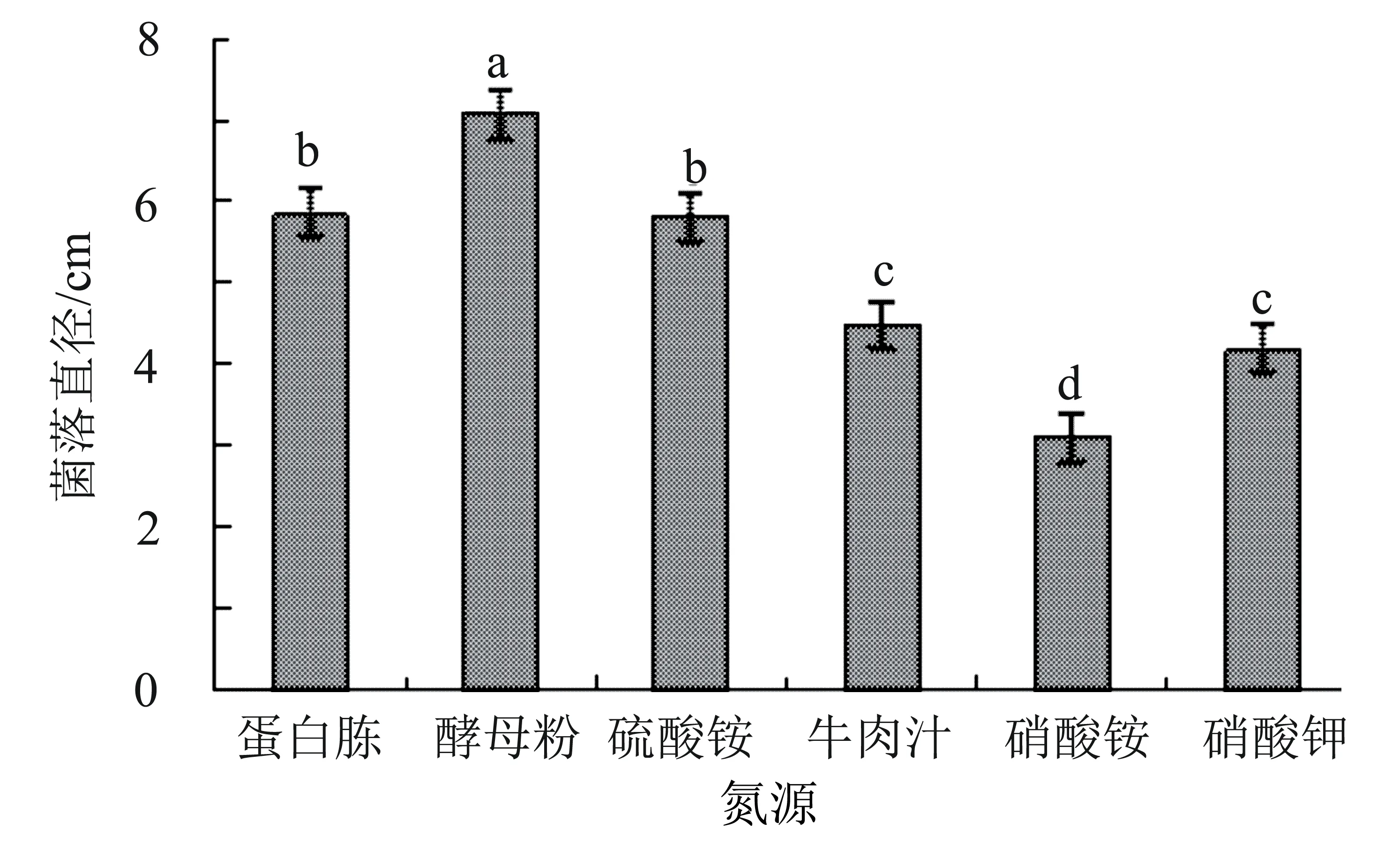
图7 氮源对菌株M3菌丝生长的影响
3 讨论
在植物病原菌分类和鉴定应用中,传统鉴定方法与基因组DNA序列分析的结合,可极大提高植物病原物种类鉴定的准确性[14],因此本研究结合形态学观察和16 S rDNA-ITS序列分析,将菌株M3鉴定为罗耳阿太菌Atheliarolfsii,属于半知菌亚门,其无性态为齐整小核菌Sclerotiumrolfsii[15],与胡红杏[16]、李利军[17]等的研究结果一致,这表明云南、湖北和陕西等地分离获得的病原菌为同一分类地位的菌株,暂时还未发现新的生理小种,但多位学者分离获得的均为无性态Atheliarolfsii、为何不易分离到有性态齐整小核菌,原因还有待进一步探究。
本研究发现,白绢病病原菌最适生长pH值为7,碳源利用以麦芽糖最好、乳糖最差,氮源利用以酵母粉最好、硝酸铵最差,这与已报道的湖北该菌最适pH值为4~5,最适碳源为可溶性淀粉,最适氮源为硝酸铵的结果[16]不一致,这可能与地域差异或菌株自身适应性有关,但具体原因还有待一步分析。陕西安康白绢病病原菌最适生长温度为30 ℃,最佳pH值为7[17],这与本研究结果基本一致,原因可能在于安康和汉中同为秦巴山区病原菌生物学特性相似。
严凯[18]和廖文月[19]等选用传统化学农药代森锰锌、氯溴异氰尿酸和甲基硫茵灵等对魔芋白绢病进行了防效试验,但近年来农业部大力推进化肥农药双减,积极探索资源节约、环境友好的现代农业发展之路[20],而现代生物农药即微生物农药、植物源农药、抗生素类农药和农药增效剂成为必然选择,因此,下一步有必要对魔芋白绢病进行现代生物农药的筛选应用。
4 结论
本文通过形态学鉴定和16 S rDNA-ITS序列分析鉴定,菌株M3为半知菌亚门罗耳阿太菌Atheliarolfsii,科学准确地鉴定了秦巴山区魔芋白绢病病原菌的分离地位。并明确了菌株M3的最适生长温度为28 ℃、最适pH值为8、最适碳源为麦芽糖、最适氮源为酵母粉等生物学特性,这为该病害的绿色防控和综合治理提供了科学依据。
