新烟碱类杀虫剂对非靶标生物毒性效应的研究进展
2020-05-06张琪赵成卢晓霞于波黄钰婷
张琪,赵成,卢晓霞,于波,黄钰婷
地表过程分析与模拟教育部重点实验室,北京大学城市与环境学院,北京100871
新烟碱类杀虫剂(neonicotinoid insecticides)是全球范围内最重要的一类杀虫剂,自20世纪90年代上市后市场份额逐年攀升,2009—2016年期间销售额的年复合增长率达3.2%,2016年该类杀虫剂的销售额为30亿美元,占杀虫剂销售额的18.2%,占全球农药市场的5.3%[1]。目前市场上广泛使用的新烟碱类杀虫剂主要有7种,根据化学结构可分为3类,即N-硝基胍类(吡虫啉、噻虫嗪、噻虫胺和呋虫胺)、N-氰基脒类(啶虫脒、噻虫啉)和硝基亚甲基类(烯啶虫胺)[2],如图1所示。吡虫啉(IMI)是新烟碱类杀虫剂中第一个成功商业化的产品,上市于20世纪90年代初,烯啶虫胺(NIT)、啶虫脒(ACE)和噻虫嗪(TMX)上市于20世纪90年代中期,而噻虫啉(THC)、噻虫胺(CLO)和呋虫胺(DIN)上市于21世纪初。根据2016年的销售数据,排名前三的杀虫剂分别为噻虫嗪(10.6亿)、吡虫啉(10.2亿)和噻虫胺(3.8亿)[1]。吡虫啉上市早,是新烟碱类杀虫剂的典型代表,曾常年占据销售榜首位,后逐渐被噻虫嗪取代[1,3]。
新烟碱类杀虫剂是与天然杀虫剂尼古丁结构相似的合成化合物,其靶向作用于昆虫中枢神经系统的烟碱型乙酰胆碱受体(nAChRs),即由咪唑烷环中的氮原子与昆虫nAChRs的氨基酸残基相互作用,阻断受体并导致昆虫瘫痪和死亡,这一机制使得新烟碱类杀虫剂具有较高的选择性,与传统杀虫剂相比对非靶标生物毒性较低[4]。新烟碱类杀虫剂是广谱杀虫剂,对多种重要的经济作物害虫(蚜虫、粉虱、叶蝉、叶甲科昆虫、线虫、飞虱、粉蚧和植食性螨等)均具有高活性。新烟碱类杀虫剂还具有内吸性,它们可以通过植物的根部吸收而后转移到植物的叶、花和花粉中[5],该特性一方面有利于通过种子包衣的方式施用新烟碱类杀虫剂,另一方面也导致生物暴露可能性增加。
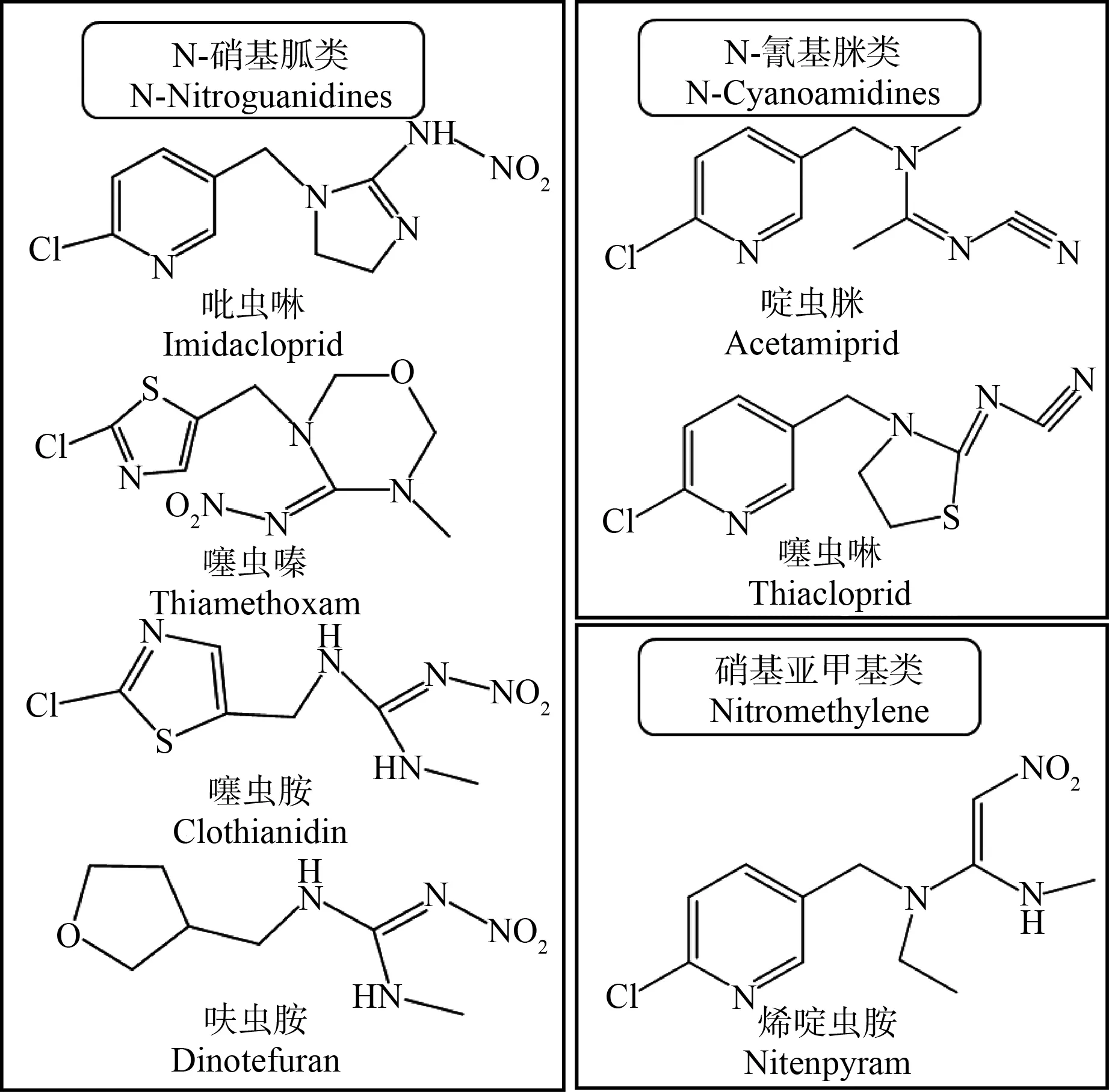
图1 7种新烟碱类杀虫剂的结构式Fig. 1 Structures of seven neonicotinoid insecticides
由于新烟碱类杀虫剂被施用后只有一小部分被作物吸收[2],其他大部分则进入土壤。它们在土壤中具有相对较长的半衰期及较高的淋溶和径流潜力,能在土壤中积累并随地表径流或渗透进入地表水和地下水中[6]。已有不少研究报道了世界各地土壤和水体中新烟碱类杀虫剂的浓度水平。Wood和Goulson[7]汇总了2013年以来美国、加拿大和欧洲部分国家农业土壤中新烟碱类杀虫剂残留的有关研究,得到吡虫啉的浓度均值范围是1.62~4.0 ng·g-1,噻虫嗪为2.4~3.46 ng·g-1,噻虫胺为2.0~13.28 ng·g-1。中国天津公园和住宅区的土壤样品中,94.3%含有至少一种新烟碱类杀虫剂,最常检出的3种为吡虫啉、啶虫脒和噻虫嗪,它们在公园的浓度均值分别为49.21、6.14和5.82 ng·g-1,在住宅区的浓度均值为19.64、2.20和2.50 ng·g-1[8]。Morrissey等[9]回顾了1998—2013年间来自9个国家的关于水体中新烟碱类杀虫剂污染水平的29项研究报告,得出地表水中新烟碱类杀虫剂浓度的几何平均值为0.13 μg·L-1,浓度峰值的几何平均值为0.63 μg·L-1。Hladik和Kolpin[10]对美国全国24个州38条河流范围的水样进行检测,发现53%的样本中至少检测到一种新烟碱类杀虫剂,最常检出的3种依次是吡虫啉(37%)、噻虫胺(24%)和噻虫嗪(21%),浓度均值分别为12.5、4.59和7.48 ng·L-1。Zhang等[11]测定了中国珠江流域3个干流(东江、北江和西江)地表水的新烟碱类杀虫剂浓度,噻虫嗪、噻虫胺、啶虫脒和吡虫啉的检出率基本接近100%,均值范围是16.6~31.0 ng·L-1。
除了环境介质,食品中也常检测到新烟碱类杀虫剂的残留。Craddock等[12]收集了在美国农业部农药数据计划中获得的1999—2015年间7种新烟碱类杀虫剂在各种食物中(包括水果、蔬菜、肉类、乳制品、谷物、蜂蜜和婴儿食品)的残留数据,发现所有食品(国内和进口)中新烟碱类杀虫剂总检出率最高的是吡虫啉,为12.0%。对于特定的食品,可观察到更高的检测率,如花椰菜中吡虫啉的检出率达57.5%,樱桃中啶虫脒的检出率为45.9%。苹果、芹菜和樱桃中至少有5%的样品检测出2种或多种新烟碱类杀虫剂的残留。蔬菜水果中新烟碱类杀虫剂浓度均值范围为0.1~5.4 μg·kg-1。Lu等[13]和谭颖等[14]分别研究了中国杭州和北京当地蔬菜水果样品中新烟碱类杀虫剂的残留。杭州样品中吡虫啉和噻虫嗪的检出率分别为66%和51%,浓度均值分别为3.09 和2.63 μg·kg-1。北京样品中吡虫啉和啶虫脒的检出率达100%,浓度均值分别为0.98 和1.39 μg·kg-1。
新烟碱类杀虫剂在环境介质和食品中的残留对生态系统和人体健康构成威胁。近年来,越来越多的研究关注新烟碱类杀虫剂对非靶标生物的生态毒理效应。目前已发现新烟碱类杀虫剂对水生生物、非靶标昆虫、鸟类、哺乳动物以及人类都具有一定毒性。本文通过汇总现有文献,按照物种分类综述了新烟碱类杀虫剂对非靶标生物的毒性效应,并提出研究中亟待解决的问题,以期为新烟碱类杀虫剂的风险评估和合理施用提供科学依据。
1 新烟碱类杀虫剂对水生生物的毒性效应(Toxic effects of neonicotinoid insecticides on aquatic organisms)
新烟碱类杀虫剂对不同种类的水生生物毒性差别较大,可达几个数量级[9]。Finnegan等[15]研究了噻虫嗪对水生生物的急性和慢性毒性,研究对象包括6种水生植物、24种水生无脊椎动物(昆虫、软体动物和甲壳动物)和5种鱼类,观察到水生植物和鱼类是急性毒性测试中不敏感的生物,在所有情况下急性半数致死浓度(LC50)和半数效应浓度(EC50)均≥80 mg·L-1,远远超过地表水暴露浓度。对于无脊椎动物,昆虫最敏感,大多数急性EC50值<1 mg·L-1,部分甲壳类动物(如栉水虱)表现出与昆虫相似的敏感性。慢性毒性测试中最敏感的是摇蚊幼虫,其无观察效应浓度(NOEC)为0.013 mg·L-1。在Morrissey等[9]的综述中,对甲壳类动物的急性毒性而言,吡虫啉和噻虫啉毒性最高,噻虫嗪和呋虫胺最低;在所评估的物种中,鳞翅目、毛翅目和双翅目的昆虫最敏感,而甲壳纲昆虫大多较不敏感。标准测试物种大型蚤(Daphnia magna)耐受程度很高,其对新烟碱类杀虫剂的敏感度比其他水生无脊椎动物的平均值至少低1 000倍。Gibbons等[16]则通过汇总现有部分研究中鱼类的急性毒性数据,发现根据美国环保局的生态毒性分类,新烟碱类杀虫剂除对虹鳟鱼的鱼苗为中等毒性外,对其余大部分鱼类的毒性为轻微毒性或几乎无毒。新烟碱类杀虫剂对水生无脊椎动物的亚致死毒性表现在可影响其摄食、运动等行为和神经系统。Agatz等[17]研究发现,甲壳动物蚤状钩虾(Gammarus pulex)在暴露于浓度大于等于30 μg·L-1的吡虫啉期间,其摄食受到抑制,并且在转移到干净的培养基中3 d后仍没有恢复;暴露于0.81~9.0 μg·L-1的吡虫啉,暴露期间对其摄食量没有显著影响,但会导致暴露后摄食量增加。在Bownik等[18]的研究中,暴露于啶虫脒2 h后甲壳动物大型蚤的游泳速度和胸肢活动受到抑制,且这一抑制为浓度依赖性的;在暴露24 h后,低中浓度(25和50 mg·L-1)的啶虫脒会刺激大型蚤的心率上升,而高浓度(100 mg·L-1)则会使其心率降低,这说明,新烟碱类杀虫剂能改变大型蚤的行为和生理参数,增加这些动物对更高捕食者压力的敏感性。Vehovszky等[19]则研究了多种新烟碱类杀虫剂对软体动物静水椎实螺(Lymnaea stagnalis)的神经毒性,发现吡虫啉、噻虫嗪、噻虫胺、啶虫脒和噻虫啉可以抑制中枢神经系统中VD4和RPeD1神经元之间存在的胆碱能突触的兴奋性反应。
新烟碱类杀虫剂对鱼类的亚致死毒性表现在可诱导鱼类出现氧化应激效应、DNA损伤及代谢物水平变化。Yan等[20]和Ge等[21]的研究分别发现,噻虫嗪和吡虫啉可以诱导斑马鱼的氧化应激和DNA损伤,且DNA损伤具有明显的剂量-效应关系。此外,Yan等[22]的研究证明,烯啶虫胺暴露也会影响斑马鱼肝脏中的抗氧化酶活性,并诱导DNA损伤。抗氧化酶活性的变化可能是保护斑马鱼免受烯啶虫胺诱导毒性的适应性反应。Topal等[23]发现,吡虫啉可通过抑制虹鳟鱼脑组织的乙酰胆碱酯酶(AChE)活性、增加8-羟基-2-脱氧鸟苷(8-OHdG)(一种细胞氧化应激的相关标志物)活性和改变氧化应激参数,表现出对虹鳟鱼的神经毒性,该研究中吡虫啉的暴露浓度为10 和20 mg·L-1。在Tian等[24]的研究中,2.0 mg·L-1吡虫啉暴露也导致中国稀有鮈鲫(Gobiocypris rarus)脑组织中8-OHdG含量增加,但AChE活性增加,2.0 mg·L-1烯啶虫胺暴露则会抑制AChE活性。高浓度(760和974 mg·L-1)的啶虫脒暴露可停止斑马鱼中运动神经元系统的发展,这种观察到的效应可能与斑马鱼中丁酰胆碱酯酶的缺乏有关[25]。此外,新烟碱类杀虫剂还会影响鱼类的代谢平衡。Alam等[26]将一种淡水鱼(南亚野鲮Labeo rohita)暴露于浓度为2~3 mg·L-1的啶虫脒28 d,其血清中钙、磷酸盐和白蛋白含量显著降低,血尿素含量显著增加。Zhang和Zhao[27]研究发现,亚致死浓度的啶虫脒诱导了氧化应激、DNA和RNA损伤,抑制了蛋白质合成,使成年斑马鱼头部、血清和肝脏中氨基酸的含量增加,最终导致尿苷和腺苷积累,扰乱斑马鱼体内氨基酸代谢、三羧酸循环(TCA)循环和神经递质的平衡。
2 新烟碱类杀虫剂对非靶标昆虫的毒性效应(Toxic effects of neonicotinoid insecticides on non-target insects)
有关新烟碱类杀虫剂对环境影响的关注始于1996年,当时法国养蜂人首次将吡虫啉的使用与蜜蜂(Apis mellifera)的死亡联系起来[28]。欧盟食品安全局(EFSA)[29-31]对截至2013年的有关蜜蜂急性口服毒性研究进行了汇总,其中包括同行评议研究以及非公共领域的私人研究,分析得到吡虫啉的口服半数致死剂量(LD50)为3.7 ng·bee-1,噻虫胺为3.8 ng·bee-1,噻虫嗪为5.0 ng·bee-1。EFSA也计算了对蜜蜂的等效的急性接触毒性,吡虫啉的LD50为81 ng·bee-1,噻虫胺为44 ng·bee-1,噻虫嗪为24 ng·bee-1。此外,含硝基的新烟碱类杀虫剂(吡虫啉、噻虫胺、噻虫嗪、烯啶虫胺和呋虫胺)比含氰基的杀虫剂(啶虫脒和噻虫啉)毒性更大,原因可能是氰基新烟碱类杀虫剂可快速地被生物转化[13]。
新烟碱类杀虫剂通过影响蜜蜂的生殖、行为、学习记忆和免疫能力等表现出对蜜蜂的亚致死毒性。繁殖是确保群体持续存在的重要行为。Whitehorn等[32]开展的大黄蜂(Bombus terrestris)田间暴露研究发现,将蜂群放在田间连续2周进行吡虫啉经口暴露后,暴露组的生长速率显著降低,且新蜂王的产量减少了85%。Abbott等[33]发现中高剂量(30和300 ng·bee-1)的吡虫啉暴露后,果树壁蜂(Osmia lignaria)幼虫需要更长的发育时间。新烟碱类杀虫剂对蜜蜂的神经毒性主要表现为蜜蜂行为和学习记忆能力的改变,进而给蜜蜂的采集活动带来不利影响,降低蜜蜂的存活能力[34]。高剂量新烟碱类杀虫剂暴露可能会导致蜜蜂出现颤抖、不协调运动、活动过度和震颤等症状而影响蜜蜂的活动性[13]。低剂量暴露则会对蜜蜂的行为产生不同的影响。在Lambin等[35]的研究中,暴露于较低剂量(1.25 ng·bee-1)吡虫啉的蜜蜂活动性增加,而暴露于较高剂量(2.5~20 ng·bee-1)吡虫啉的蜜蜂在开放式田间装置中移动的能力受损。Decourtye等[36]通过半开放式和实验室内经典喙伸反应实验发现,吡虫啉可以降低蜜蜂的嗅觉辨别能力和学习表现,并导致觅食行为减少。在Aliouane等[37]的研究中,长期(11d)接触低剂量(0.1 ng·bee-1)噻虫嗪仅会导致蜜蜂短期(24 h)学习记忆减少,而不会造成长期记忆障碍。新烟碱类杀虫剂也会造成免疫毒性。Di Prisco等[38]发现,亚致死剂量的噻虫胺降低了蜜蜂内NF-κB免疫信号,对蜜蜂的抗病毒防御系统产生了不利影响。此外,研究发现CYP9Q亚家族的细胞色素P450在确定蜜蜂和大黄蜂对新烟碱类杀虫剂的敏感性方面至关重要[39]。
部分研究者开展了大型野外实验探究新烟碱类杀虫剂对蜜蜂的影响。Henry等[40]将接近亚致死剂量(1 ng·bee-1)的噻虫嗪置于蜜蜂胸部的微芯片中,在蜜蜂远离蜂群时逐渐释放,以模拟实际的暴露情况,发现经处理的蜜蜂在一天中因归巢失败而死亡的可能性(高达31.6%)是同类蜜蜂当天自然死亡概率的2倍,这说明,蜜蜂接触非致命但常见的噻虫嗪剂量会影响蜜蜂的生存,并可能导致蜂群崩溃综合征(CCD)。Woodcock等[41]采用大型田间试验来评估新烟碱类杀虫剂处理作物对3个国家(匈牙利、德国和英国)蜜蜂的影响,结果显示,新烟碱类杀虫剂会导致蜜蜂在暴露后一年内建立新种群的能力降低。为了保护蜜蜂,欧洲已采取相应的禁用政策。2018年4月欧盟通过投票表决,禁止在户外使用噻虫胺、噻虫嗪和吡虫啉3种新烟碱类杀虫剂,仅允许用于预期不会与蜜蜂接触的永久性温室中。2018年9月1日起,法国禁止销售与使用5种新烟碱类杀虫剂(噻虫胺、吡虫啉、噻虫嗪、噻虫啉和啶虫脒),法国成为欧盟首个为保护蜜蜂种群禁用新烟碱类杀虫剂的国家[42]。
除蜜蜂外,对蝴蝶和家蚕等非靶标昆虫也有一些研究。家蚕(Bombyx mori)是鳞翅目的模型昆虫。在Yu等[43]的研究中,将家蚕暴露于吡虫啉和噻虫嗪96 h,所得LC50分别为1.27和2.38 mg·L-1。Phugare等[44-45]先后将家蚕口服暴露于吡虫啉和啶虫脒48 h,发现家蚕整体生长缓慢,而且体内出现脂质过氧化(丙二醛显著增加)、蛋白质氧化速率增加和抗氧化酶活性增加等现象,说明吡虫啉和啶虫脒可能通过诱导氧化应激对家蚕产生毒性。此外,彗星试验结果证实吡虫啉和啶虫脒对家蚕具有潜在遗传毒性。对蝴蝶的毒理学研究极少,但有学者使用蝴蝶种群长期数据集来评估新烟碱类杀虫剂在农业区使用的相对影响。Pecenka和Lundgren[46]评估了噻虫胺对帝王蝶(Danaus plexippus)幼虫的影响,得到一龄幼虫36 h口服LC50为15.63 μg·L-1,亚致死浓度下一龄幼虫发育时间延长、体长缩短、体重减轻,但这些差异未延伸到第二龄期。Gilburn等[47]利用1984—2012年期间英国蝴蝶监测计划得到的各种栖息地内蝴蝶数据,发现在控制天气影响后,新烟碱类杀虫剂的使用与蝴蝶种群指数呈显著的负相关。Forister等[48]则对加利福尼亚州北部低海拔范围(<25 m)的67种蝴蝶的种群数据进行了统计,数据来源于该区域内4个地点2周一次的监测(分别开始于1972年、1975年和1988年),发现在控制土地利用和其他因素时,可检测到的蝴蝶种群数量与新烟碱类杀虫剂施用量之间存在负相关性,并且这种相关性对于较小体型的物种而言似乎更为显著。新烟碱类杀虫剂对蝴蝶的具体毒性机制还需更多研究。
3 新烟碱类杀虫剂对鸟类的毒性效应(Toxic effects of neonicotinoid insecticides on birds)
由于新烟碱类杀虫剂对昆虫nAChRs的亲和力大于对脊椎动物的亲和力[49],以往普遍认为它们对鸟类的危害较小。然而,越来越多的证据表明,新烟碱类杀虫剂在环境浓度下对鸟类具有直接或间接的负面影响。Hallmann等[50]利用2项荷兰标准化监测方案的数据集,对2003—2009年吡虫啉在地表水中的平均浓度与2003—2010年鸟类种群趋势的空间相关性进行评估,发现当地农田鸟类种群的平均内在增长率与吡虫啉浓度呈负相关,即吡虫啉可能导致当地鸟类种群数量下降。在吡虫啉浓度超过19.43 ng·L-1的情况下,鸟类的数量每年平均下降3.5%。这一现象发生的原因除了直接饮水引起的急性毒性外,还可能与施用新烟碱类杀虫剂导致鸟类食物资源(昆虫)减少有关。此外,鸟类食用受污染的昆虫而导致的累积效应也可能造成鸟类数量下降。昆虫是鸟类尤其是繁殖季节鸟类饮食的重要组成部分,对鸟类养育后代必不可少。类似地,Millot等[51]利用法国的流行病学监测网络“SAGIR”,发现1995—2014年共有103起检测到吡虫啉残留的野生动物死亡事件。这些死亡动物中灰鹧(Perdix perdix)和鸽子(Columba palumbus、Columba livia和Columba oenas)是主要物种。
实验室研究表明,吡虫啉对鸟类具有中度至高度的急性毒性(按美国环保局生态毒性分类),特别是对于小型物种,如麻雀(Passer domesticus)、金丝雀(Serinus canaria),对灰鹧(Perdix perdix)的毒性尤其高[15,52]。对斑颊哀鸽(Zenaida auriculata)的研究显示,吡虫啉比噻虫胺和噻虫嗪的口服急性毒性高70倍,临床症状持续时间也更长[53]。近年来,新烟碱类杀虫剂对鸟类的慢性毒性和亚致死效应也受到广泛关注。目前有关鸟类的低反应性、共济失调、翼下垂、腹泻、角弓反张(背部严重弓形)、睾丸异常、受精率下降、蛋壳厚度及胚胎大小下降、孵化成功率及幼崽成活率下降以及幼崽发育异常等都有报道[6,15]。口服暴露实验也证实,新烟碱类杀虫剂对鸟类可产生影响。例如,1 mg·kg-1·d-1的噻虫胺暴露26 d即导致雄性日本鹌鹑(Coturnix japonica)产生睾丸异常、DNA损伤率增加和胚胎长度减少[54]。将红腿鹧(Alectoris rufa)暴露于31.9 mg·kg-1·d-1的吡虫啉10 d,也可直接造成其卵子的受精率降低、鸟蛋的尺寸减小[55]。Lopez-Antia等[56]发现,长时间(25和10 d)低剂量(推荐施用率的20%)的吡虫啉暴露导致红腿鹧的血浆生化指标水平降低,血液内超氧化物歧化酶活性增加,首次产卵日期延迟,而且红腿鹧幼体的T细胞免疫反应降低。Gobeli等[57]则选择山齿鹑(Colinus virginianus)的卵为实验对象,定期向其中注射吡虫啉,发现山齿鹑的胚胎发育受到影响,雏鸟存活率降低。Pandey和Mohanty[58]将红梅花雀(Amandava amandava)暴露于0.5% LD50的吡虫啉30 d,发现其甲状腺的重量、体积和组织病理学明显改变,表明低剂量杀虫剂暴露可能会影响甲状腺的稳态和鸟类的繁殖。为探索新烟碱类杀虫剂导致鸟类繁殖障碍的机制,2014年研究人员利用鹌鹑为实验动物研究了噻虫胺的影响,通过观察鹌鹑曲细精管中生殖细胞的空泡化程度及具有片段化DNA的生殖细胞数量、肝细胞中空泡数量和大小、卵巢颗粒细胞(产生黄体酮)组织结构以及氧化应激指标谷胱甘肽过氧化物酶4(GPx4)和锰超氧化物歧化酶(Mn-SOD)活性,推测新烟碱类杀虫剂可能通过氧化应激影响生殖系统[59]。表1列出新烟碱类杀虫剂对各类非靶标生物的急性半数致死浓度(LC50)或半数致死剂量(LD50)。表2列出新烟碱类杀虫剂对水生生物、非靶标昆虫和鸟类的亚致死效应。

表1 新烟碱类杀虫剂对非靶标生物的急性半数致死浓度(LC50)或半数致死剂量(LD50)Table 1 Acute median lethal concentrations (LC50) or lethal doses (LD50) for non-target organisms exposed to neonicotinoid insecticides
注:*括号内为暴露的新烟碱类杀虫剂,其中,IMI为吡虫啉,ACE为啶虫脒,TMX为噻虫嗪,CLO为噻虫胺,THC为噻虫啉,DIN为呋虫胺。
Note: *The exposed neonicotinoids were shown in parentheses; IMI is imidacloprid; ACE is acetamiprid; TMX is thiamethoxam; CLO is clothianidin; THC is thiacloprid; DIN is dinotefuran.
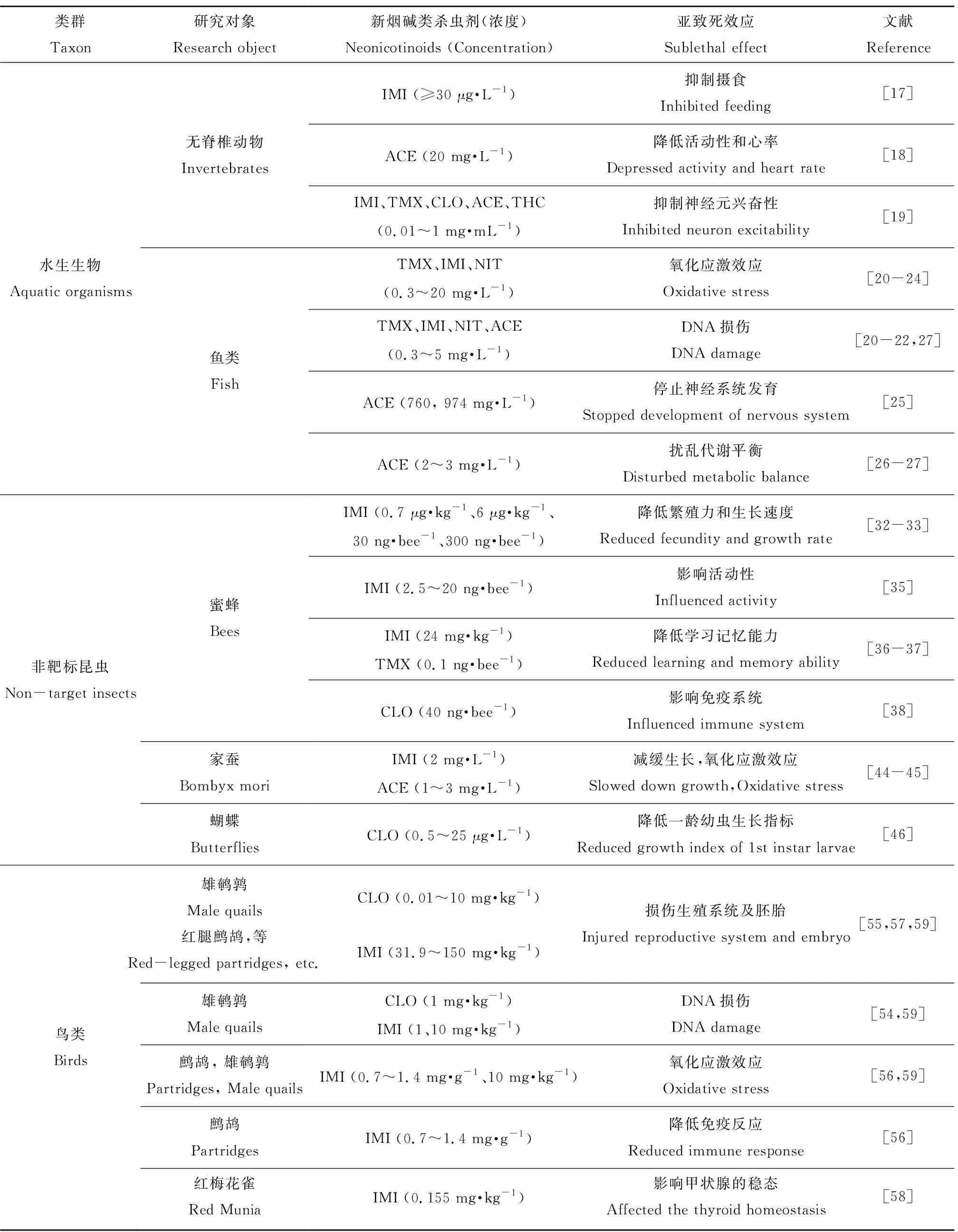
表2 新烟碱类杀虫剂对水生生物、非靶标昆虫和鸟类的亚致死效应Table 2 Sublethal effects of neonicotinoid insecticides on aquatic organisms, non-target insects, and birds
注:IMI为吡虫啉,ACE为啶虫脒,TMX为噻虫嗪,CLO为噻虫胺,THC为噻虫啉,NIT为烯啶虫胺。
Note: IMI is imidacloprid; ACE is acetamiprid; TMX is thiamethoxam; CLO is clothianidin; THC is thiacloprid; NIT is nitenpyram.
4 新烟碱类杀虫剂对哺乳动物的毒性效应(Toxic effects of neonicotinoid insecticides on mammals)
哺乳动物的nAChRs广泛存在于中枢神经系统中,有多种构成形式,既有包含α(α2-α6)和β(β2-β4)亚基的异聚复合物,也有包含α(α7-α9)亚基的同聚复合物,其中α4-β2和α7亚型占优势[60]。以往认为新烟碱类杀虫剂对哺乳动物是低毒性的,但越来越多的研究表明,新烟碱类杀虫剂对哺乳动物的影响不容忽视。新烟碱类杀虫剂在哺乳动物中诱导的毒性可能与α4-β2 nAChRs的激动剂作用和结合亲和力有关[49]。截至目前,新烟碱类杀虫剂对哺乳动物的毒性研究主要以大鼠、小鼠和兔子为研究对象,内容涉及生殖和发育毒性、神经毒性、遗传毒性以及脏器毒性效应。新烟碱类杀虫剂对大鼠急性经口暴露的半数致死剂量为182~>5 000 mg·kg-1[61],如表1所示。
4.1 生殖发育毒性
新烟碱类杀虫剂会对大鼠和家兔的生殖系统造成损伤,也会对小鼠和兔胚胎的发育产生不利影响。Bal等[62-65]进行了一系列针对发育中和成年雄性大鼠的实验,通过口服强饲法用不同剂量的吡虫啉(0.5、2和8 mg·kg-1·d-1)和噻虫胺(2、8和32 mg·kg-1·d-1)处理3个月,发现中高剂量的暴露均会对发育中大鼠的生殖系统(附睾重量、精子参数、睾酮水平和生殖细胞等)产生显著的不利影响。由于高剂量(8 mg·kg-1·d-1)吡虫啉处理下的大鼠睾丸丙二醛(MDA)和脂肪酸显著升高而谷胱甘肽(GSH)降低,因此,推断吡虫啉对雄性大鼠繁殖的不利影响是由睾丸氧化应激导致的。对于成熟大鼠,高剂量吡虫啉暴露也会导致生殖系统损伤,但噻虫胺对雄性大鼠的生殖系统几乎没有可检测到的有害影响。以上结果说明,发育中的大鼠更容易受到吡虫啉和噻虫胺的有害影响。类似地,另一研究发现,啶虫脒也显著降低了睾丸、附睾、精囊和前列腺等睾酮反应器官的重量以及血清睾酮浓度和精子数量、活力、运动性,并破坏了顶体的完整性。一系列指标显示,啶虫脒也是通过诱导睾丸氧化应激损害男性生殖功能[66]。Kapoor等[67]对雌性大鼠口服暴露吡虫啉90 d,发现高剂量(20 mg·kg-1·d-1)下大鼠卵巢重量减轻,卵泡出现窦卵泡和闭锁卵泡等显著病理形态学变化,促黄体激素(LH)、卵泡刺激素(FSH)和孕酮水平也有显著改变。此外,吡虫啉也可诱导雄性家兔的细胞间隙增加、睾丸间质细胞数量减少[68]。Babel’ová等[69]的体外实验表明,将原核期的小鼠胚胎暴露于新烟碱类杀虫剂(噻虫啉、啶虫脒、噻虫嗪和噻虫胺)溶液中,所有最高浓度(100 μmol·L-1)的新烟碱类杀虫剂均对小鼠胚胎发育产生负面影响,噻虫嗪在10 μmol·L-1浓度下也影响胚胎的发育能力;将原核期兔胚胎暴露于噻虫啉中,在10 μmol·L-1和100 μmol·L-1浓度下均发现胚泡的死细胞百分比增加。
4.2 神经毒性
体内和体外研究均表明,新烟碱类杀虫剂可诱导发育中和成熟大鼠的神经行为和生化指标发生改变。向妊娠期(妊娠第9天)大鼠腹膜注射吡虫啉(337 mg·kg-1),发现出生30 d后的幼鼠出现显著的感觉运动损伤,这与其脑、皮质、脑干和血浆中的AChE活性增加有关,且幼鼠运动皮质和海马齿状回内的胶质原纤维酸性蛋白(GFAP)表达增加,这一特征是中枢神经系统对各种损伤的修复反应。这些变化可能对后代健康产生长期的不良影响[70]。在Lonare等[71]的研究中,通过口服将成熟大鼠暴露于吡虫啉(45和90 mg·kg-1·d-1)28 d,发现大鼠的自发运动活动和疼痛阈值显著降低,且大鼠体内AChE、三磷酸腺苷酶(ATP酶)和血清生化物质水平也显著降低。Bhardwaj等[72]发现口服暴露于较低剂量(20 mg·kg-1·d-1)吡虫啉90 d后,雌性大鼠的自发运动活动会降低,脑组织出现轻微的病理学变化,血清和脑中AChE的活性降低。还有研究表明,噻虫嗪和噻虫胺可能通过nAChRs诱导大鼠纹状体的多巴胺释放,且这一效应具有浓度依赖性[73]。Faro等[74]对其机理进行探究,发现噻虫胺对多巴胺释放的影响主要是由胞吐机制、Ca2+、囊泡和TTX依赖性介导的,而不是由多巴胺转运蛋白介导的。焦虑程度也是神经行为学中评价神经毒性的有效指标。在Rodrigues等[60]的研究中,连续7 d暴露于中高剂量(50、100 mg·kg-1·d-1)的噻虫嗪会导致大鼠的焦虑行为增加,大鼠海马突触体中的高亲和力胆碱摄取(HACU)和AChE活性均降低,后者可能是由于噻虫嗪或代谢物作用于大鼠中枢nAChRs导致胆碱能神经传递模式不平衡后的补偿机制。Sano等[75]发现,在子宫内和哺乳期内暴露于低剂量的啶虫脒也可能会特异性地干扰雄性小鼠体内有关社会群体内性关系和焦虑行为的神经回路发展。
体外研究大多基于神经细胞或与之相关的细胞系进行,揭示新烟碱类杀虫剂的神经毒性机制。Bal等[76]发现,暴露于浓度大于10 mmol·L-1的吡虫啉,不到1 min即可损害具有nAChRs的小鼠耳蜗核星状细胞的膜特性,如膜电位的显著去极化。陈柯[77]的研究显示,吡虫啉可以诱导小鼠神经细胞F11细胞系出现细胞萎缩、细胞膜完整性被破坏等细胞凋亡的表现,并干扰F-肌动蛋白的合成及上调乙酰胆碱受体的合成。此外,吡虫啉还能够启动MAPK细胞信号传导途径及Nrf2细胞信号转导途径,通过后者可提高细胞抗氧化能力。Kimura-Kuroda等[78]的研究表明,吡虫啉和啶虫脒对新生大鼠的小脑神经元具有毒性,>1 μmol·L-1的吡虫啉和啶虫脒可以诱发显著的兴奋性Ca2+流入,这是神经生理活动转化为低活性的指标;此外,由于3种nAChRs拮抗剂显著抑制了由吡虫啉和啶虫脒诱导的Ca2+流入,推断这2种新烟碱类杀虫剂可能对小脑神经元中的nAChRs具有直接的激动剂活性。在后续研究中,Kimura-Kuroda等[79]仍将新生大鼠的小脑神经元长期(14 d)低剂量(1 μmol·L-1)暴露于吡虫啉、啶虫脒和烟碱(作为阳性对照)中,之后进行了转录组分析,发现所有暴露组细胞中均有9个神经发育所必需的基因具有显著差异,表明慢性新烟碱类杀虫剂暴露以与烟碱暴露相似的方式改变了发育中哺乳动物大脑的转录组。Li等[80]研究发现,噻虫胺和吡虫啉对人神经元α4β2 nAChRs起到弱激动剂的作用,从而可能对人体产生神经毒性。
4.3 遗传毒性
目前针对遗传毒性的检验已发展出一些经典的实验方法,包括彗星试验、微核试验、姐妹染色单体交换试验、染色体畸变试验和细菌回复突变试验,其中彗星试验用来检测DNA的损伤程度,微核试验和姐妹染色单体交换试验用以检测染色体的改变程度,而细菌回复突变试验则是用以检测化合物的致突变性。吡虫啉、噻虫啉、噻虫胺和啶虫脒均会对哺乳动物产生遗传毒性。吡虫啉对哺乳动物的遗传毒性,郭婧怡等[81]在其综述中已经进行了较为完善的总结。大多数研究者以人外周血淋巴细胞作为实验材料,少数以小鼠和兔的体细胞及生殖细胞作为实验材料。用不同浓度的吡虫啉进行上述经典试验,绝大部分试验结果均有显著性,吡虫啉可造成DNA链断裂、细胞微核率和SEC数均上升,说明吡虫啉具有相当的遗传毒性。另一相对研究较多的新烟碱类杀虫剂为噻虫啉。等[82]分别将大鼠口服暴露于高浓度噻虫啉(112.5 mg·kg-1·d-1)24 h、低浓度(22.5 mg·kg-1·d-1)30 d后,发现大鼠骨髓细胞的有丝分裂指数(BI)和双核细胞数都显著降低,染色体畸变(CA)显著增加。Kocaman等[83]对人外周血淋巴细胞进行的染色体畸变、姐妹染色单体交换和微核试验,结果表明,噻虫啉在实验浓度(75、150和300 μg·mL-1)条件下均有潜在遗传毒性。同样运用上述手段,Galdíková等[84]仅在浓度为120、240和480 mg·mL-1的噻虫啉暴露中,发现牛外周淋巴细胞DNA损伤的频率显著增加,出现不稳定的染色体畸变。此外,在低浓度暴露下谷胱甘肽S-转移酶M3的表达下降。利用彗星试验、微核试验和染色体畸变试验,研究者发现长时间的噻虫胺和啶虫脒暴露,分别对小鼠的外周血红细胞和体细胞造成遗传毒性[85-86]。在Calderón-Segura等[87]的研究中,使用2种遗传毒性参数(尾长和彗星频率)来评估吡虫啉、噻虫啉和噻虫胺对人外周血淋巴细胞的DNA损伤,发现经不同浓度的新烟碱类杀虫剂处理2 h后,DNA损伤显著增加,且具有浓度依赖关系,遗传毒性最大的为吡虫啉。
4.4 脏器毒性
新烟碱类杀虫剂对于哺乳动物的肝脏、肾脏均会产生毒性效应,由于肝脏的主要功能是代谢和消除毒性,因而肝脏是新烟碱类杀虫剂损伤的主要靶器官[88]。几项研究表明,高浓度吡虫啉长期作用于大鼠时,会造成大鼠一系列肝脏的组织学变化,包括肝细胞变性、中央静脉和血窦的扩张以及肝组织内各种酶水平的变化。Bhardwaj等[72]发现将成年雌性大鼠长时间(90 d)暴露于高浓度(20 mg·kg-1·d-1)吡虫啉中,大鼠的脑、肝显示出轻微的病理变化,血清中谷氨酸草酰乙酸转氨酶(GOT)活性、谷氨酸丙酮酸转氨酶(GPT)活性、葡萄糖和血尿素氮(BUN)含量显著升高。Kapoor等[89]通过分析提出,吡虫啉被吸收、代谢和排泄,显示为血清酶水平(如GOT和GPT)和生化成分(如胆红素和BUN)的增加。Toor等[90]和Vohra等[91]在暴露于高剂量吡虫啉的雌性白化大鼠中均发现了肝组织的病理学变化,包括肝细胞变性、中央静脉和血窦的扩张,但Toor等[90]发现肝组织中天冬氨酸氨基转移酶(AST)和碱性磷酸酶(AKP)的水平显著增加,而Vohra等[91]的研究中这一升高并不显著。另一研究以成年雄性白化小鼠为实验对象,发现吡虫啉在暴露剂量达到15 mg·kg-1时,血清的GOT、GPT、碱性磷酸酶(ALP)和总胆红素(TBIL)水平显著升高,肝组织出现病理学变化,这表明吡虫啉对小鼠也具有肝毒性[92]。El Okle等[93]将兔子以250 mg·kg-1的剂量口服暴露于噻虫嗪90 d,发现噻虫嗪通过调节氧化/抗氧化状态和促炎细胞因子(如白细胞介素-6(IL-6)和B淋巴细胞瘤-2(Bcl-2))的产生,抑制细胞凋亡和激活细胞生存信号通路,对兔子发挥潜在的肝毒性和促致癌作用。
肾脏是大多数异生素的靶器官,因为近端肾小管细胞能够在毒性水平积累微酸性和碱性化合物、氨基酸结合物和季胺化合物[94]。有几项研究表明,新烟碱类杀虫剂对哺乳动物具有肾毒性,可造成肾组织的病理学变化和生理生化参数改变。Arfat等[92]和Bhardwaj等[72]研究发现,一定剂量(15和20 mg·kg-1)的吡虫啉对小鼠也具有肾毒性,导致肾组织发生病理学变化。Ozsahin等[95]研究发现,在亚慢性剂量下口服暴露于吡虫啉和噻虫胺90 d后(吡虫啉和噻虫胺剂量分别为4和12mg·kg-1),成年和发育中的雄性大鼠肾组织中脂肪酸、胆固醇和维生素的水平均升高,排泄系统可能在发育早期对于新烟碱类杀虫剂更为敏感。表3列出新烟碱类杀虫剂对哺乳动物的亚致死效应。
5 新烟碱类杀虫剂对人类健康的影响(Influences of neonicotinoid insecticides on human health)
Cimino等[96]汇总了8篇有关新烟碱类杀虫剂对人类健康影响的文献,其中4篇关于急性暴露,4篇关于慢性暴露。在急性暴露研究中,一项未观察到不良影响,3项观察到了不良影响。在慢性暴露研究中,4项均显示新烟碱类杀虫剂暴露与人体不良健康效应之间有良好的相关性。
Elfman等[97]对瑞典19名针叶树幼苗种植者的研究显示,人体接触IMI处理幼苗1周后未有明显的急性不良反应。Phua等[98]研究了向中国台湾毒物中心报告的70例暴露病例,其中57例涉及新烟碱类杀虫剂,主要为IMI(n= 53),其次为ACE(n= 2)和CLO(n= 2)。10例最严重的中毒症状均涉及IMI,其中2例死亡。Forrester[99]研究了向美国德克萨斯毒物控制中心报告的1 142例暴露病例,其中77%与IMI有关,17%与DIN有关。最常见的暴露途径是摄入(51%),其次是皮肤接触(44%)。常见的不良临床反应有眼部刺激(6%)、皮肤刺激(5%)、恶心(3%)、呕吐(2%)、口腔刺激(2%)、红斑(2%)和红眼(2%)。Mohamed等[100]研究了斯里兰卡68名与新烟碱类杀虫剂暴露有关的住院患者,其中一名出现呼吸衰竭,另一名因长期镇静而接受重症监护,其余大多数出现轻微症状,如恶心、呕吐、头痛和腹泻。患者血液中IMI浓度为0.02~51.25 ng·L-1,中位值为10.58 ng·L-1。
母亲在怀孕期间接触新烟碱类杀虫剂与不良产出结果之间存在正相关。Carmichael等[101]的一项病例对照(569例心脏缺陷病例和785例对照)研究表明,孕妇在怀孕早期接触新烟碱类杀虫剂与新生儿患法洛四联症的风险增加有关。Yang等[102]根据加利福尼亚州圣华金谷的73例无脑病例(6例暴露,67例未暴露)研究发现,母亲居住区靠近吡虫啉使用区与无脑病发生相关。在Keil等[103]的研究中,自闭症儿童产前暴露于吡虫啉的几率略高于对照(407例自闭症病例和262例对照)。此外,对新烟碱类杀虫剂施用者的健康影响也有研究。Koureas等[104]发现80名新烟碱类杀虫剂施用者全血中DNA氧化损伤的诱导与杀虫剂使用频率有关。Hernandez等[105]对89名新烟碱类杀虫剂施用者和25名非施用者的呼吸功能进行了测定和比较,发现杀虫剂的施用与肺功能紊乱(总肺容量、残余体积和功能性残余容量较低)有一定相关性。Marfo等[106]基于对35名未知出身的症状患者与50名非症状志愿者的研究发现,尿液中N-去甲基-啶虫脒的浓度与神经症状(包括失忆、手指震颤和头痛等)患病率有一定相关性。
6 结语和展望(Summary and outlook)
新烟碱类杀虫剂对水生生物、非靶标昆虫、鸟类和哺乳动物等多种非靶标生物都具有致死效应和亚致死效应,且不同物种之间差异较大。从总体毒性看,吡虫啉最高,其次为啶虫脒、噻虫啉、噻虫嗪和噻虫胺,呋虫胺和烯啶虫胺较低。在对不同物种的研究中,吡虫啉的毒性都最高,呋虫胺和烯啶虫胺的都较低,急性LC50或LD50相差几倍至几十倍。啶虫脒、噻虫啉、噻虫嗪和噻虫胺的毒性大小顺序随物种不同而不同。例如,对于水生生物和非靶标昆虫,噻虫啉和噻虫胺的毒性较高,而对于鸟类和哺乳动物,啶虫脒的毒性较高。应当指出的是,实验结果通常会受多种因素影响。即便对于同一物种,实验条件如暴露浓度、时间和方式等都会对结果产生影响。因此,上述结论还需更多的研究进行验证。
注:IMI为吡虫啉,ACE为啶虫脒,TMX为噻虫嗪,CLO为噻虫胺,THC为噻虫啉。
Note: IMI is imidacloprid; ACE is acetamiprid; TMX is thiamethoxam; CLO is clothianidin; THC is thiacloprid.
虽然欧洲已经开始部分禁用新烟碱类杀虫剂,但在世界范围内新烟碱类杀虫剂的市场占有率仍然很高,这意味着各种非靶标生物仍会暴露于该类杀虫剂中,因而生物安全受到威胁。目前对新烟碱类杀虫剂生物毒性的研究还存在不足。例如,研究对象多为水生生物、非靶标昆虫、鸟类和哺乳动物,对其他非靶标生物研究较少。已有研究对毒性效应表征较多,对致毒机理探究较少;对单一化合物暴露较多,对多个化合物联合暴露较少。此外,如何将模式动物和体外细胞的实验结果外推到人,目前还未见报道。对人群的暴露研究中,定性数据较多,实量数据较少。今后应在如下几方面加强研究:(1)新烟碱类杀虫剂对其他非靶标生物如土壤节肢动物、非靶标食草动物、两栖及爬行类动物等的毒性效应;(2)结合多种分析手段在不同水平上研究新烟碱类杀虫剂对不同物种生物的致毒机理;(3)多种新烟碱类杀虫剂或与其他农药联合暴露时对不同物种生物的毒性效应与机理;(4)模式动物和体外细胞实验结果外推至人的可靠方法,以及人群暴露评估的可靠方法。这些研究有助于进一步为新烟碱类杀虫剂的风险评估和合理施用提供科学依据。
