湛江特呈岛红树林湿地冬季小型底栖动物和海洋线虫群落的初步研究
2020-05-06吴成业郭玉清杨培培
潘 超,吴成业,郭玉清,杨培培,王 浩
(集美大学水产学院,福建 厦门 361021)
湛江特呈岛位于湛江市霞山区东南方向的湛江港海域,地处110°25′~110°27′E、21°09′~21°10′N,岛上陆地面积约为3.6 km2,海岸线长7.4 km,潮汐属不规则半日潮。特呈岛红树林面积为50.7 hm2,沿岛南部、东南部潮间带成片状分布,整个红树林已有500多年历史,沿岛南部、东南部潮间带成片状分布,主要以白骨壤单优群落、白骨壤与红海榄混交群落为主[1]。
红树林是指热带海岸潮间带的木本植物群落,红树林生态系统在维持海湾河口生态系统的稳定和平衡中起着特殊的作用[2]。小型底栖动物具有种类丰富、丰度较高、世代周期短等特点,其营养物质成为微生物循环的一部分,通过细菌利用转化为溶解的有机碳,供更高的营养级使用[3]。小型底栖动物作为海洋碎屑食物链的关键中间环节,是海洋环境监测、生态系统健康评估的一个重要指标[4];在微食物网中,海洋线虫通过细菌-碎屑耦合,刺激细菌生长,进而加速营养物质的再矿化;海洋线虫是较高营养阶元的食物来源,也是微型和大型底栖动物的重要联接;此外,海洋线虫作为潜在的环境指示种,在生物监测领域被广泛应用[5]。
截至目前,有较多关于特呈岛红树林湿地的研究,包括红树林资源调查、保护与利用[1],水环境质量评价[6],土壤重金属含量特征及污染评价[7],以及对特呈岛红树林沉积物中可培养真菌的系统发育及防污潜力的研究[8]等等,而对该区域小型底栖动物及海洋线虫群落结构的研究尚未见报道。本研究针对特呈岛红树林湿地小型底栖动物群落及海洋线虫群落结构进行初步研究,旨在丰富我国红树林湿地小型底栖动物特别是海洋线虫的物种多样性,为特呈岛红树林湿地的生态系统健康评价提供初步的数据参考。
1 材料与方法
1.1 研究区域概况
本研究于2018年12月8日低潮时沿湛江特呈岛红树林南部自东往西布设1、2、3、4、5共五个采样断面,每个断面取高、中、低三个潮位,每个潮位取三个重复样,共计45个样品。断面2、3是以白骨壤单优林为主,其他断面以白骨壤、木榄混交林为主。特呈岛红树林湿地表层土壤以砂为主,其次是粉砂,黏土含量最少[7]。采样区域见图1,具体信息见表1。

表1 特呈岛红树林湿地采样点及环境因子
1.2 样品采集及室内分选
野外处理选择底质相对一致,无人为扰动的的区域进行沉积物采集,采样管由内径为2.9 cm注射器改制而成,采样深度为5 cm,以5%的福尔马林溶液进行固定,摇匀混合后常温保存。室内处理样品放入500 μm与42 μm孔径组成的套筛内,用过滤后的自来水将其缓缓清洗,除去大部分泥沙、粘土和其他杂质;再用比重为1.15的Ludox提取液将样品转移至离心管,4 000 r/min离心10 min,重复离心两次,取上清液,用42 μm孔径网筛过滤,将截留的样品转移到具有等宽平行线的培养皿内,在解剖镜(Nikon-SMZ800)下将样品按小型底栖动物类群分别计数,再将线虫挑出,放入有混合溶液(V甘油:V酒精:V水=1∶1∶18)的凹型玻璃容器中,在干燥箱中静置一周,进行透明、脱水后,制片保存,以备鉴定。
1.3 数据处理与分析
数据采用软件Excel、SPSS 22.0、PRIMER 6.0(Plymouth Routines In Multivariate Ecological Research)处理。
在PRIMER 6.0软件中用DIVERSE进行数据分析Shannon-Wiener多样性指数(H′),Margalef物种丰富度指数(d),Pielou均匀度指数(J′),以及Simpson优势度指数(1-λ)。
小型底栖动物的分类主要参照《Introduction to the Study of Meiofauna》[9];自由生活海洋线虫的分类鉴定主要参照Platt和Warwick等编写的《Free-living Marine Nematodes》[10]。
2 结果
2.1 特呈岛红树林湿地小型底栖动物的类群组成及丰度
湛江特呈岛红树林湿地采样区域共获取5个小型底栖动物类群(表2),分别是自由生活海洋线虫(Free-living marine nematode)、桡足类(Copepoda)、多毛类(Polychaeta)、寡毛类(Oligochaeta)以及其他未鉴定类群(Others)。其中,海洋线虫是绝对优势类群,占整个小型底栖动物总丰度的97.99%;其次为桡足类,占比为1.60%;多毛类、寡毛类以及其他类占比分别为0.13%、0.19%和0.08%。
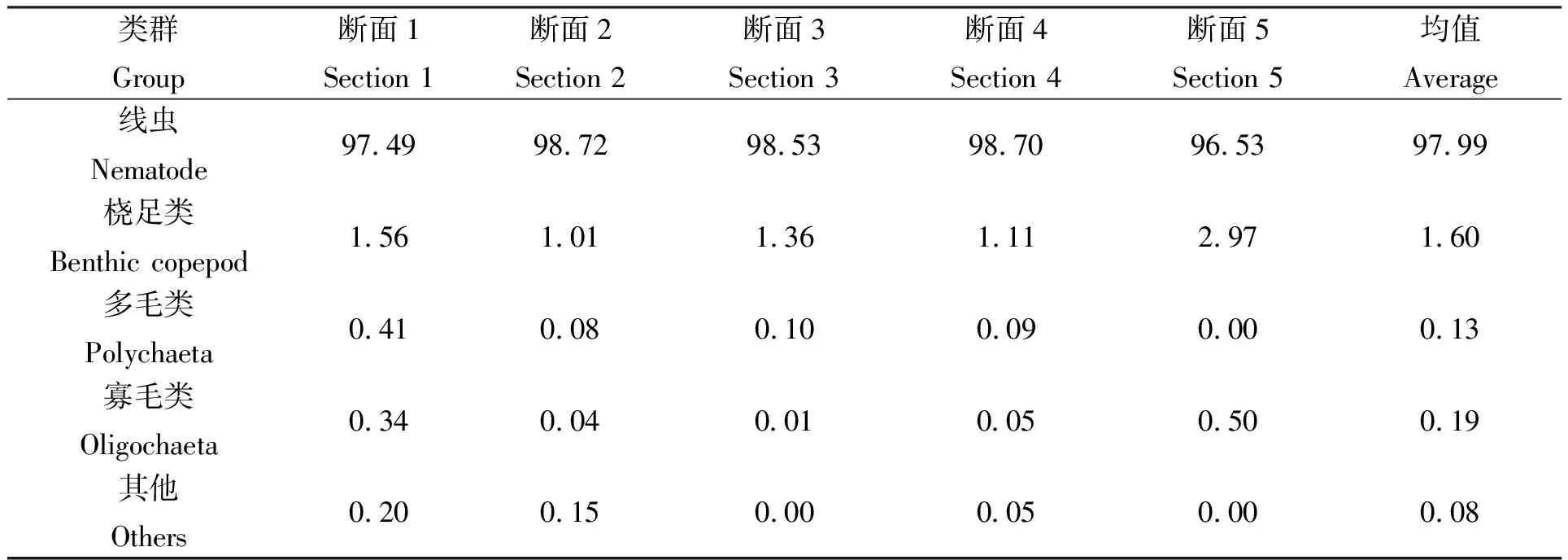
表2 特呈岛红树林湿地小型底栖动物类群丰度的百分比
2.2 特呈岛红树林湿地小型底栖动物丰度的空间分布
采样区域小型底栖动物的平均丰度为(432.25±500.84)ind/10 cm2,从采样断面来看,最高值出现在断面3,平均为(786.40±908.18)ind/10 cm2;最低值出现在断面5,平均为(71.35±16.80)ind/10 cm2;从采样潮位来看,各断面各潮位丰度的较高值出现在断面3的中潮位,丰度值分别为(2 058.4±202.91)ind/10 cm2;较低值出现在断面3的高潮位,为(54.38±7.56)ind/10 cm2;各潮位的丰度大小排列为中潮位(686.22±723.01)ind/10 cm2>高潮位(319.58±288.36)ind/10 cm2>低潮位(290.94±222.39)ind/10 cm2;通过单变量双因素方差分析,不同断面之间小型底栖动物丰度差异极显著(P=0.004<0.01),不同潮位之间小型底栖动物丰度差异显著(P=0.023<0.05)(图2)。
2.3 特呈岛红树林湿地海洋线虫群落结构和多样性分析
2.3.1 海洋线虫优势属
共鉴定特呈岛红树林湿地采样区域海洋线虫标本1 033条,隶属于22个科44个属,其中采样区域数量大于5%的优势属为Terschellingia、Sabatieria、Viscosia、Spirinia、Megadesmolaimus和Spilophorella,优势度分别为21.77%、8.43%、7.99%、7.99%、6.50%和5.79%,合计占总丰度的58.47%(表3)。其中,Terschellingia在每个断面都是优势属,优势度最高达到了39.72%,该属在特呈岛红树林属于广布种;Viscosia、Megadesmolaimus除了在断面1不是优势属外,在其他断面都是优势属,优势度最高为10.92%;Ptycholaimellus、Halichoanolaimus和Paracomesoma只在断面2是优势属,优势度分别为19.75%、8.02%和5.56%;Belballa仅出现在断面3,Spilophorella仅出现在断面4,Metadesmolaimus仅在断面5是优势属,优势度分别为6.06%、21.46%和7.56%;从鉴定结果来看,特呈岛海洋线虫群落分布具有区域差异性。

表3 特呈岛红树林湿地海洋线虫优势属
2.3.2 海洋线虫摄食类型
Wiser等[11]根据线虫口腔结构的不同,将海洋线虫划分为4个功能类群,即1A型(选择性沉积食性者)、1B型(非选择性沉积食性者)、2A型(底上硅藻捕食者)、2B型(杂食者或捕食者)。从鉴定结果(表3)来看,该区域海洋线虫的摄食类型主要以1B型所占为主,比例为31.82%;其次是2A型和2B型,占比分别为27.27%、22.73%;1A占据比例较小,为18.18%;从个体数量上分析,摄食类型以1A型为主,占比为39.11%;其次为1B型,占比为30.30%;2A型、2B型所占比例较小,占比分别为14.81%、15.78%。从属的数量看,沉积食性者(50.00%)占有优势;从个体数量看,沉积食性者(69.41%)也占有一定优势,说明在特呈岛红树林湿地海洋线虫以沉积食性者占优势。沉积食性者占优势时,可以推测出该区域内沉积物的粒径较细,可以提供较多的沉积有机物;反之,当沉积物的粒径较大时,杂食者或捕食者会占多数[12]。
2.3.3 海洋线虫多样性及K-优势度分析
特呈岛红树林湿地各站点海洋线虫多样性分析结果(表4)显示,各项生物多样性指数较低值出现在断面1,断面1的优势度曲线位于图3中其他站位曲线的最上面,说明断面1的海洋线虫群落优势度较高,但物种多样性较低。各项多样性指数较高值出现在断面3,断面3的优势度曲线位于图形最下面,表明其海洋线虫群落优势度较低,但物种多样性较高。其他断面多样性分析结果和K-优势度分析结果介于断面1和断面3的分析结果之间。这些多样性分析的结果与K-优势度曲线的分析结果是一致的。

表4 特呈岛红树林湿地海洋线虫群落的生物多样性指数
2.3.4 特呈岛红树林湿地海洋线虫群落聚类分析及MDS分析
对特呈岛红树林湿地海洋线虫群落的聚类分析和MDS分析见图4、5。聚类分析的结果与MDS分析的结果基本相同;不同断面海洋线虫种类相似性在34.11%~71.33%。断面1与其他断面线虫种类差异较大,断面3和断面5的线虫群落结构相似。从海洋线虫的鉴定结果来看,断面3有7个优势属,断面5有6个优势属,两者有5个共同的优势属,其他断面有1~4个共同优势属,断面3和断面5多样性指数也相差不大,在群落结构上较为相似。
3 讨论
3.1 特呈岛红树林湿地小型底栖动物的类群组成、丰度及空间分布
小型底栖动物的分布受物理、化学和生物等多种因素的影响,如沉积物粒度、有机质含量、外界环境、季节等[13]。陈玉珍等[14]研究比较了冬季福建省四个主要岛屿沙滩小型底栖动物的丰度分别为:东山岛(1 053.18±447.69)ind/10 cm2、海坛岛(256.13±132.31)ind/10 cm2、湄洲岛(98.08±79.14)ind/10 cm2、火山岛(107.04±47.81)ind/10 cm2,四个岛屿冬季第一优势类群都是海洋线虫,第二优势类群分别是涡虫类、腹毛类、缓步类、桡足类。本研究区域冬季小型底栖动物丰度为(432.25±500.84)ind/10 cm2,5个断面第一优势类群都为海洋线虫,第二优势类群是桡足类,该区域的生境属于以泥砂质为主的红树林,与参考文献[14]中砂质沙滩生境有一定差异。厦门凤林红树林湿地冬季小型底栖动物丰度,在秋茄林A断面为292~659 ind/10 cm2,在秋茄林B断面为461~1 526 ind/10 cm2,在白骨壤林D断面为148 ind/10 cm2;小型底栖动物第一优势类群为海洋线虫,第二优势类群为桡足类。在生境上,本研究属于红树林湿地,与参考文献[15]同属红树林湿地,但不同的是凤林红树林的沉积物类型为淤泥[15]。
史本哲[16]在东寨港红树林湿地的研究表明,小型底栖动物丰度与有机质含量极显著相关。食物来源的不同,如噬菌体、叶绿素a、有机碳和沉积物结构影响着小型底栖动物的分布[17]。本研究中断面3出现小型底栖动物平均丰度的最高值,平均为(786.40±908.18) ind/10 cm2,断面3位于青蟹养殖区,有机质含量较高,营养较为丰富。刘亚云等[6]研究结果表明,特呈岛红树林自然保护区水环境有机污染程度属于4级,处于高富营养化水平。陈碧珊等[7]研究结果表明,特呈岛红树林湿地表层土壤潜在生态风险总体上属于轻微-中等污染。本研究中断面5出现小型底栖动物平均丰度的最低值,平均为(71.35±16.80) ind/10 cm2,该采样地点受到大型船只往来作业产生的水能的影响,造成了大量土壤基质流失,有机质减少,现场也观察到白骨壤垂死株较多,有可能造成了断面5的小型底栖动物丰度明显较低[18]。
3.2 海洋线虫的群落结构及多样性分析
目前的研究表明,我国不同红树林湿地海洋线虫群落中出现的优势属存在着一定相似性。本研究中海洋线虫优势属中Terschellingia在每个断面都有,而且优势度除了在断面3居第3位,在其他断面优势度都是最高的,说明其在特呈岛红树林湿地属于广布种。经WoRMS查询,该属目前在世界上发现并有具体描述的有46种,国内有4种。本实验室刘梦迪[19]在凤林红树林、泉州洛阳江和龙海潮间带泥质沉积物发现并详细描述有Terschellinggiaparalonggicaudatasp.nov.和Terschellingialuoyangjiangensissp.nov.两个新种。Terschellinggia在福建九龙江口(6.70%)、凤林红树林(18.10%)、洛阳江口(5.25%)[20],海南东寨港红树林[21]春季(39.6%)、夏季(30.41%)、秋季(27.21%)和冬季(21.5%),都是优势属,只是其优势度与本研究中该属的优势度(12.12%~39.72%)存在一定差异。
曾佳丽等[22]在泉州湾洛阳江河口红树林的研究表明在冬季秋茄生境中非选择性沉积食性者种数最多,常瑜[20]在漳江口红树林发现沉积食性者(1A+1B)线虫在夏、秋、冬所占比例最高,在海南东寨港[21]沉积食性者也占优势,本研究中沉积食性者数量上比例达到了69.41%,说明其在特呈岛红树林湿地中占有优势。郭玉清[15]的研究表明,在白骨壤林的线虫群落各种指数最高,物种丰富度指数4.13、均匀度指数0.71、多样性指数2.16、优势度指数0.84,本研究中白骨壤林线虫群落各项指数与其有一定差异,但相差不大,海洋线虫的群落结构可能与不同红树植物形成的沉积物有关。
