不同FMDV易感性豚鼠PBLC对模拟FMDV感染细胞的杀伤作用
2020-05-03刘迪文卫振陈雁虹谭海明
刘迪文,卫振,陈雁虹,谭海明
(浙江大学实验动物中心,杭州 310013)
口蹄疫(foot and mouth disease,FMD)是严重危害国家经济和人民健康的重大传染病,以往对该病的研究大都基于病毒和疫苗方面,很少见于宿主的免疫机制,特别是机体天然抗性及免疫遗传方面的研究。实际上,生物机体由于遗传背景差异的关系,常会导致不同个体或品种对同一种病原体产生不同的免疫,即呈现易感型及抵抗型个体或品种。2006年,本课题组在豚鼠中发现不同品系对口蹄疫病毒(foot and mouth disease virus,FMDV)呈现不同抗性的现象[1],而后又发现这种抗性可能与豚鼠的细胞免疫功能有关[2],这些发现提示豚鼠免疫系统可能存在对FMDV天然敏感或抗性的遗传特性。
VP1是FMDV的主要表位抗原,在机体内起着启动体液和细胞免疫的关键性作用[3]。实验豚鼠的肾细胞是研究机体对FMDV等多种病毒免疫机制的活体材料,使用原代细胞进行免疫学等研究比用相应细胞系更能反映机体的生理状态[4]。另外,在研究FMDV细胞免疫机制中,直接用FMDV感染体细胞制作靶细胞也是必要的[5]。然而由于进行FMDV感染细胞试验受到生物安全的限制,为此本课题组通过构建重组VP1的慢病毒质粒,替代FMDV感染豚鼠肾小管上皮细胞,制备表达VP1蛋白的肾原代细胞,然后通过豚鼠免疫细胞(效应细胞)对FMDV感染靶细胞的杀伤作用的研究,阐明模拟FMDV感染细胞的可行性,在免疫细胞层面上探究机体FMDV天然抗性的免疫机理。
1 材料与方法
1.1 材料
1.1.1 实验动物
Zmu-1:DHP豚鼠系浙江大学实验动物中心培育的白色品系[11],DHP系该中心繁育的英国种花色品系[12],均为普通级,选用体重300 ~ 400 g,1 ~ 2月龄。豚鼠饲养及实验均位于浙江大学实验动物中心,生产许可证编号【SCXK(浙)2018-0006】,使用许可证编号为【SYXK(浙)2018-0016】。所有动物均实施人道关怀。
1.1.2 试剂和仪器
VP1保存质粒(浙大动科院赠送)、pLVX-GFP表达质粒及293T细胞系(浙大医学院赠送)、慢病毒质粒包装系统:pLP1包装质粒、pLP2促翻译质粒及pLP/VSVG包膜质粒(Invitrogen)、磷酸钙转染试剂(吉诺生物)、PCR试剂盒(上海生工)、EcoRI及BamHI内切酶、T4 DNA连接酶及CytoTOX96 Non-Radiactive Cytotoxicity AssayKit(Promega)等。CO2孵箱(MCO-15AC型,Therm)、荧光倒置显微镜(DMI 3000 M型,Leica)、生物安全柜(NuAIRE)、倒置显微镜(Leica)、PCR仪(ABI)、电泳仪(Bio-Rad)、凝胶成像仪(Bio-Rad)、冷冻离心机(5804R,Eppendorf)、酶标仪(Bio-Rad)等。
1.2 方法
1.2.1 FMDV感染的豚鼠靶细胞制备
(1)豚鼠原代肾细胞的制备及培养,详见参考文献[4]。
(2)重组VP1的慢病毒表达质粒构建
① VP1亚克隆
通过查找pLVX质粒图谱及保存质粒的VP1序列,设计扩增VP1的上下游引物:5’-TAG↓AATTCATACCACCTCTACAGGT-3’,5’-CTG↓GATCCTTACAAA GACTGCTTTAC-3’,引物分别带有EcoRI和BamHI酶切位点。从VP1保存质粒中扩增出VP1片段,用BamHI和EcoRI内切酶先后酶切VP1片段和pLVX-GFP表达质粒,电泳收集VP1目的片段,用连接酶将VP1重组入pLVX-GFP表达质粒,转化至大肠杆菌内扩增。从大肠杆菌中提取pLVX -VP1-GFP表达质粒,通过PCR和双酶切法对其进行鉴定,并对VP1片段进行测序。
② 含VP1的慢病毒组装
将慢病毒包装系统的4个质粒pLVX-VP1-GFP、pLP1、pLP2及pLP/VSVG通过磷酸钙法转染入293T细胞进行慢病毒组装。培养至24 h观察GFP绿色荧光,进行鉴定。
③ 慢病毒感染力鉴定
培养至48 h过滤抽提慢病毒上清液,感染293T细胞。再培养48 h,根据绿色荧光GFP表达鉴定慢病毒感染及VP1表达率。当细胞感染率达到90%以上时,证明慢病毒已能稳定表达VP1蛋白,适合于感染应用。
(3)慢病毒感染豚鼠肾细胞(靶细胞)
将含VP1的慢病毒上清液感染培养10 d的豚鼠原代肾细胞(基本长满培养皿底部),制备高效稳定感染和表达VP1蛋白的靶细胞,然后通过观察GFP绿色荧光证实感染效果。再用抗O型口蹄疫VP1小鼠单抗(哈兽研赠送)染色细胞,通过观察二抗CY5红色荧光标记,直接鉴定肾细胞表达VP1蛋白。同时,制备感染空载慢病毒的靶细胞作对照。
1.2.2 淋巴细胞(效应细胞)的提取及其杀伤性测定
取约300 g的豚鼠,戊巴比妥麻醉后施行心脏采血,每只豚鼠取2 mL肝素抗凝血。用淋巴细胞分离液(天津灏洋生物制品公司)分离出混合的单核细胞,作为效应细胞。然后弃去感染VP1豚鼠原代肾细胞培养液,用胰酶消化分散细胞。细胞计数后按20∶1的比例,吸取效应细胞与感染VP1的靶细胞作为实验组,置于微量反应板的孔中,同时设空载VP1慢病毒的阴性对照组和无感染慢病毒的空白对照组,每个样本做复孔,加培养液置CO2孵箱内混合培养。
次日,参照试剂盒说明书,用LDH法测定细胞上清液中靶细胞LDH释放量的OC值,从标准曲线查出并计算免疫细胞杀伤的百分率。
1.2.3 豚鼠效应细胞及靶细胞的杀伤因子测定
吸取混合细胞培养的上清液,参照试剂盒说明书,用ELISA法分别测定颗粒酶GRA及GRB、穿孔素PF、细胞凋亡因子FAS及其受体FASL的含量。
1.2.4 豚鼠效应细胞及靶细胞的免疫因子测定
吸取混合细胞培养的上清液,参照试剂盒说明书,用ELISA法分别测定主要组织相容性复合物MHC I及MHC II、IFN-γ、TNF-α、IL-2及IL-12的含量。
1.2.5 豚鼠CD4+、CD8+T细胞比例测定
在流式细胞管中分别加入5 μL CD4+、CD8+单抗及50 μL豚鼠抗凝血,对CD4+、CD8+T细胞染色,然后用溶血素裂解红细胞。加PBS,离心,弃去上清。加入0.5 mL PBS重悬细胞,用流式细胞法检测CD4+、CD8+细胞在淋巴细胞中的比例。
1.3 统计学分析
2 结果
2.1 含VP1片段的慢病毒载体质粒的鉴定
重组慢病毒载体质粒pLVX-VP1-GFP的PCR产物电泳图谱如图1,可见650 bp附近呈现目的片段(泳道1、3),而对照质粒(即不含VP1片段的载体质粒)则没有相应的片段(泳道2、4),说明VP1片段已经重组进入了慢病毒载体质粒。(pLVX-VP1-GFP发光,pLVX-GFP不发光,图片未显示,证明质粒中插入外源性片段)。
BamH1和EcoR1酶切重组质粒,所得酶切片段的电泳图谱见图2,可见在650 bp附近呈现目的片段(泳道1、2、3、4),说明酶切位点无误,与设计的引物碱基序列一致,VP1片段被插入到慢病毒载体质粒的MCS区两位点之间。
提取的质粒样品和设计引物送上海生工测序,结果经NCBI查询为福建O型口蹄疫病毒VP1片段,目标片段验证无误。经过上述实验验证,含口蹄疫VP1片段的慢病毒载体质粒构建是正确的。

注:泳道1:DNA Marker(1000 bp);泳道3:DNA Marker(100 bp);泳道2、5:目的片段;泳道4、6:DNA 空质粒。图1 PLVX质粒PCR片段扩增出VP1片段Note. Lane 1,DNA Marker(1000 bp). Lane 3, DNA Marker(100 bp). Lane 2, 5,Target fragment. Lane 4, 6,Empty vector.Figure 1 VP1 fragment amplified by PCR from PLVX plasmid

注:泳道1、2、5、6:目的片段;泳道3:DNA Marker(1000 bp);泳道4:Marker(100 bp)。图2 重构质粒双酶切电泳验证得到VP1片段Note. Lane 1, 2, 5, 6,Target fragment. Lane 3,DNA Marker(1000 bp). Lane 4,DNA Marker(100 bp).Figure 2 VP1 fragment gained by enzyme digestion from the restructure plasmid
2.2 完整慢病毒的构建及感染力测定
慢病毒包装系统的4质粒经293T细胞包装,细胞表面表达GFP荧光(见图3),表明质粒已组装成完整的慢病毒。为了证明该慢病毒的感染性,将病毒上清液感染293T细胞,结果细胞表面仍表达GFP绿色荧光(见图4),表明该慢病毒具有较强的感染力。
2.3 豚鼠肾小管上皮细胞感染慢病毒及其VP1蛋白的表达
如图5所示,豚鼠肾小管上皮细胞长满培养皿。慢病毒上清液感染豚鼠肾小管上皮细胞表达荧光(见图6),可见慢病毒已几乎感染所有豚鼠肾原代细胞。用VP1抗体对豚鼠肾小管上皮细胞(靶细胞)染色,出现红色荧光(见图7),证实肾小管上皮细胞已被慢病毒感染,并表达口蹄疫病毒VP1蛋白,而阴性对照样本没有显色。
2.4 效应细胞对靶细胞的杀伤作用
将两个品系豚鼠的淋巴细胞分离液提取的效应细胞分别与两个品系豚鼠(每品系1只)感染FMDV VP1的靶细胞进行细胞毒性(杀伤性)反应,结果见表1及图8。
从图表中可见,两个品系豚鼠实验组的杀伤率都显著大于对照组(P< 0.01),表明VP1蛋白显著地激发了效应细胞的免疫反应,效应细胞杀伤靶细胞的效果非常明显;DHP豚鼠实验组的杀伤率显著大于Zmu-1:DHP豚鼠(P< 0.01),表明DHP品系豚鼠对FMDV感染细胞具有较大的自然杀伤性。
2.5 豚鼠细胞上清液杀伤因子含量
为了研究免疫细胞对靶细胞的杀伤机理,测定了混合细胞杀伤后培养基上清液中的杀伤因子含量,结果见表2及图9。
由图表可见,两个品系豚鼠效应细胞分泌的穿孔素PF、细胞凋亡因子FAS、颗粒酶GR A及GR B呈极显著差异(P< 0.01),即DHP品系豚鼠极显著的大于Zmu-1:DHP豚鼠,而两个品系的细胞凋亡因子受体FASL无差异(P> 0.05)。

图3 293T细胞内组装的慢病毒GFP荧光(标尺:50 μm)Figure 3 GFP fluorescence of assembly lentivirus in 293T cell(Scale bar:50 μm)
图4 慢病毒感染293T细胞的GFP荧光(标尺:100 μm)Figure 4 GFP fluorescence of 293T cell infected with lentivirus(Scale bar:100 μm)

图5 肾小管原代上皮细胞(标尺:100 μm)Figure 5 Prrimary epithelial cells of renal superior tuble(Scale bar:100 μm)

图6 72 h GFP表达图(标尺:20 μm)Figure 6 GFP fluorescence expression 72 h latter(Scale bar:20 μm)
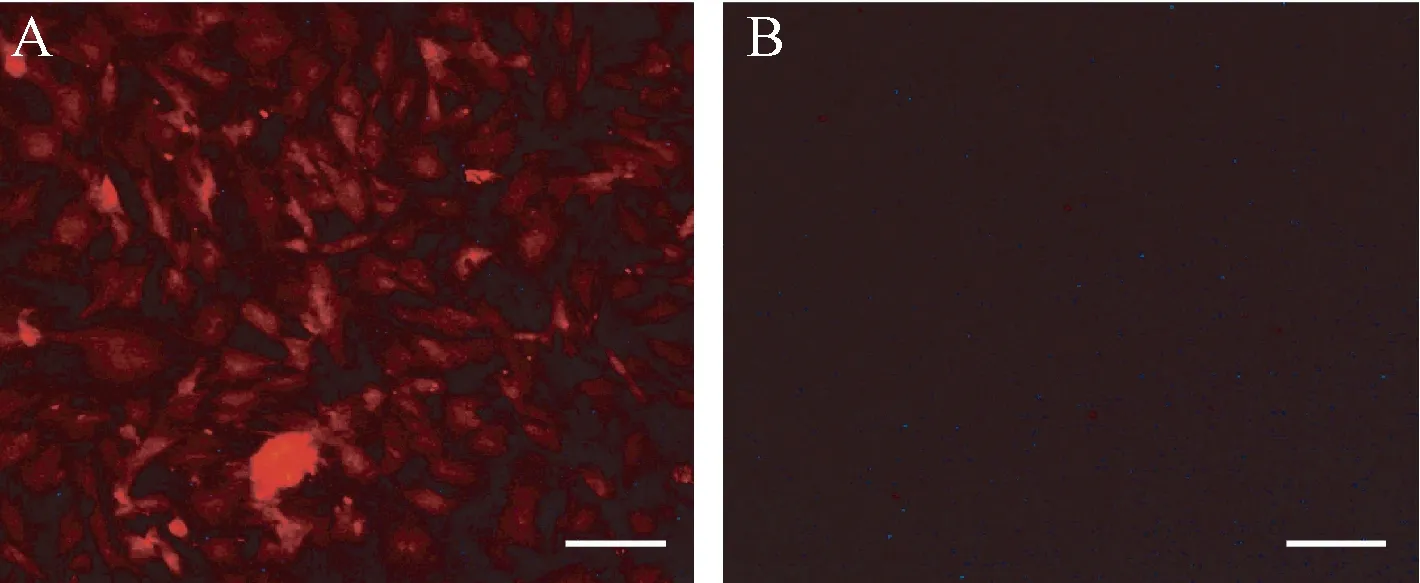
图7 VP1蛋白荧光染色图(A)和阴性对照图(B)(标尺:50 μm)Figure 7 Fluorescent staining image of VP1 protein (A) and negative control image (B)(Scale bar:50 μm)
2.6 豚鼠细胞上清液免疫分子含量
为了研究效应细胞对靶细胞的免疫机理,测定了混合细胞杀伤后培养基上清液中的免疫分子含量,结果见表3及图10。从图表可见,两个品系豚鼠效应细胞分泌的IFN-γ和TNF-α呈极显著差异(P< 0.01),即DHP品系豚鼠极显著的大于Zmu-1:DHP豚鼠;IL-12、IL-2呈显著差异(P< 0.05),即DHP品系显著的大于Zmu-1:DHP;而两个品系的细胞MHC I及II无差异(P> 0.05)。
2.7 豚鼠CD4+、CD8+ T细胞亚类比例
从血液提取的免疫细胞中对靶细胞产生杀伤作用的主要是CD8+及NK细胞,由于目前市场上没有鉴定豚鼠NK细胞的单抗,因此拟通过测定CD8+细胞比例,初步推断效应(杀伤)细胞是CD8+细胞还是NK细胞。豚鼠CD4+、CD8+T细胞亚类的测定结果见表4及图11。从图表可见,在未经特异性抗原免疫的情况下,DHP品系豚鼠的CD8+细胞含量显著大于Zmu-1:DHP豚鼠(P< 0.05)。

表1 豚鼠淋巴细胞对靶细胞的杀伤率(%,n=5)Table 1 Killing rate of lymphocyte to target cells(%,n=5)
注:与同品系空白、阴性对照组比较,**P< 0.01。与相同靶细胞的另一品系实验组对照,##P< 0.01。
Note. Compared with blank and negative control group,**P<0.01. Compared with experimental group of another strain with the same target cell,##P< 0.01.

注:与另一品系比较,*P<0.05,**P<0.01。(下图同)图8 豚鼠淋巴细胞对靶细胞的杀伤性Note.Compared with the another strain,*P<0.05,**P<0.01.(The same in the following figures)Figure 8 Killing rate of lymphocyte to target cells
表2 两个品系豚鼠细胞杀伤因子含量(pg/mL,n=5)
Table 2 Content of cell killing factors in two strains of guinea pigs(pg/mL,n=5)

品系Strains指标含量ContentPFGR AGR BFASFASLDHP457.75±74.54790.75±267.931565.75±64.94472.25±126.63100.25±1.89Zmu-1:DHP152.50±34.95127.25±18.54165.25±62.13110.50±7.0599.75±1.50P值 P value< 0.01< 0.01< 0.01< 0.01>0.05DHP/Zmu-1:DHP比值DHP/Zmu-1:DHP ratio3.006.219.484.271.01
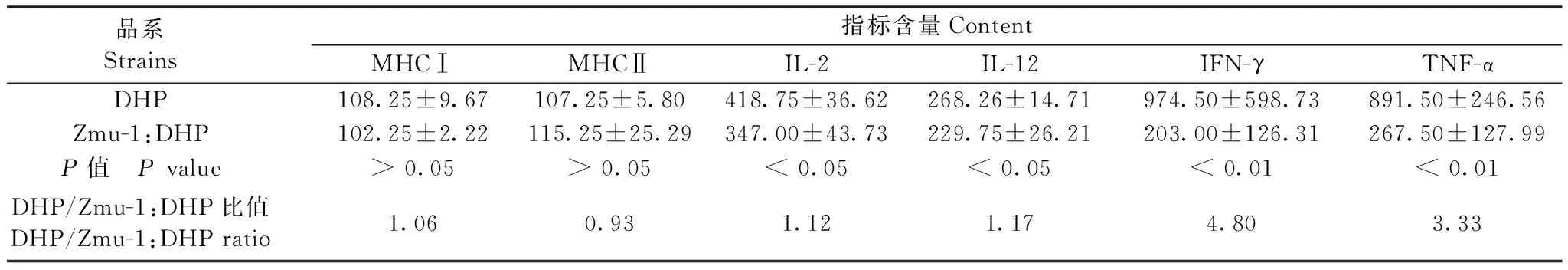
表3 两个品系豚鼠细胞因子含量(pg/mL,n=5)Table 3 Content of cytokines in two strains of guinea pigs(pg/mL,n=5)
图9 两个品系豚鼠细胞杀伤因子显示图Figure 9 Image of cell killing factors in two strains of guinea pigs

图10 两个品系豚鼠细胞因子显示图Figure 10 Tow strains of guinea pig cytokine
图11 流式细胞仪测定T细胞亚类显示图Figure 11 Chart of T lymphocyte subset determined by flow cytometry

表4 豚鼠T细胞亚类测定结果(%,n=5)Table 4 Results of T lymphocyte subset of guinea pig(%,n=5)
注:与另一品系比较,*P< 0.05。
Note. Compared with the another strain,*P< 0.05.
3 讨论
口蹄疫传染性非常之强,被国际有关机构列为头等烈性传染病。传染病是机体与病原体抗争的过程,从机体方面对传染病进行免疫机理研究是新的课题。由于物种间或物种内个体的遗传背景差异,往往会导致对疾病的抵抗性不同。目前国内外培育出疾病抗性物种,如吉林大学的天然抗猪瘟猪[6],哥伦比亚筛选的抗口蹄疫病毒牛[7]等等,这些事例都说明物种中蕴藏着许多天然抗病性状或基因,研究和挖掘这些抗性基因对防治疾病发生有非常重要的意义。本课题组在培育实验豚鼠品系过程中,发现不同品系及毛色豚鼠与抗口蹄疫病毒遗传特性有关,有的品系对口蹄疫病毒呈完全易感,有的则呈完全抗性[1],该现象的发现促使课题组进一步研究疾病抗性与机体细胞的免疫遗传关系
病毒侵入机体及感染靶细胞后,机体免疫细胞如NK自然杀伤细胞和CD8+T淋巴细胞等将以固有及特异性免疫的形式对感染细胞进行杀伤[8],以驱除病毒、维持机体内环境稳定。其作用机理是分泌杀伤和免疫蛋白等,破坏靶细胞及调节天然和适应性免疫[9]。因此,课题组对不同抗性豚鼠免疫细胞杀伤病毒感染细胞的机理进行了体外研究。从结果可见,抗性品系豚鼠的免疫细胞对病毒感染靶细胞的杀伤率远大于易感豚鼠(P< 0.01),且其效应细胞表达的大部分杀伤和免疫因子含量远高于易感品系,某些指标达到3 ~ 9倍,证明在这过程中机体的天然细胞免疫可能起着抗击病毒的第一道防线的重要作用。
作者研究发现,FMDV抗性豚鼠杀伤靶细胞不需要相应抗原刺激,产生杀伤的时间为4 ~ 96 h,相对特异性免疫细胞杀伤的4 ~ 14 d时间较短,杀伤细胞不需要MHC参与,与两种豚鼠靶细胞及效应细胞表达的MHC无关,这些结果都与文献[10]报道的天然免疫机制基本一致。目前缺乏分离豚鼠天然免疫细胞的特异性标记抗体,对研究豚鼠天然免疫特性造成一定限制,因此最终究竟何种细胞起主要作用有待进一步证实。本实验用淋巴细胞分离液提取的细胞包含T、B和NK等免疫细胞,从流式分析来看,DHP品系豚鼠CD8+T细胞数量也有增高的趋势,说明CD8+细胞也可能参与部分免疫作用。
检测机体免疫细胞杀伤FMDV的功能需要制备FMDV感染的靶细胞,这涉及到生物安全问题。本文通过慢病毒将FMDV主要免疫片段VP1导入靶细胞,经鉴定表达VP1蛋白,证明靶细胞确实感染了VP1基因,并表达相应病毒蛋白,制备模拟病毒自然感染性靶细胞的方法是成功的。VP1作为FMDV的主要抗原基因,已有多篇文献报道了其特性,及将其制成重组疫苗用于免疫动物[13-14],由此可见该片段在体内是安全可靠的。本文采用小型动物作为模式动物替代大型动物,为进一步研究效应细胞杀伤功能,揭示FMD天然抗性的机制提供了技术平台。
