4型登革病毒NS2A蛋白通过UXT-V1逃避宿主免疫的机制研究
2020-05-01鞠鹏飞王政坤张建立
鞠鹏飞,王政坤,张建立
(青岛大学附属医院胃肠外科,山东青岛 266555)
登革病毒感染是当今世界上最主要的由蚊子传播的病毒性疾病的原因[1]。与其他黄病毒一样,其基因组包含编码3种结构蛋白和7种非结构蛋白的单链正义RNA[2]。与其他黄病毒不同,有4种血清型,它们具有遗传相似性但抗原性不同[3]。4型登革病毒NS2A蛋白含有几个跨膜结构域并与内质网膜相关[4]。由于其高疏水性,这种蛋白质可能是登革病毒非结构蛋白中最不为人知的。除了参与膜重排和病毒复制外,NS2A蛋白参与宿主的免疫系统逃避和免疫反应[5]。泛转录表达因子剪接变异体1(UXT-V1)参与基因转录调节[6]。HUANG 等[7]发现UXT-V1能够促进线粒体上线粒体抗病毒信号蛋白(MAVS)抗病毒信号体的形成激活干扰素-β(IFN-β)与核因子κB(NF-κB)通路。然而,4型登革病毒NS2A蛋白在UXT-V1的抗病毒活动中的作用鲜少报道。基于此,本研究旨在探讨4型登革病毒NS2A蛋白通过UXT-V1逃避宿主免疫的机制。
1 材料与方法
1.1 材料 HEK-293T细胞购自上海康朗生物科技有限公司(货号:H-HEK-293T)。总RNA抽取试剂购自上海科敏生物科技有限公司(货号:DXT-15596018)。Flag、Myc、IRF3、p65、TUBULIN、H3抗体购自abcam公司(货号:ab205606、 ab32072、ab68481、 ab16502、 ab210797、 ab1791)。BCA蛋白质测定试剂盒购自上海经科化学科技有限公司(货号:JK-201)。NF-κB报告试剂盒购自BPS公司(货号:60614)。IFN-β报告试剂盒购自R&D公司(货号:41410-1)。蛋白裂解液购自金克隆(北京)生物技术有限公司(货号:EX6020,100 mL)。核蛋白提取试剂盒购自贝博-Bestbio(货号:BB-3102)。DMEM培养基购自上海中乔新舟生物科技有限公司(货号:09211-1),优级胎牛血清购自浙江天杭生物科技股份有限公司(货号:11011-8611)。蛋白酶抑制剂购自bimake公司(货号:B14011)。转染试剂购自上海邦奕生物科技有限公司(货号:BB-4601)。磷酸盐缓冲液购自天津泰泽兴业生物科技有限公司(货号:MA0015)。荧光素酶报告试剂盒购自上海科敏生物科技有限公司(货号:DXT-ST219020)。青链霉素混合液(100×)购自上海亿言生物科技有限公司(货号:SL6040,100 mL)。FLAG-NS2A质粒和Myc-UXT-V1质粒均由北京擎科生物合成,载体为PCDNA3.1。4型登革病毒获赠于武汉病毒所。2×SDS 蛋白电泳上样缓冲液购自上海樊克生物科技有限公司(货号:FK-ZH536J)。IFN-β、白细胞介素-8(IL-8)、干扰素诱导蛋白54(ISG54)、 甘油醛-3-磷酸脱氢酶(GAPDH)实时荧光定量PCR(qPCR)引物序列见表1,引物由生工生物工程(上海)股份有限公司合成。

表1 qPCR引物序列
1.2 方法
1.2.1 细胞培养、转染和感染 HEK-293T细胞在含有10%胎牛血清中和1%青霉素和链霉素的DMEM培养基中培养。将所有细胞维持在37 ℃的含5%CO2的培养箱中。将FLAG-NS2A质粒或Myc-UXT-V1质粒与脂质体混合,静止大约20 min后,缓缓滴入HEK-293T细胞。使用感染复数为1的4型登革病毒感染HEK-293T细胞[9]。
1.2.2 RNA抽取与qPCR 总RNA抽取试剂细胞中提取总RNA,并用逆转录酶进行逆转录。将转录水平标准化为GAPDH的水平。使用mRNA qPCR试剂盒并根据制造商的说明书测定IFN-β、IL-8、ISG54、GAPDH mRNA的表达[10]。
1.2.3 免疫印迹 使用RIPA裂解缓冲液或核蛋白提取试剂盒从HEK-293T细胞中提取总蛋白质,并使用BCA蛋白质测定试剂盒进行定量[8]。使用多克隆抗Flag、 Myc、 IRF3、 p65、TUBULIN、 H3抗体作为一抗、抗兔和抗小鼠IgG为二抗。使用化学发光试剂检测相应蛋白质[11]。
1.2.4 荧光素酶报告实验 将每孔总共5×104个HEK-293T细胞接种在24孔板中。培养24 h后,用含有200 ng/mL双荧光素酶报告质粒IFN-β或NF-κB与转染试剂混合后转染细胞。使用荧光素酶报告检测试剂盒在转染后24 h通过酶标仪测量荧光素酶活性。所有转染独立重复至少3次[12]。
1.2.5 免疫共沉淀 HEK-293T细胞用在1 mL NP-40裂解缓冲液中裂解。在14 000×g,4 ℃条件下离心15 min,立即将上清液转移到新管中。用磷酸盐缓冲液洗涤琼脂糖珠2次,并制成50%琼脂糖工作液。在水平振荡器上4 ℃振荡10 min。在14 000×g,4 ℃条件下离心15 s,将上清液转移到新管中并丢弃琼脂糖。加入适量的FLAG抗体至总体积约500 μL。旋转振荡器上于4 ℃缓慢摇动过夜。在14 000×g,4 ℃条件下离心15 s,保持沉淀并用预先冷却的洗涤缓冲液(或冷磷酸盐缓冲液)洗涤3次。加入15 μL SDS加样缓冲液后100 ℃水浴5 min后取7 μL进行下游分析[13]。

2 结 果
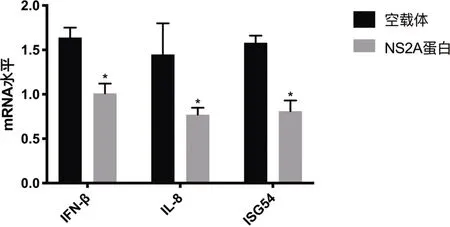
2.1 4型登革病毒NS2A蛋白抑制宿主IFN-β与NF-κB通路 HEK-293T细胞用4型登革病毒感染后再过表达Flag-NS2A蛋白,见图1。qPCR检测发现,4型登革病毒NS2A蛋白抑制宿主IFN-β、IL-8和ISG54的mRNA水平,见图2。通过荧光素酶报告实验发现4型登革病毒NS2A蛋白抑制宿主IFN-β、IL-8和ISG54的mRNA水平,见图2。通过荧光素酶报告实验检测发现4型登革病毒NS2A蛋白抑制宿主IFN-β与NF-κB通路,见图3。

图1 4型登革病毒感染的情况下过表达NS2A蛋白
注:与空载体比较,*P<0.05。
图2 NS2A蛋白抑制宿主IFN-β、IL-8和ISG54的mRNA水平

注:与空载体比较,*P<0.05。
图3 NS2A蛋白抑制宿主IFN-β与NF-κB通路
2.2 4型登革病毒NS2A蛋白与宿主UXT-V1存在相互作用 将Flag-NS2A质粒与Myc-UXT-V1质粒共转染进入HEK-293T细胞中,免疫共沉淀后免疫印迹结果显示4型登革病毒NS2A蛋白与宿主UXT-V1存在相互作用,见图4。

图4 4型登革病毒NS2A蛋白与宿主UXT-V1存在

注:W表示全细胞裂解液;C表示细胞质;N表示细胞核。
图5 4型登革病毒NS2A蛋白阻断IRF3和p65的核转移
2.3 4型登革病毒NS2A蛋白阻断IRF3和p65的核转移 HEK-293T细胞用4型登革病毒感染后,过表达NS2A蛋白时,IRF3和p65均定位在细胞质中,细胞核中几乎没有。因此,4型登革病毒NS2A蛋白阻断IRF3和p65的核转移。见图5。
3 讨 论
登革病毒是蚊子传播的人类病原体,主要影响热带地区,39亿人生活,每年有近1亿株感染引起临床症状[14]。病毒的传播是通过来自伊蚊属的蚊子(主要是埃及伊蚊和白纹伊蚊)的叮咬而发生的。这些蚊媒通常在热带地区发现,但现在也在更温和的地区发现全球变暖,从而增加了受登革热影响地区进一步扩大的可能性。大多数感染是无症状的或导致持续数天的轻微症状(发烧、关节疼痛或皮疹)[15]。然而,在一些严重的情况下,后果可能更严重:登革热出血热、登革热休克综合征,这些疾病每年导致约20 000人死亡[16]。
NS2A蛋白是许多黄病毒的毒力决定因子,其与病毒毒素具有相似性[17]。 NS2A蛋白是高度疏水的跨膜蛋白,与脂质双分子层相互作用,与复制复合物中的dsRNA,病毒蛋白NS1、NS3和NS5共定位,在病毒组装和释放中发挥关键作用[18]。泛素表达转录因子(UXT)广泛存在于人和小鼠组织中[19]。生物信息学分析揭示了UXT的两种同种型,即UXT-V1和泛转录表达因子剪接变异体2(UXTV2)[7]。在本研究中,发现4型登革病毒NS2A蛋白与宿主UXT-V1存在相互作用。UXT-V1能够促进线粒体上MAVS抗病毒信号体的形成,激活IFN-β与NF-κB通路[7]。提示4型登革病毒NS2A蛋白可能抑制宿主IFN-β与NF-κB通路。
RIG-I和MDA5已被表征为在宿主细胞的初级应答期间检测细胞溶质RNA病毒普遍存在的传感器[20]。一旦RIG-I/MDA5感知病毒RNA,就会形成线粒体信号体,其中包括线粒体抗病毒信号蛋白[21]。MAVS信号体是线粒体上新出现的抗病毒蛋白复合物。UXT-V1是MAVS信号体的一个新成分,它对病毒诱导的NF-κB和干扰素调节因子3(IRF3)的激活至关重要[7]。在本研究中,发现4型登革病毒NS2A蛋白抑制宿主IFN-β、IL-8和ISG54的mRNA水平,阻断IRF3和p65的核转移,抑制宿主IFN-β与NF-κB通路。MAVS本身通过其C-末端跨膜结构域定位于线粒体的外膜上[22-25]。在静息细胞中,MAVS信号体中的大多数蛋白质存在于胞质溶胶中,包括TNF受体相关因子3和死亡域相关蛋白。病毒感染后,这些蛋白质与线粒体上的MAVS快速聚集,导致坦克结合激酶1的活化,然后其在C末端磷酸化IRF3,之后IRF3二聚化并易位到细胞核中。此外,MAVS信号体可以激活NF-κB。转录因子IRF3和NF-κB协同诱导Ⅰ型干扰素的早期产生并随后建立抗病毒状态[26]。因此,4型登革病毒NS2A能够抑制MAVS信号体下游的IFN-β与NF-κB通路以抑制宿主细胞的抗病毒状态的形成。
4 结 论
综上所述,4型登革病毒NS2A蛋白通过与UXT-V1的相互作用阻断宿主固有免疫关键因子IRF3和p65的核定位,抑制宿主IFN-β与NF-κB通路,最终到达其免疫逃避的目的。
