血清Tg、TNF-α、HMGB1联合检测诊断甲状腺腺瘤的临床意义
2020-05-01刘权忠付远飞
刘权忠,付远飞,贾 佩
(重庆医科大学附属南川人民医院耳鼻咽喉科,重庆 408400)
甲状腺腺瘤是甲状腺最常见的良性肿瘤,好发于中青年女性,大部分患者无症状,随着肿瘤逐渐增大压迫周围组织后出现呼吸困难、吞咽困难等症状;如不及时治疗,将严重影响患者的生活质量。有研究报道,全球甲状腺腺瘤的发病率呈逐年增长趋势[1]。超声、CT 等检查方式在甲状腺腺瘤的诊断中发挥了重要作用,但其易受图像特征、分辨率等因素的影响,出现误诊、漏诊[2]。因此,对甲状腺腺瘤患者尽早诊治,对改善患者生存质量至关重要。血清甲状腺球蛋白(Tg)是由甲状腺滤泡上皮细胞合成的一种糖蛋白复合物,其已成为当前诊断甲状腺疾病的重要指标[3-4]。肿瘤坏死因子-α(TNF-α)是单核巨噬细胞分泌的炎症细胞因子,其具有抑制肿瘤细胞凋亡,促进肿瘤细胞由G1期向S期进展功能,从而增加了肿瘤病灶的血供,促进了肿瘤的发生、发展[5]。高迁移率族蛋白B1(HMGB1)是一种保守的非组DNA 结合蛋白,其通过调控细胞的增殖凋亡、侵袭转移,来诱导肿瘤微环境的形成[6-7]。目前,关于血清Tg、TNF-α和HMGB1联合检测诊断甲状腺腺瘤的研究较少。因此,本研究旨在分析血清Tg、TNF-α和HMGB1检测在甲状腺腺瘤中的价值,为其诊断和治疗提供理论依据。
1 资料与方法
1.1 一般资料 选取2016—2019年本院耳鼻咽喉科收治的甲状腺腺瘤患者60例(实验组),甲状腺腺瘤病理上分为甲状腺滤泡状腺瘤(39例)和甲状腺乳头状囊性腺瘤(21例),其中男性16例,女性44例;年龄26~71岁,平均(41.6±1.73)岁;体质量指数(BMI)<24 kg/m222例,BMI≥24 kg/m238例。实验组根据肿瘤不同直径分为直径>2 cm 38例和直径≤2 cm 22例患者。健康志愿者60例作为对照组,其中男性21例,女性39例;年龄28~72岁,平均(43.1±2.06)岁;BMI<24 kg/m226例,BMI≥24 kg/m234例。两组受试者的性别、年龄、BMI比较,差异无统计学意义(P>0.05),具有可比性。纳入标准:(1)实验组术后病理均证实为甲状腺腺瘤;(2)术前未接受抗肿瘤药物治疗。排除标准:(1)既往有甲状腺局部手术病史者;(2)有其他器官恶性肿瘤病史者;(3)有心脑血管、肝、肾等部位疾病者;(4)存在甲状腺炎等甲状腺疾病者。
1.2 方法 实验组患者分别在术前3 d及术后2周抽取外周静脉血5 mL,分离血清,-20 ℃冻存。对照组于入组时抽取外周静脉血5 mL,分离血清,-20 ℃冻存。采用贝克曼库尔特化学发光法检测实验组、对照组血清Tg水平,酶联免疫吸附剂试验(ELISA)法检测血清TNF-α和HMGB1水平。
1.3 观察指标 比较两组Tg、TNF-α、HMGB1水平差异,比较实验组患者术前及术后检测的Tg、TNF-α、HMGB1水平;比较不同肿瘤直径、不同肿瘤病理类型检测的Tg、TNF-α、HMGB1水平。检测Tg、TNF-α、HMGB1单独和联合检测时诊断甲状腺腺瘤的灵敏度和特异度。正常参考值:TNF-α 8~500 pg/mL、Tg 1.4~78.0 ng/mL、HMGB1≤10 μg/L[8-10]。

2 结 果
2.1 实验组与对照组血清Tg、TNF-α、HMGB1水平比较 实验组患者血清Tg、TNF-α、HMGB1水平高于对照组,差异有统计学意义(P<0.05),见表1。实验组患者术前血清Tg、TNF-α、HMGB1水平分别与术后血清Tg、TNF-α、HMGB1水平比较,差异有统计学意义(P<0.05),见表2。
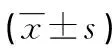
表1 实验组与对照组血清Tg、TNF-α、HMGB1水平比较
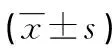
表2 实验组患者血清Tg、TNF-α、HMGB1水平术前与术后比较
2.2 实验组肿瘤不同直径状态下血清Tg、TNF-α、HMGB1水平比较 实验组肿瘤直径大于2 cm的患者血清Tg水平高于肿瘤直径小于或等于2 cm患者血清Tg水平,差异有统计学意义(P<0.05);肿瘤直径小于或等于2 cm患者血清TNF-α、HMGB1水平低于肿瘤直径大于2 cm患者血清TNF-α、HMGB1水平,差异有统计学意义(P<0.05),见表3。
2.3 实验组术后不同肿瘤病理类型患者血清Tg、TNF-α、HMGB1水平比较 实验组术后甲状腺滤泡状腺瘤患者血清Tg、TNF-α、HMGB1水平与甲状腺乳头状囊性腺瘤患者血清Tg、TNF-α、HMGB1水平比较,差异无统计学意义(P>0.05),见表4。
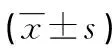
表3 实验组肿瘤不同直径状态下血清Tg、TNF-α、HMGB1水平的比较
2.4 血清Tg、TNF-α、HMGB1水平对甲状腺腺瘤的预测价值分析 血清Tg的AUC为0.725(95%CI为0.531~0.919,P=0.048),灵敏度和特异度分别为75.8%和58.2%;TNF-α的AUC为0.753(95%CI为0.578~0.927,P=0.026),灵敏度和特异度分别为80.4%和67.8%;HMGB1的AUC为0.750(95%CI为0.565~0.935,P=0.028),灵敏度和特异度分别为78.4%和64.1%;联合测定的AUC为0.815(95%CI为0.621~0.979,P=0.008),灵敏度和特异度分别为91.2%和84.7%,见表5及图1。
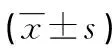
表4 实验组术后不同肿瘤病理类型患者血清Tg、TNF-α、HMGB1水平比较

表5 血清Tg、TNF-α、HMGB1单独及联合检测对甲状腺腺瘤的辅助诊断价值
注:-无数据。
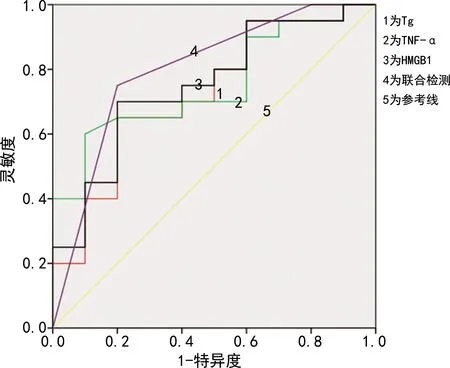
图1 血清Tg、TNF-α、HMGB1单独及联合检测诊断甲状腺腺瘤的ROC曲线
3 讨 论
甲状腺腺瘤是起源于甲状腺滤泡细胞的良性肿瘤;病程进展缓慢,多数为单发,占甲状腺肿瘤的70%~80%[11-12]。甲状腺腺瘤如未及时发现及治疗有诱发甲状腺功能亢进和恶变的可能。针刺病理学检查是甲状腺腺瘤最佳诊断方法,但细针穿刺活检具有创伤性,且术中受患者的依从性及检查受操作者技术水平的影响,往往穿刺诊断效果欠佳。因此,寻找一种检测方便、创伤小且诊断价值高的血清标志物对甲状腺腺瘤及时治疗至关重要。
Tg是一种相对分子质量约为660×103的糖蛋白,主要由甲状腺细胞合成并释放到甲状腺滤泡腔内[13]。在正常生理状态下,Tg水平较低,且受到促甲状腺激素(TSH)调控[14]。血清Tg水平升高与甲状腺结节的病情变化密切相关[15]。也有研究报道术前血清Tg水平可作为甲状腺结节恶变的预测因子[13]。TNF-α作为一种促炎细胞因子,具有多种生物活性。TNF-α对预测恶性肿瘤的术后复发具有重要意义。TNF-α是各种肿瘤发生、增殖,血管生成和转移的重要因素,对肿瘤具有促进作用[16]。同时,TNF-α也具有抗肿瘤作用,导致肿瘤细胞坏死,并且可抑制肿瘤血管形成,从而影响肿瘤细胞膜的渗透性,导致细胞凋亡。有研究表明,TNF-α可以对肿瘤的血管内皮细胞造成损伤,导致血管破裂,功能障碍或血栓形成;可阻止局部血液流向肿瘤组织而导致的出血或缺氧性坏死[16-17]。HMGB1作为一种非组蛋白,对DNA具有非特异性亲和力。它可以稳定核小体结构,并可参与DNA复制、转录和修饰[18]。在非恶性细胞中,HMGB1主要存在于细胞核内。HMGB1也被认为与肿瘤发生、发展密切相关[18]。HMGB1作为肿瘤细胞的关键调节因子,与机体免疫、炎症、代谢、增殖、血管生成、细胞凋亡、自噬、侵袭和转移等有关[19]。HMGB1通过调节多种信号通路,在促进细胞存活和死亡方面发挥重要作用,包括增殖、自噬、炎症、侵袭和转移。HMGB1在多种类型的恶性肿瘤中呈现高表达[20]。当前,关于甲状腺腺瘤的早期诊断临床缺乏准确的检测指标。因此,通过检测血清Tg、TNF-α、HMGB1水平来判断其对甲状腺腺瘤临床诊断价值,具有重要意义。
本研究结果表明,实验组患者检测的血清Tg、TNF-α、HMGB1水平高于对照组,且实验组患者术前血清Tg、TNF-α、HMGB1水平高于术后,差异均有统计学意义(P<0.05),表明血清Tg、TNF-α、HMGB1对甲状腺腺瘤的诊断有一定价值;肿瘤直径大于2 cm的患者检测的血清Tg、TNF-α、HMGB1水平高于肿瘤直径小于或等于2 cm患者,差异有统计学意义(P<0.05),表明甲状腺腺瘤的直径越大,血清Tg、TNF-α、HMGB1水平越高,诊断为甲状腺腺瘤的价值越高;滤泡状腺瘤患者检测的血清Tg、HMGB1水平高于乳头状囊性腺瘤患者,滤泡状腺瘤患者检测的血清TNF-α水平低于乳头状囊性腺瘤患者,差异均无统计学意义(P>0.05),表明血清Tg、TNF-α、HMGB1水平对诊断甲状腺腺瘤不同病理类型无意义。本研究用ROC曲线评估了血清Tg、TNF-α、HMGB1水平诊断甲状腺腺瘤的可行性,结果显示血清Tg、TNF-α、HMGB1联合检测诊断甲状腺腺瘤的灵敏度和特异度优于三者单独检测,血清Tg、TNF-α、HMGB1单独检测时AUC均大于0.5,说明血清Tg、TNF-α、HMGB1均有早期诊断甲状腺腺瘤的价值。但是,血清Tg、TNF-α、HMGB1联合检测更有利于甲状腺腺瘤的早期诊断和鉴别诊断,更有利于实现肿瘤早发现、早诊断、早治疗的目的。
4 结 论
综上所述,肿瘤直径越大,血清Tg、TNF-α、HMGB1水平越高,诊断为甲状腺腺瘤可能性越大;血清Tg、TNF-α、HMGB1联合检测诊断甲状腺腺瘤的灵敏度和特异度好,对甲状腺腺瘤的早期诊断具有临床辅助价值。
