产NDM ExPEC毒力与其耐药性和分子分型的关系研究*
2020-05-01冯丽娜李从荣姜树朋杨勇文
冯丽娜,李从荣,姜树朋,杨勇文,蔡 璇,李 娟,冯 锴,郭 静
(武汉大学人民医院检验医学中心,湖北武汉 430060)
自2010年在印度发现以来,多个国家陆续报道检出产新德里金属β-内酰胺酶(NDM)肠杆菌科细菌(又称“超级细菌”)[1]。这种“超级细菌”几乎对临床所有的抗菌药物耐药,导致感染此类细菌的患者具有很高的病死率,引起了全社会的广泛关注。肠外致病性大肠埃希菌(ExPEC)是中国最常见的致病性肠杆菌科细菌,可以表达多种β-内酰胺酶,包AmpC酶、产超广谱β-内酰胺酶(ESBLs)和碳青霉烯酶[2]。ExPEC产碳青霉烯酶,尤其是产NDM及其变体,成为重大的公共卫生问题[3]。此外,ExPEC能表达多种毒力因子,包括黏附素、毒素、多糖荚膜、脂多糖和蛋白酶,这些毒力因子在ExPEC入侵宿主、免疫防御及引起宿主损伤的过程中起着重要作用。多位点序列分型(MLST)是一种基于核酸序列测定的细菌分型方法,结合系统发育分群研究,可以对产碳青霉烯酶肠杆菌科细菌(CPE)进行同源性分析,了解其种系间的发生关系,寻找其变异、进化和传播的规律。由于细菌在获取耐药基因和毒力基因的方式上存在一定程度的共性,所以两者之间可能存在一定的联系[4]。本研究旨在分析产NDM ExPEC的毒力与ST型、系统发育分群和耐药性之间的关系。
1 材料与方法
1.1 材料来源 实验菌株分离自临床送检标本中的15株产NDM ExPEC(实验组)。对照菌株共28株(对照组),包括分离自临床送检标本中的5株对亚胺培南和(或)美罗培南不敏感[最小抑菌浓度(MIC)≥2 μg/mL]但不产NDM的ExPEC及同期分离自临床送检标本中的23株对亚胺培南和美罗培南均敏感(MIC<2 μg/mL)的ExPEC。剔除同一患者相同部位分离的重复菌株。质控菌株大肠埃希菌ATCC®25922和大肠埃希菌ATCC®35218(监控β-内酰胺酶/β-内酰胺酶抑制剂复合物),由原卫生部临床检验中心提供。用于检测的所有菌株均为转种于哥伦比亚血平板后在37 ℃、含5% CO2培养箱孵育16~24 h的新鲜菌株。
1.2 仪器与试剂
1.2.1 主要仪器 MALDI-TOF质谱仪[布鲁克(北京)科技有限公司]、全自动细菌鉴定药敏系统Phoenix-100(美国BD公司)、NanoDrop2000c分光光度计(美国Thermo公司)、T100TMPCR仪(美国Bio-Rad公司)、DYY-6C型电泳仪(北京六一仪器厂)、G:BOX Chemi XT4全自动凝胶成像分析系统(英国SYNGENE公司)。
1.2.2 主要试剂 哥伦比亚血平板和MH琼脂平板(广州市迪景微生物科技有限公司)、药敏纸片(英国OXOID公司)、2×Taq PCR Master Mix和无核酶水(上海莱枫公司)、PCR 引物(武汉金开瑞生物合成有限公司)、Gel-Red核酸染料(北京Biotech公司)、DL1000 DNA Marker(大连宝生物公司)、亚胺培南粉末(海正辉瑞制药有限公司)、基质(德国BrukerDaltonik公司)。
1.3 方法
1.3.1 菌株鉴定及药物敏感性检测 菌株鉴定和药物敏感性检测采用Phoenix-100全自动细菌鉴定药敏系统,基质辅助激光解吸电离飞行时间(MALDI-TOF)质谱仪复核鉴定结果,对于Phoenix-100全自动细菌鉴定药敏系统检测亚胺培南和(或)美罗培南的MIC ≥ 2 μg/mL的菌株,采用纸片法(K-B)法和(或)E-test法复核亚胺培南和美罗培南的药敏结果。试验操作及结果解释参照美国临床和实验室标准化协会(CLSI) M100(第28版)标准[5]。
1.3.2 碳青霉烯酶基因检测 检测方法参考文献[6]。
1.3.3 毒力基因检测 PCR检测15株产NDM和28株不产NDM ExPEC的7种毒力基因(aer、hly、papA、fimH、sat、fyuA和ompT),用于基因扩增的引物委托武汉金开瑞生物工程有限公司合成。引物序列见表1。PCR反应体系见表2,扩增条件为95 ℃预变性5 min,95 ℃ 30 s、60 ℃ 30 s、72 ℃ 30 s循环32次,72 ℃延伸10 min,4 ℃保存。PCR产物经2.0%琼脂糖凝胶电泳(90 V×40 min)后,在凝胶成像系统中进行观察。χ2检验比较7种毒力基因在两组菌株中的分布差异。

表1 毒力基因和管家基因基因扩增引物

续表1 毒力基因和管家基因基因扩增引物
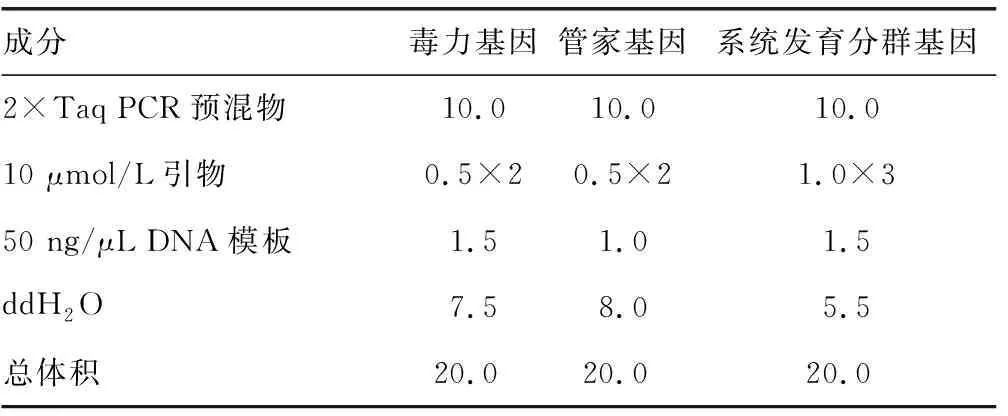
表2 基因检测PCR反应体系加样量(μL)
1.3.4 MLST研究 对15株产NDM ExPEC进行MLST分型研究。用于MLST分型的7个管家基因的引物序列下载自http://www.mlst.net/网站,引物委托武汉金开瑞生物工程有限公司合成。引物序列见表1。PCR反应体系见表2,扩增条件为95 ℃预变性5 min,95 ℃ 30 s、62 ℃ 30 s、72 ℃ 30 s循环32次,72 ℃延伸10 min,4 ℃保存。PCR产物经2.0%琼脂糖凝胶电泳(90 V×40 min)后,在凝胶成像系统中进行观察。PCR产物委托武汉金开瑞生物工程有限公司进行双向测序(Sanger法),Chromas Version 2.6查看测序结果,SeqMan Pro对正反向测序结果进行剪切和拼接后,提交到pubmlst网站得到等位基因号和序列型(ST型)。将7个管家基因的序列按照adk、fumC、gyrB、icd、mdh、purA、recA的先后顺序拼接后,运用ClustalXV2.0[7]进行比对,MEGA6.06[8]生成进化树(邻接法)。
1.3.5 系统发育分群研究 运用多重PCR对15株产NDM ExPEC进行系统发育分群。检测系统发育分群基因ChuA、YjaA和TspE4C2,将产NDM ExPEC分为A、B1、B2和D这4个群[9],引物序列见表3,PCR反应体系见表2。PCR扩增条件为:95 ℃预变性5 min,95 ℃ 30 s、55 ℃ 30 s、72 ℃ 30 s循环30次,72 ℃延伸10 min,4 ℃保存。
1.4 统计学处理 采用SPSS20.0统计软件进行数据分析,计数资料以例数表示,χ2检验比较7种毒力基因(aer、hly、papA、fimH、sat、fyuA、ompT)在15株产NDM ExPEC菌株和同期分离的28株不产NDM ExPEC菌株中的分布差异,P<0.05表示差异有统计学意义。
2 结 果
2.1 菌株分布 15株产NDM ExPEC主要分离自尿液标本(8例),检出的科室以泌尿外科(5例)和肿瘤科(3例)为主。
2.2 对抗菌药物的敏感性检测 15株产NDM ExPEC对临床常用抗菌药物氨苄西林、氨苄西林/舒巴坦、阿莫西林/克拉维酸、哌拉西林、哌拉西林/他唑巴坦、头孢唑林、头孢他啶、头孢噻肟、头孢吡肟、复方磺胺甲噁唑、亚胺培南和美罗培南的耐药率均为100%,绝大部分菌株对氨曲南、庆大霉素、环丙沙星、莫西沙星、左氧氟沙星、氯霉素和四环素耐药。
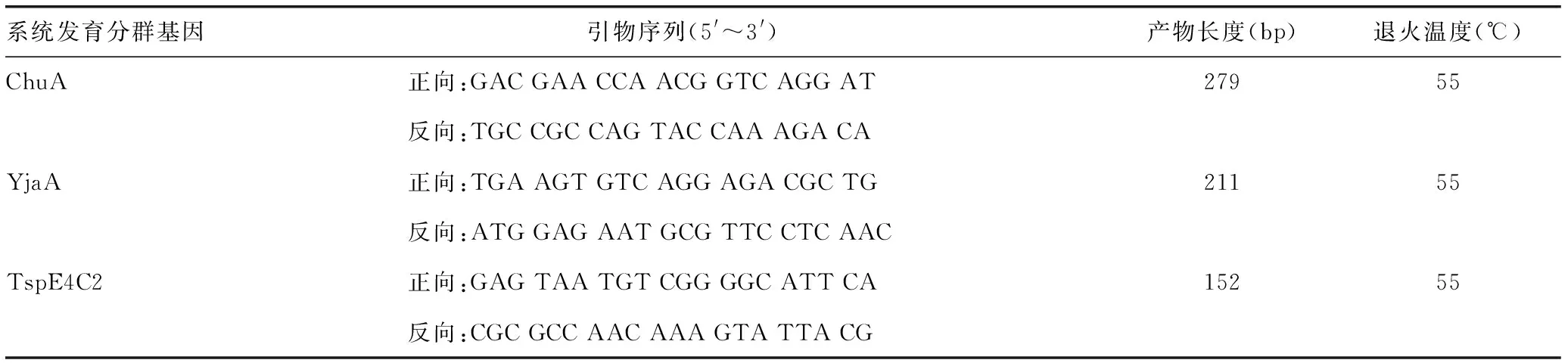
表3 系统发育分群基因扩增引物
2.3 基因型检测 15株产NDM ExPEC中,11株产NDM-5型(73.3%),4株产NDM-1型(26.7%)。
2.4 系统发育分群和MLST分型 系统发育分群结果显示,15株产NDM ExPEC中,13株属于A群,2株属于D群。MLST分型结果显示,ST410是检出率最高的ST型(5株,33.3%),见图1。

注:运用邻接法,由7个管家基因的串联序列构建进化树;进化树中主要包含ST10和ST23两个复合群,ST10 复合群中有ST167和ST617两个序列型,ST23复合群中只有 ST410 1个序列型。
图1 15株产NDM ExPEC的MLST分型
2.5 毒力基因 实验组中毒力基因fimH检出率最高,对照组毒力基因sat、fyuA和ompT检出率高于实验组,差异有统计学意义(P<0.05),见表4。

表4 两组毒力基因的检出率[n(%)]

续表4 两组毒力基因的检出率[n(%)]
3 讨 论
近年来,随着blaNDM——一种质粒介导的碳青霉烯类抗菌药物耐药基因在世界范围内的广泛传播,由多重耐药菌感染引起的临床和公共健康问题的范围进一步扩大[10]。本院分离的15株产NDM,包括NDM-1和NDM-5型两种类型。NDM-5检出率高于NDM-1型,这与相关研究结果一致[11]。多种革兰阴性菌可以产NDM-1,尤其是肠杆菌科细菌和不动杆菌属细菌[12]。通过在不同位置氨基酸残基的取代,NDM-1可以衍生出新的变体[3],NDM-5是NDM-1的变体之一[13],目前并没有太多关于NDM-5的研究报道。迄今为止,已有17种NDM-1的变体被检出[3]。产NDM细菌对几乎所有临床常用抗菌药物耐药。NDM可以广泛水解青霉素类、头孢菌素类、氨基糖苷类、喹诺酮类,尤其是碳青霉烯类抗菌药物。有研究表明,NDM-5比NDM-1具有更强的水解碳青霉烯类抗菌药物的能力[14-15]。由于菌株数量的限制,本研究并没有做相关比较。但值得注意的是,对产NDM菌株感染的治疗选择是非常有限的,这必须引起足够的重视。
已有的系统发育分群研究将大肠埃希菌分为4个系统发育群:A、B1、B2和D[16]。研究表明,人体正常寄生菌株通常属于A群和B1群,而毒力菌株通常属于B2群和D群,这些毒力菌株含有可以编码毒力因子的基因或毒力岛[17-18]。有研究指出,大多数的ExPEC属于B2群,少数属于D群[2]。而本研究结果显示,在15株产NDM ExPEC中,有13株属于A群,2株属于D群,表明本院绝大多数产NDM ExPEC属于毒力较小的系统发育群,这可能是由于其NDM编码基因的获取影响了毒力基因的表达。
ExPEC能表达多种毒力因子,这些毒力因子可大致分为两类:细菌表面毒力因子和细胞毒因子。细菌表面毒力因子有助于ExPEC菌株的入侵、黏附、移动和免疫防御,如黏附素、多糖荚膜、脂多糖等,而细胞毒因子则可以引起宿主细胞不同程度的损伤,如溶血素、细胞毒素等。黏附素Ⅰ型菌毛(编码基因fimH)和P菌毛(编码基因papA)可以促进细菌在物体表面的黏附;铁载体产气杆菌素(编码基因aer)和耶尔森菌素(编码基因fyuA)是一类用于摄取铁元素的低相对分子质量化合物;大肠埃希菌溶血素(编码基因hly)是破坏细胞膜导致细胞裂解的蛋白质和脂质;分泌性自转运蛋白毒素(编码基因sat)是肠杆菌科细菌中发现的丝氨酸蛋白酶自动转运家族蛋白中的一种;外膜蛋白酶(编码基因ompT)是在肠杆菌科细菌外膜中发现的天冬氨酸蛋白酶。本研究检测这7种毒力因子编码基因在15株产NDM ExPEC和28株不产NDM ExPEC中的分布。毒力基因fimH、aer、papA和hly在两组细菌间的分布差异无统计学意义(P>0.05),而sat、fyuA和ompT在不产NDM ExPEC中的检出率要高于产NDM ExPEC中的检出率。虽然产NDM ExPEC的耐药性强,但其携带的毒力基因反而较少,这与系统发育分群结果一致。同样有研究显示,多重耐药菌株的毒力要远小于敏感菌株[19]。一些毒力因子(如蛋白酶、黏附素和铁摄取系统等)的作用并不典型,它们并不直接导致感染,而是提升细菌的竞争力和适应能力从而有助于其在人体的定植[20]。
MLST分型结果显示,15株产NDM ExPEC中检出8种不同的ST型,以ST410最为常见。ZHANG等[21]对中国25个地区收集的887株CPE进行MLST分型,产NDM大肠埃希菌中最常见的ST型为ST167,其次为ST410,其中湖北省产NDM大肠埃希菌中最常见的ST型为ST410,与本研究结果一致。有研究显示,ST131、ST38、ST69、ST155、ST393、ST405和ST648是国际多重耐药高危克隆大肠埃希菌常见的几种ST型,其中以ST131最为常见[22]。这种多重耐药、危险性高的菌株在许多国家均有检出[23]。研究发现,ST131菌株比非ST131菌株的总体毒力评分更高,并且一些毒力基因如usp、ompT、sat、iutA、malX与ST131密切相关。DOBRINDT等[24]发现,与非ST131 ExPEC相比,ST131 ExPEC的某些毒力基因如sat、iutA、malX、usp、iha、hra、ompT持续高表达。2010年在芝加哥和巴黎的ST131菌株中检测到blaNDM[25-26],本院未检出产NDM的ST131 ExPEC。本研究检出1株多重耐药高危克隆型别ST648,早在2011年,就有研究发现,ST648与菌株产NDM有关[13,27];此外,ST648还与产ESBLs大肠埃希菌引起的感染有关[28]。
4 结 论
综上所述,产NDM ExPEC菌株的系统发育分群、MLST分型和毒力基因研究得出的结论基本一致,即本院绝大多数产NDM ExPEC菌株的毒力较弱,菌株耐药性强并不意味着其致病性也强,相反,耐药基因的获取可能会影响毒力基因的表达,从而导致其致病性减小。对产NDM ExPEC菌株进行流行病学监测,有助于早期发现多重耐药高危克隆菌株,从而采取及时的感染控措施,防止其暴发流行。
