“小题大做”突破电解质溶液中的平衡图像题
2020-05-01谢美珊
■谢美珊
2019年全国卷化学考试大纲明确指出:“学生需具备通过对图形、图表的阅读,获取有关的感性知识和印象,并进行初步加工、吸收、有序存储的能力;从提供的新信息中,准确地提取实质性内容,并与已有知识整合,重组为新知识的能力”。电解质溶液中的平衡图像题是高三学生化学备考的重、难点之一。本文通过分析两道全国卷理综化学试题的特点,采取“小题大做”的方式,层层递进,突破学生的疑点,以帮助学生提高高三化学的复习效率。
一、近四年全国卷理综化学试题涉及电解质溶液中的平衡图像题的考查内容及命题规律分析
从近四年的全国卷理综化学试题涉及电解质溶液的考查情况分析,选择题中必有一题,命题情境主要以坐标图的形式给予解答问题所需的信息。考点设置上,既包括对中和反应、弱电解质电离、盐类水解、溶液导电能力的影响因素、混合溶液中离子浓度大小的比较、沉淀溶解平衡的影响因素等知识点的考查,也包括对数学图形信息提取、定量推理等能力的考查。
二、“小题大做”,拓展考点,梯度上升,提升能力
选择题涉及的电解质溶液中的平衡图像题综合性强,大多数考生存在畏难情绪,基础较差的考生甚至随意选取答案。同样的题目学生经过几次练习后,正确率并无明显提升。笔者通过不断反思和尝试,发现若将该类选择题改编成填空题,每个图像可以承载多个不同的选项,设置梯度、拓展考点由易到难,可以帮助学生懂一题会一类,使得学生变得乐学且对该类题目的分析能力增强,再遇到类似题目时能够静心分析,不随意选择。此类试题经过“小题大做”改编训练后,很多学生的做题正确率都有了明显的提升。
三、联系已知,巧用信息,分类突破,建构模型
电解质溶液中的平衡图像题的类型可分为酸碱中和滴定曲线、难溶电解质的沉淀溶解平衡曲线、分布系数图等。下面以滴定曲线为例进行分析,首先学生要了解横、纵坐标的代表意义;然后观察各曲线的变化趋势(其中对比曲线找出同一条件下曲线之间的差别与联系,多曲线时注意分析曲线变化的原理和交点);最后结合选项理解各特殊点(如零点、中和点、中性点)的含义并以此作为答题的突破口,逐步建构答题的思维模型。
滴定曲线包括中和滴定、氧化还原滴定等,其中中和滴定是高考的热点,近四年的全国Ⅰ卷理综化学均考查了这一热点,虽然载体不同,但答题模式有迹可循。学生只要熟练掌握基础知识,仔细分析题干或图表,准确提取信息,就可以找到解题的突破口,从而顺利解答试题。
例1(pH-lgc图)(2017年高考全国Ⅰ卷理综第13题改编)常温下将NaOH 溶液添加到己二酸(H2X)溶液中,混合溶液的pH 与离子浓度变化的关系如图1所示。
(1)曲线_____(填“M”或“N”)表示pH 与_____的变化关系。
(2)Ka2(H2X)的数量级为____。
(3)NaHX 溶液中,c(H+)_________c(OH-)(填“>”“<”或“=”)。
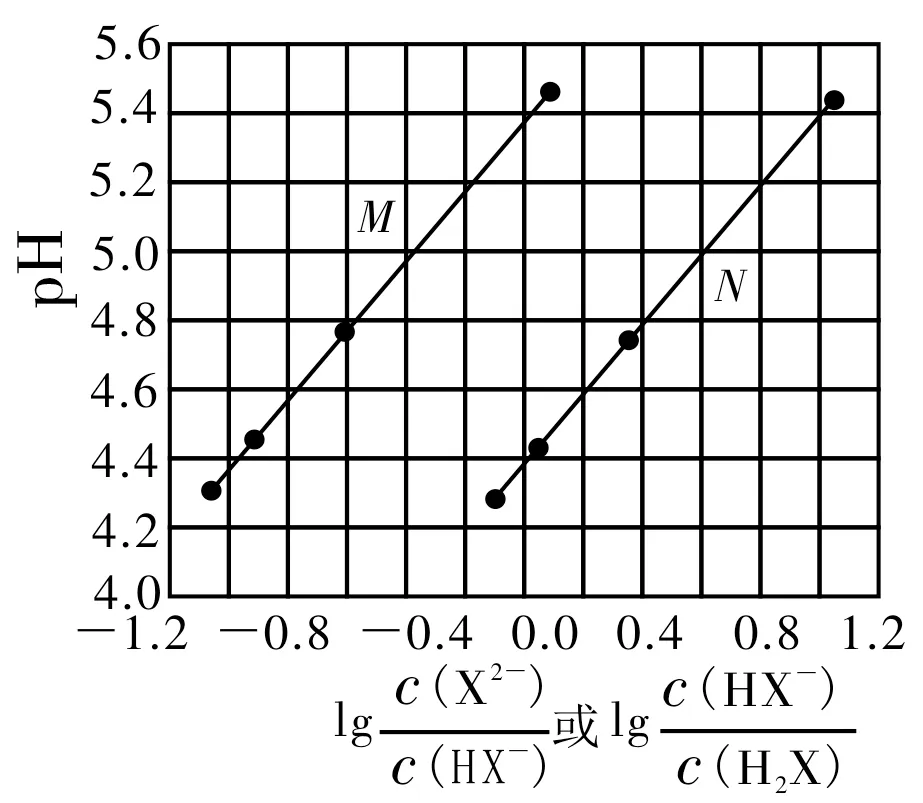
图1
(4)当溶液的pH=4.6时,c(HX-)_____c(X2-)(填“>”“<”或“=”)。
(5)当混合溶液呈中性时,X2-、Na+、HX-、H+、OH-的离子浓度大小关系为_____。
解题策略:准确地从图中获取信息是解答此类陌生试题的关键。横坐标为0.0 时(突破口),溶液中的c(X2-)=c(HX-),c(HX-)=c(H2X),因为Ka1(H2X)>Ka2(H2X),故c(H+)大(即pH 小)的为第一步电离,即曲线N代表第一步电离,曲线M代表第二步电离。当c(X2-)=c(HX-)时,Ka2=c(H+)≈10-5.4,所以Ka2(H2X)的数量级为10-6,此时溶液中NaHX、Na2X 的浓度相等,故NaHX 溶液中的c(H+)>c(OH-)。pH=4.6 时,由图可知,即溶液中的,故c(X2-)<c(HX-)。当溶液的pH=7(中性点)时,由曲线M可知,,即溶液中的,故c(Na+)>c(X2-)>c(HX-)>c(H+)=c(OH-)。当,即溶液中的时,c(HX-)=c(H2X)。
例2(电导率-V图)(2019年高考全国Ⅰ卷理综第11 题改编)用NaOH 溶液滴定邻苯二甲酸氢钾(邻苯二甲酸氢钾H2A 的Ka1=1.1×10-3,Ka2=3.9×10-6)溶液,混合溶液的相对导电能力变化曲线如图2 所示,其中b点为反应终点。
(1)混合溶液的导电能力与离子的浓度和种类有关,滴定至终点时发生的化学反应方程式为____。
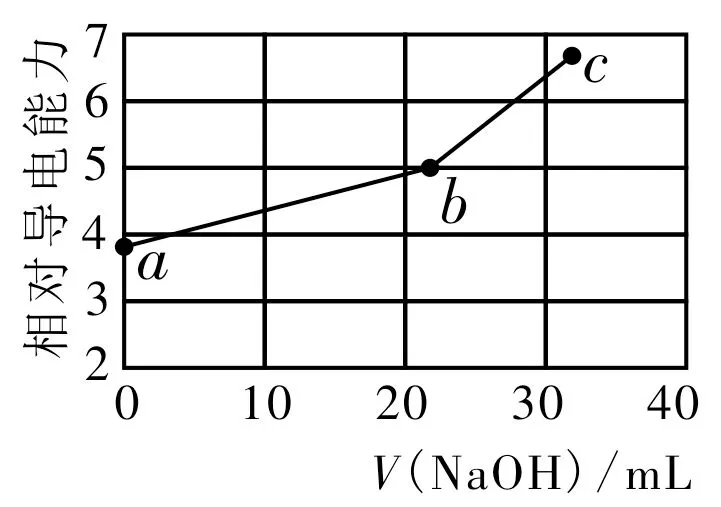
图2
(2)a、b、c三点的溶质分别是____。
(3)常温下,b点混合溶液的pH_____7(填“>”“<”或“=”)。
(4)Na+与A2-的导电能力之和____HA-的(填“大于”“小于”或“等于”)。
(5)c点的混合溶液中,Na+、K+、OH-、H+的离子浓度大小关系为____。
(6)在相同温度下,a、b、c三点溶液中水电离出的c(H+)由小到大的顺序为____。
解题策略:导电能力和加入NaOH 溶液的体积、溶液中离子浓度大小的关系是解题的关键。根据题干信息可以书写出滴定至终点时发生反应的化学方程式,为2NaOH+2KHA==K2A+Na2A+2H2O,从而推知a、b、c三点的溶质。常温下,b点的混合溶液其pH>7,由方程式可知,滴定的过程中,c(K+)、c(HA-)减小,而导电能力上升,说明Na+、A2-的导电能力强于HA-的。滴定至终点时,c(Na+)<c(K+),由b点滴定至c点时,加入的NaOH 溶液体积较小,可得c(Na+)>c(K+)>c(OH-)>c(H+)。
在高三二轮复习中,汇集各种类型的电解质溶液中的平衡图像题,可以帮助学生形成一个全面的认识。再根据薄弱知识进行“小题大做”的不断强化,更新题目载体,可以加强学生适应新信息的能力,从而熟练应用已有知识和模型顺利解答题目。
四、展望未来高考电解质溶液中的平衡图像题的命题趋势
一是在基础知识和基本能力上延续稳定的考查频率,例如对溶液中离子浓度大小的比较、平衡常数的计算及其应用等的考查;二是增加陌生物质和陌生横、纵坐标的含义在题中并存的情况;三是增强在图像题的基础上对数据的定量分析考查。
综合以上分析,学生在高三复习备考过程中,要在平时的训练中严格要求自己,掌握扎实的基础知识,根据对应的题型,合理分析图像和题干的信息,选准题目的突破口,选取合适的方法和技巧,只要落实好各个环节,电解质溶液中的平衡图像题一定能有所突破。
