扶正化瘀方对脂多糖诱导的RAW264.7巨噬细胞M1型炎性极化JNK通路的影响
2020-04-30张满胡旭东黄恺陶艳艳彭渊刘成海
张满 胡旭东 黄恺 陶艳艳 彭渊 刘成海


摘要:目的 觀察扶正化瘀方对脂多糖(LPS)诱导的M1型RAW264.7巨噬细胞一氧化氮合酶(iNOS)基因和一氧化氮(NO)分子过表达的影响,探讨其可能的抗炎机制。方法 采用LPS刺激小鼠RAW264.7巨噬细胞,建立M1型巨噬细胞炎性细胞模型,分别给予扶正化瘀方50、100、200 μg/mL和10 nmol/L JNK蛋白抑制剂SP600125进行孵育。Griess法检测炎症介质NO含量,RT-PCR检测炎症因子白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)和iNOS基因表达,Western blot检测iNOS蛋白表达和MAPK信号通路中JNK、p38、ERK蛋白的磷酸化水平。结果 与LPS比较,扶正化瘀方和SP600125均显著降低巨噬细胞中NO分泌(P<0.01)和iNOS蛋白表达(P<0.01),降低MAPK信号通路JNK蛋白的磷酸化水平(P<0.05,P<0.01);扶正化瘀方对炎症因子IL-6、TNF-α的基因表达及MAPK信号通路ERK、p38蛋白的磷酸化水平无明显影响。结论 扶正化瘀方可能通过抑制JNK蛋白的磷酸化而抑制iNOS基因过表达,最终减少NO的生成,从而抑制RAW264.7巨噬细胞M1型极化,发挥抗炎作用。
关键词:扶正化瘀方;巨噬细胞;一氧化氮;一氧化氮合酶;MAPK信号通路;JNK信号通路
中图分类号:R285.5 文献标识码:A 文章编号:1005-5304(2020)03-0043-05
DOI:10.3969/j.issn.1005-5304.201909314
Effects of Fuzheng Huayu Prescription on LPS-induced Inflammatory M1 Polarization of RAW264.7 Macrophages Through JNK Pathway
ZHANG Man1, HU Xudong2, HUANG Kai1, TAO Yanyan1, PENG Yuan1, LIU Chenghai1,3,4
1. Institute of Liver Diseases, Shuguang Hospital Affiliated to Shanghai University of Traditional Chinese Medicine, Shanghai 201203, China; 2. School of Basic Medical Sciences, Shanghai University of Traditional Chinese Medicine, Shanghai 201203, China; 3. Key Laboratory of Liver and Kidney Diseases of Shanghai University of Traditional Chinese Medicine, Ministry of Education, Shanghai 201203, China; 4. Shanghai Key Laboratory of Clinical Chinese Medicine, Shanghai 201203, China
Abstract: Objective To explore the effects of Fuzheng Huayu Prescription on iNOS gene overexpression and NO overproduction in M1 polarized RAW264.7 macrophages induced by lipopolysaccharide (LPS); To discuss its possible anti-inflammatory mechanism. Methods LPS was used to stimulate mouse RAW264.7 macrophages to establish an inflammatory M1 macrophage model, and Fuzheng Huayu Prescription (50, 100, 200 μg/mL) and 10 nmol/L JNK inhibitor SP600125 were incubated respectively. Inflammatory mediator NO production was measured by Griess method. The mRNA expressions of inflammatory cytokines IL-6, TNF-α and iNOS were detected by Real-time RT-PCR. iNOS protein expression and the phosphorylation levels of key proteins in MAPK signaling pathway, namely p-JNK, p-p38 and p-ERK were detected by Western blot. Results Compared with LPS, Fuzheng Huayu Prescription and SP600125 could significantly reduce the overproduction of NO (P<0.01), the overexpression of
![]()
iNOS protein (P<0.01) and the phosphorylation levels of JNK protein (P<0.05, P<0.01) in MAPK signaling pathway in macrophages. Fuzheng Huayu Prescription had no significant effect on the mRNA expressions of inflammatory cytokines IL-6 and TNF-α in LPS-induced macrophages, and the phosphorylation levels of ERK and p38 proteins in MAPK signaling pathway. Conclusion Fuzheng Huayu Prescription exerts its anti-inflammatory-M1 - polarization effect on RAW264.7 macrophages through inhibiting iNOS gene overexpression and NO overproduction by repressing JNK phosphorylation.
Keywords: Fuzheng Huayu Prescription; macrophage; NO; iNOS; MAPK signaling pathway; JNK signaling pathway
慢性肝病進展中,肝脏炎症(inflammation)→纤维化(fibrosis)→癌症(cancer)所构成的IFC轴线越来越被人们重视[1],肝内M1型巨噬细胞炎性极化是肝纤维化发生的始动因素和肝纤维化进展的促进要素。因此,抑制肝脏中肝内M1型巨噬细胞炎性极化,从而减轻肝脏炎症损伤,是肝纤维化乃至肝癌防治中的重要目标。扶正化瘀方由上海中医药大学附属曙光医院肝病研究所研制,临床广泛用于抗肝纤维化。研究表明,扶正化瘀方治疗慢性乙型肝炎肝纤维化6个月后,在逆转肝纤维化的同时明显改善肝组织炎症[2],但其抗炎分子机制尚未阐明。我们前期研究发现,扶正化瘀方能显著抑制M1型巨噬细胞中炎症介质一氧化氮(NO)生成。在M1型巨噬细胞中,诱导型一氧化氮合酶(iNOS)催化L-精氨酸分解产生NO[3],而MAPK信号通路则是调控iNOS基因表达的重要信号通路[4]。本研究拟探讨扶正化瘀方通过调控MAPK信号通路减少NO生成从而抑制M1型巨噬细胞炎性极化的可能抗炎机制。
1 实验材料
1.1 药物
扶正化瘀方浸膏粉,上海黄海制药有限责任公司,批号180206。质控标准:褐色粉末,味苦、涩;每克含发酵草菌粉以腺苷不少于1000 g/批,丹参以丹参素钠不少于3000 g/批,丹酚酸B不少于5000 g/批,水分少于8.0%,需氧菌总数不超过1000 cfu/g,霉菌、酵母菌总数不超过100 cfu,大肠埃希菌不得检出。
1.2 细胞株及主要试剂
RAW264.7巨噬细胞株,购自中国科学院干细胞库(编号SCSP-5036)。DMEM高糖培养基、胎牛血清(美国Gibco公司),链霉素、青霉素均(ScienCell公司),CCK8细胞试剂盒(上海翊圣生物科技有限公司),二甲基亚砜(DMSO,Corning公司),脂多糖(LPS,美国Sigma公司),JNK抑制剂SP600125,(MCE公司),总RNA提取试剂盒(上海生工生物工程股份有限公司),反转录试剂盒(货号RR047A,TaKaRa公司),扩增试剂盒(货号RR420A,TaKaRa公司),BCA蛋白定量试剂盒(货号23227,Pierce化学公司),iNOS抗体(Abcam公司),p-JNK、p-ERK和p-p38抗体(美国CST公司),山羊抗鼠和山羊抗兔的荧光二抗(LI-COR公司),GAPDH抗体(Proteintech公司)。
1.3 仪器
Odyssey红外荧光扫描成像系统,美国LI-COR公司;垂直板电泳槽、半干电转印系统,美国Bio-Rad公司;ABIViiA7型荧光定量PCR仪,美国ABI公司;多功能酶标仪,美国Bio-Tek公司。
2 实验方法
2.1 细胞培养
将RAW264.7细胞以合适的浓度接种于10 cm培养皿中,根据实验需要接种不同数量细胞于6、96孔细胞培养皿中,置于含10%FBS DMEM培养基,37 ℃、5%O2、95%湿度培养箱中培养。传代时吸走部分培养液,留下3~4 mL培养液,用无菌细胞刮板刮拭培养皿表面,将细胞刮落,吹打后接种到新的装有新鲜培养液的培养皿中进行传代。
2.2 CCK8法检测扶正化瘀方细胞毒性
RAW264.7细胞接种至96孔板,调整细胞数量为5×104个/孔,细胞种板后,分别加入2、5、50、100、200、400、1000 μg/mL不同浓度扶正化瘀方,每个浓度设置6个复孔,将接种好的细胞置于培养箱中孵育24 h后弃去上清液,每孔加100 μL 10% CCK8继续培养2 h,在波长450 nm/630 nm处测吸光度,计算细胞存活率,评价扶正化瘀方的细胞毒性。
2.3 细胞分组
体外培养RAW264.7细胞接种于6孔板,根据实验需要设计正常组、正常+扶正化瘀方组、LPS组、LPS+扶正化瘀方(50、100、200 μg/mL)组和JNK抑制剂组,每组设3个复孔。细胞种板后,LPS组和LPS+扶正化瘀方组给予1 μg/mL LPS刺激,JNK抑制剂组给予10 nmol/L SP600125刺激,随后LPS+扶正化瘀方组给予不同浓度扶正化瘀方(50、100、200 μg/mL)孵育24 h。收集培养上清液和细胞备用。
2.4 Griess法检测一氧化氮生成
0.1%N-(1-萘基)乙二胺鹽酸盐(以ddH2O溶解)和1%磺胺(以5%H3PO4溶解)按1∶1混合即为Griess试剂,并以NaNO2制作标准曲线。100 μL Griess试剂与100 μL细胞上清混合,10 min后检测OD540 nm吸光度,根据标准曲线拟合公式计算样本中NO浓度。
2.5 RT-PCR实验
收集细胞,加入Trizol裂解细胞,提取总RNA,反转录和扩增试剂盒合成cDNA和cDNA扩增。采用2-ΔΔCt法进行分析定量。以β-actin为内参,检测巨噬细胞中白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)和iNOS基因的表达。所有引物由上海生工生物工程股份有限公司合成,引物序列见表1。
2.6 Western blot实验
收集细胞后,加入含有磷酸酶抑制剂和蛋白酶抑制剂RIPA裂解液冰上裂解30 min,4 ℃、12 000×g离心15 min,收取上清液。BCA法蛋白定量后进行蛋白变性、电泳、转膜、封闭。分别加入1∶250稀释的iNOS抗体,1∶1000稀释的p-JNK、p-ERK和p-p38抗体,4 ℃孵育一抗过夜。荧光标记的二抗室温避光孵育60 min,Odyssey红外成像系统扫描读取目的条带。以GAPDH为内参,检测样本中iNOS、p-JNK、p-ERK、p-p38的蛋白含量。
3 统计学方法
采用SPSS21.0统计软件进行分析。实验数据以x(—)±s表示,多样本均数间比较采用ANOVA检验。P<0.05表示差异有统计学意义。
4 结果
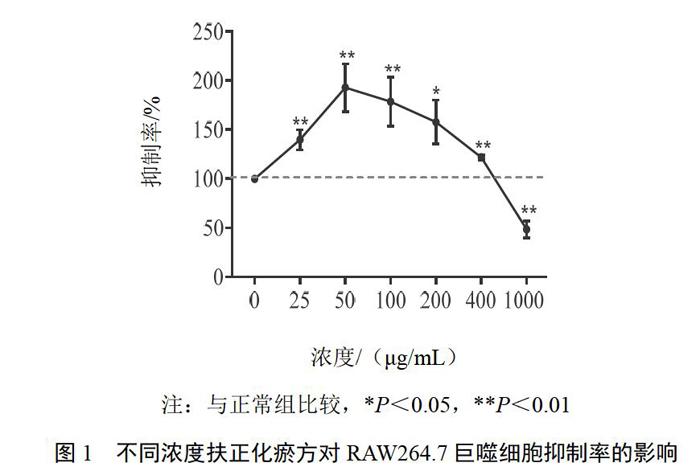
4.1 扶正化瘀方对RAW264.7巨噬细胞抑制率的影响
与正常组比较,扶正化瘀方在1000 ?g/mL浓度时对RAW264.7巨噬细胞有显著抑制作用,而在25~400 ?g/mL浓度范围对RAW264.7细胞无明显毒性。结果见图1。因此,在后续实验中选用扶正化瘀方50、100、200 μg/mL作为工作浓度。
![]()
4.2 扶正化瘀方对脂多糖诱导的RAW264.7巨噬细胞一氧化氮合酶、白细胞介素-6、肿瘤坏死因子-α基因表达的影响
与正常组比较,LPS诱导RAW264.7巨噬细胞中炎症相关因子iNOS、IL-6和TNF-α基因表达显著升高,差异有统计学意义(P<0.01);与LPS组比较,扶正化瘀方各浓度组IL-6、TNF-α基因表达无明显变化,但能明显下调iNOS基因的表达,差异有统计学意义(P<0.05,P<0.01),尤以扶正化瘀方200 μg/mL浓度时最为显著,差异有统计学意义(P<0.01)。结果见图2。
4.3 扶正化瘀方对脂多糖诱导的RAW264.7巨噬细胞一氧化氮合酶蛋白表达和一氧化氮生成的影响
与LPS组比较,扶正化瘀方在200 μg/mL浓度时能显著抑制iNOS蛋白表达(P<0.01);同时呈剂量依赖性减少细胞培养上清液中的NO生成(P<0.01)。结果见图3。
4.4 扶正化瘀方对脂多糖诱导的RAW264.7巨噬细胞MAPK信号通路活化的影响
与正常组比较,LPS刺激RAW264.7细胞可促进MAPK信号通路中p38、JNK、ERK蛋白的磷酸化,差异有统计学意义(P<0.05);与LPS组比较,扶正化瘀方能显著抑制JNK蛋白磷酸化(P<0.05),对p38、ERK蛋白磷酸化仅有抑制趋势,但差异无统计学意义(P>0.05)。结果见图4。
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
4.5 JNK蛋白抑制劑SP600125对脂多糖诱导的RAW264.7巨噬细胞一氧化氮合酶蛋白表达和一氧化氮生成的影响
与LPS组比较,JNK蛋白抑制剂SP600125显著下调巨噬细胞JNK蛋白的磷酸化(P<0.05,P<0.01),同时降低巨噬细胞iNOS蛋白的表达(P<0.05)和NO的生成(P<0.01)。结果见图5。
5 讨论
扶正化瘀方由丹參、桃仁、绞股蓝、松花粉、冬虫夏草菌丝和五味子组成,广泛应用于治疗肝纤维化和肝硬化[5]。在肝纤维化和肝硬化进程中,慢性肝脏炎症是激发肝纤维化的关键先决条件[6]。肝脏发生炎症时,肝内巨噬细胞被各种体内外刺激因素激活,主要以M1型功能状态存在,通过促炎介质进一步加重肝细胞的损伤和炎症,同时通过分泌各种纤维生成介质激活肝星状细胞(HSCs),从而促进肝纤维进展[7-8]。因此,通过抑制肝内巨噬细胞M1型极化从而减轻肝脏炎症损伤、减少HSCs细胞活化,从源头阻断IFC轴线病理进程。本课题既往研究表明,扶正化瘀方能抑制从CCl4损伤大鼠分离培养的肝Kupffer巨噬细胞中促纤维化因子转化生长因子-β和血小板衍生因子的表达[9],还可通过调节Kupffer巨噬细胞旁分泌从而抑制HSCs的活化[10]。
巨噬细胞是一种机体内广泛分布的固有免疫细胞,在炎症和免疫过程中发挥十分重要的作用[11]。巨噬细胞可根据表型及功能变化分为促炎的M1型和抑炎的M2型[12-13]。巨噬细胞受LPS刺激后向促炎的M1型极化,细胞内iNOS基因表达增强,iNOS大量增加,从而催化精氨酸分解生成过量NO。过量NO与O2-生成的过氧化亚硝酸盐通过强烈过氧化作用导致细胞死亡、广泛的组织损伤和病理变化。因此治疗NO参与的炎症性疾病,iNOS基因表达和活性调控是最直接和关键的靶点。本研究表明,与LPS诱导的M1型巨噬细胞比较,扶正化瘀方能显著抑制M1型巨噬细胞中NO的生成,且呈明显剂量依赖性;同时,扶正化瘀方在浓度为200 μg/mL时显著抑制NO关键合成酶iNOS的基因表达,而对IL-6、TNF-α基因表达无影响。
Toll样受体(TLR)参与机体防御入侵病原体的第一线,在炎症、免疫细胞调节生存和增殖中具有重要作用。TLR4受LPS刺激活化后触发下游的MAPK信号通路,对巨噬细胞内iNOS基因的过表达具有关键调控作用[14]。MAPK由一组丝氨酸/苏氨酸蛋白激酶组成,在被细胞外各种刺激活化后介导从细胞表面到核内的信号传递。在哺乳动物细胞内有3条已被明确定义的MAPK信号通路:JNK、ERK、p38。LPS和其他促炎因子能诱导MAPK信号通路相关蛋白磷酸化并进入核内,触发核内iNOS基因表达。本实验结果显示,与正常组比较,LPS能显著促进M1型巨噬细胞中JNK、ERK、p38蛋白的磷酸化,促进iNOS基因和蛋白表达以及NO产生;而扶正化瘀方对ERK、p38蛋白的磷酸化调节与LPS组比较无明显差异,但其能显著抑制JNK蛋白的磷酸化。进一步实验发现,JNK蛋白表达被抑制后,细胞中iNOS蛋白表达及NO产生均被显著抑制。上述结果表明,MAPK信号通路中的JNK蛋白可能是扶正化瘀方抑制巨噬细胞M1型炎性极化的关键靶点。
综上所述,扶正化瘀方可通过抑制MAPK信号通路中JNK蛋白磷酸化减少巨噬细胞iNOS基因及蛋白过表达及NO过量生成,从而抑制巨噬细胞M1型炎性极化发挥其抗炎作用,这可能是扶正化瘀方抗炎、抗肝纤维化的分子机制之一。
参考文献:
[1] DING Y F, WU Z H, WEI Y J, et al. Hepatic inflammation-fibrosis- cancer axis in the rat hepatocellular carcinoma induced by diethylnitrosamine[J]. J Cancer Res Clin Onco,2017,143(5):821-834.
[2] LIU P, HU Y Y, LIU C, et al. Multicenter clinical study on Fuzhenghuayu capsule against liver fibrosis due to chronic hepatitis B[J]. World J Gastroenterol,2005,11(19):2892-2899.
[3] LEE M, REY K, BESLER K, et al. Immunobiology of nitric oxide and regulation of inducible nitric oxide synthase[J]. Results Probl Cell Differ,2017,62:181-207.
[4] SHIN W B, DONG X, KIM Y S, et al. Anti-inflammatory effects of batillaria multiformis water extracts via NF-кB and MAPK signaling pathways in LPS-induced RAW264.7 Cells[J]. Adv Exp Med Biol,2019,1155:1001-1014.
[5] 赵长青,徐列明.扶正化瘀胶囊/片治疗肝纤维化和肝硬化的临床研究进展[J].世界中医药,2014,9(5):561-567.
[6] HENDERSON N C, IREDALE J P. Liver fibrosis:cellular mechanisms of progression and resolution[J]. Clin Sci,2007,112(5):265-280.
[7] FRANK T. Targeting hepatic macrophages to treat liver diseases[J]. Journal of Hepatology,2017,66(6):1300-1312.
[8] PRADERE J P, KLUWE J, MINICIS S D, et al. Hepatic macrophages but not dendritic cells contribute to liver fibrosis by promoting the survival of activated hepatic stellate cells in mice[J]. Hepatology,2013,58(4):1461-1473.
[9] 姜春萌,刘成,刘成海,等.扶正化瘀方对大鼠CCl4损伤肝Kupffer细胞功能的影响[J].中西医结合肝病杂志,2000,10(5):26-28.
[10] LIU C, HU Y, XU L, et al. Effect of Fuzheng Huayu formula and its actions against liver fibrosis[J]. Chin Med,2009,4:12.
[11] YU Y, SHEN M, WANG Z, et al. Sulfated polysaccharide from, Cyclocarya paliurus, enhances the immunomodulatory activity of macrophages[J]. Carbohydrate Polymers,2017,174:669-676.
[12] WYNN T A, CHAWLA A, POLLARD J W. Macrophage biology in development, homeostasis and disease[J]. Nature,2013,496(7446):445-455.
[13] VINOGRADOV S, WARREN G, WEI X. Macrophages associated with tumors as potential targets and therapeutic intermediates[J]. Nanomedicine (Lond),2014,9(5):695-707.
[14] PENG X X, ZHANG S H, WANG X L, et al. Panax Notoginseng flower saponins (PNFS) inhibit LPS-stimulated NO overproduction and iNOS gene overexpression via the suppression of TLR4-mediated MAPK/NF-к B signaling pathways in RAW264.7 macrophages[J]. Chin Med,2015,10:15.
(收稿日期:2019-09-23)
(修回日期:2019-10-11;編辑:华强)
