山药多糖对大鼠急性心肌梗死后心肌细胞凋亡的抑制作用及其机制
2020-04-29王静洪炳哲张习敬葛鲁敏任海勤
王静 洪炳哲 张习敬 葛鲁敏 任海勤
(1贵州盘江投资控股(集团)有限公司总医院心内科,贵州 六盘水 553530;2齐齐哈尔医学院附属第三医院心内科六病区)
急性心肌梗死的主要表现形式为心肌细胞凋亡,研究表明冠状动脉闭塞后造成局部心肌组织缺血缺氧进而导致心肌细胞凋亡〔1〕。急性心肌梗死可促使心肌细胞因缺血缺氧而发生细胞凋亡,通过抑制心肌细胞凋亡可延缓心室重构并减少心肌梗死面积,既往研究报道指出心肌梗死后引发的心肌细胞凋亡是造成心力衰竭等心血管疾病发生的细胞学基础〔2,3〕。因而如何减少心肌细胞凋亡成为目前研究的主要方向。山药多糖(CYPS)是山药的主要成分且属于补气中药,研究表明CYPS在神经细胞凋亡过程中发挥抗氧化等作用〔4,5〕。但CYPS对急性心肌梗死后心肌细胞凋亡的影响尚未可知。上调成纤维细胞生长因子(FGF)9表达可减少缺氧/复氧(H/R)诱导的心肌细胞凋亡〔6〕。FGF9属于成纤维生长因子家族成员,其表达异常与多种血管疾病发生及发展过程密切相关〔7〕。但CYPS是否可通过调控FGF9表达进而参与心肌细胞凋亡过程尚未见相关报道。本研究通过观察CYPS对H/R后心肌细胞存活及凋亡的影响,探讨其对FGF9表达的影响及其调控作用。
1 材料与方法
1.1材料与试剂 心肌细胞H9C2购自上海酶研生物科技有限公司。siRNA转染试剂购自德国罗氏公司;DMEM培养基购自美国Hyclone公司;胎牛血清购自美国Gibco公司;噻唑蓝(MTT)检测试剂盒购自美国Sigma公司;细胞凋亡检测试剂盒购自上海贝博生物公司;放射免疫沉淀法(RIPA)裂解液、二喹啉甲酸(BCA)蛋白定量试剂盒、电化学发光(ECL)试剂盒均购自上海碧云天生物工程有限公司;兔抗鼠活化半胱氨酸天冬氨酸蛋白酶(Cleaved caspase)-3、细胞周期蛋白依赖性激酶(CDK)4单克隆抗体购自美国Abcam公司;Lipofectamine2000转染试剂购自美国Invitrogen公司;谷胱甘肽过氧化物酶(GSH-Px)、超氧化物歧化酶(SOD)含量检测试剂盒均购自北京博奥森生物技术有限公司。
1.2构建H/R模型 DMEM低糖培养基充入无菌氮气,以1 L/min的流量持续30 min,将原培养基更换为DMEM高糖培养基,放入缺氧装置内进行缺氧处理4 h,充入氧气进行复氧处理2 h〔8〕。未进行任何处理的心肌细胞作为空白对照(NC)组,H/R处理的心肌细胞作为H/R组。
1.3药物处理及实验分组 收集处于对数生长期心肌细胞,随机分为3组:H/R+75 mg/L CYPS组(心肌细胞缺氧时加入终浓度为75 mg/L 的CYPS进行H/R处理)、H/R+150 mg/L CYPS组(心肌细胞缺氧时加入终浓度为150 mg/L 的CYPS进行H/R处理)、H/R+300 mg/L CYPS组(心肌细胞缺氧时加入终浓度为300 mg/L 的CYPS后进行H/R处理)〔9〕,放入37℃恒温培养箱内继续培养48 h。后续实验首先观察过表达FGF9对缺氧处理心肌细胞存活率和细胞凋亡的影响,将心肌细胞随机分为H/R+pcDNA组、H/R+pcDNA-FGF9组,将心肌细胞随机分为H/R+CYPS组(心肌细胞缺氧时加入终浓度为300 mg/L 的CYPS进行H/R处理)、H/R+CYPS+si-con组(心肌细胞中转染FGF9-siRNA的阴性对照,转染成功后在心肌细胞缺氧时加入终浓度为300 mg/L 的CYPS进行H/R处理)、H/R+CYPS+si-FGF9组(心肌细胞中转染FGF9-siRNA,转染成功后在心肌细胞缺氧时加入终浓度为300 mg/L的CYPS进行H/R处理),继续培养48 h。
1.4MTT检测细胞存活率 收集对数生长期心肌细胞,调整细胞浓度(5×104个/ml),以每孔1 ml接种于96孔板,放入37℃恒温培养箱继续培养24 h,按照实验分组处理后,每孔分别加入10 μl MTT试剂,放入37℃恒温培养箱继续培养4 h,分别于作用24 h、48 h、72 h、96 h时弃细胞上清液,每孔分别加入150 μl二甲基亚砜(DMSO),放入摇床上低速振荡10 min,充分反应,应用酶标仪检测波长为490 nm时各孔吸光度值(OD值),空白对照组仅添加等量培养液,每组均设置3个复孔,细胞存活率=〔(实验组OD值-空白对照组OD值)/(正常对照组OD值-空白对照组OD值)〕×100%。
1.5流式细胞术检测细胞凋亡率 收集各组心肌细胞,弃上清,用预冷磷酸盐缓冲液(PBS)洗涤细胞,0.25%胰蛋白酶消化,低温条件下,1 500 r/min离心5 min(离心半径10 cm),弃上清,预冷PBS洗涤细胞,加入400 μl结合缓冲液悬浮细胞,调整细胞浓度为1×106个/mL,加入5 μl Annexin V-异硫氰酸荧光素(FITC)染色液,充分混匀后,室温避光孵育15 min,加入10 μl碘化丙啶(PI)染色液,充分混匀,室温避光孵育5 min,流式细胞仪检测细胞凋亡情况。
1.6实时荧光定量-聚合酶链反应(qRT-PCR)检测细胞中FGF9 mRNA表达水平 采用Trizol法提取心肌细胞总RNA,测定RNA浓度,按照逆转录试剂盒将2 μg RNA反转录为cDNA,严格按照qRT-PCR检测试剂盒说明书配制反应体系,采用2-ΔΔCt法计算FGF9 mRNA相对表达量。
1.7Western印迹检测心肌细胞CDK4、Cleaved caspase-3、FGF9蛋白表达 取各组对数生长期心肌细胞,加入RIPA裂解液,冰上裂解30 min后进行离心,离心条件为4℃,12 000 r/min转速,离心15 min(离心半径6 cm),收集上清液即细胞总蛋白,采用BCA法检测蛋白含量,根据十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)试剂盒配置分离胶,取20 μg蛋白样品进行SDS-PAGE,电泳反应条件为80 V 30 min,120 V 90 min,120 V、2 000 mA条件下转移至聚偏氟乙烯(PVDF)膜,室温条件下用5%脱脂奶粉封闭2 h,TBST洗涤3次×10 min,4℃孵育一抗(1∶1 000)过夜,TBST洗涤3次×10 min,室温孵育二抗(1∶20 000)2 h,Tris-HCl缓冲盐溶液(TBST)洗涤3次×10 min,滴加ECL显影,放入凝胶成像系统并应用ImageJ软件分析蛋白条带灰度值。
1.8检测GSH-Px、SOD含量 采用黄嘌呤氧化酶法检测SOD活力,采用还原型谷胱甘肽氧化法检测GSH-Px活力,严格按照试剂盒说明书进行操作。
1.9统计学处理 应用SPSS21.0软件进行独立样本t检验、单因素方差分析。
2 结 果
2.1CYPS对H/R处理心肌细胞存活率、GSH-Px、SOD含量及CDK4表达的影响 H/R组心肌细胞存活率显著低于NC组(P<0.05),不同浓度CYPS干预后心肌细胞存活率显著高于H/R组(P<0.05),且随着CYPS浓度的增加而显著升高(P<0.05)。与NC组相比,H/R组心肌细胞中CDK4蛋白水平及GSH-Px、SOD含量均显著降低(P<0.05);相对于H/R组,H/R+75 mg/L CYPS组、H/R+150 mg/L CYPS组、H/R+300 mg/L CYPS组心肌细胞中CDK4蛋白水平及GSH-Px、SOD含量均显著升高(P<0.05),且呈剂量依赖性,见表1、图1。
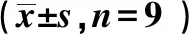
表1 不同浓度的CYPS对缺氧处理心肌细胞存活率和GSH-Px及SOD含量的影响
1)与NC组比较,2)与H/R组比较,3)与H/R+75 mg/L CYPS组比较,4)与H/R+150 mg/L CYPS组比较:均P<0.05,表2同

1~5:NC组,H/R组,H/R+75 mg/L CYPS组,H/R+150 mg/L CYPS组,H/R+300 mg/L CYPS组;图2同图1 不同浓度的CYPS对H/R处理心肌细胞CDK4含量的影响
2.2CYPS对H/R处理心肌细胞凋亡的影响 H/R组心肌细胞凋亡率显著高于NC组(P<0.05),不同浓度CYPS干预后心肌细胞凋亡率显著低于H/R组(P<0.05),且随着浓度的增加而显著降低(P<0.05)。与NC组相比,H/R组心肌细胞中Cleaved caspase-3蛋白水平显著升高(P<0.05);相对于H/R组,H/R+75 mg/L CYPS组、H/R+150 mg/L CYPS组、H/R+300 mg/L CYPS组心肌细胞中Cleaved caspase-3蛋白水平显著降低(P<0.05),且呈剂量依赖性,见表2、图2。
2.3CYPS对H/R处理心肌细胞FGF9表达的影响 H/R组心肌细胞FGF9 mRNA及蛋白水平显著低于NC组(P<0.05),不同浓度CYPS干预后心肌细胞FGF9 mRNA及蛋白水平显著高于H/R组(P<0.05),且随着浓度的增加而显著升高(P<0.05),见表2,图3。
2.4过表达FGF9对H/R处理心肌细胞存活率和细胞凋亡的影响 与H/R+pcDNA组相比,H/R+pcDNA-FGF9组心肌细胞存活率显著升高(P<0.05),而细胞凋亡率显著降低(P<0.05),GSH-Px、SOD含量及CDK4、FGF9蛋白水平均显著升高(P<0.05),而Cleaved caspase-3蛋白水平显著降低(P<0.05),见图3、表3。表明FGF9过表达可明显促进H/R诱导的心肌细胞增殖而抑制细胞凋亡。
2.5沉默FGF9逆转CYPS对H/R处理心肌细胞的保护作用 相对于H/R+CYPS+si-con组,H/R+CYPS+si-FGF9组心肌细胞存活率显著降低(P<0.05),而细胞凋亡率显著增加(P<0.05),GSH-Px、SOD含量及CDK4、FGF9蛋白水平均显著降低(P<0.05),而Cleaved caspase-3蛋白水平显著升高(P<0.05),见表4、图4。表明CYPS可通过上调FGF9表达而保护心肌细胞。
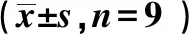
表2 不同浓度的CYPS对缺氧处理心肌细胞凋亡和Cleaved caspase-3、FGF9蛋白及mRNA表达的影响

图2 不同浓度的CYPS对缺氧处理心肌细胞Cleaved caspase-3、FGF9蛋白表达的影响
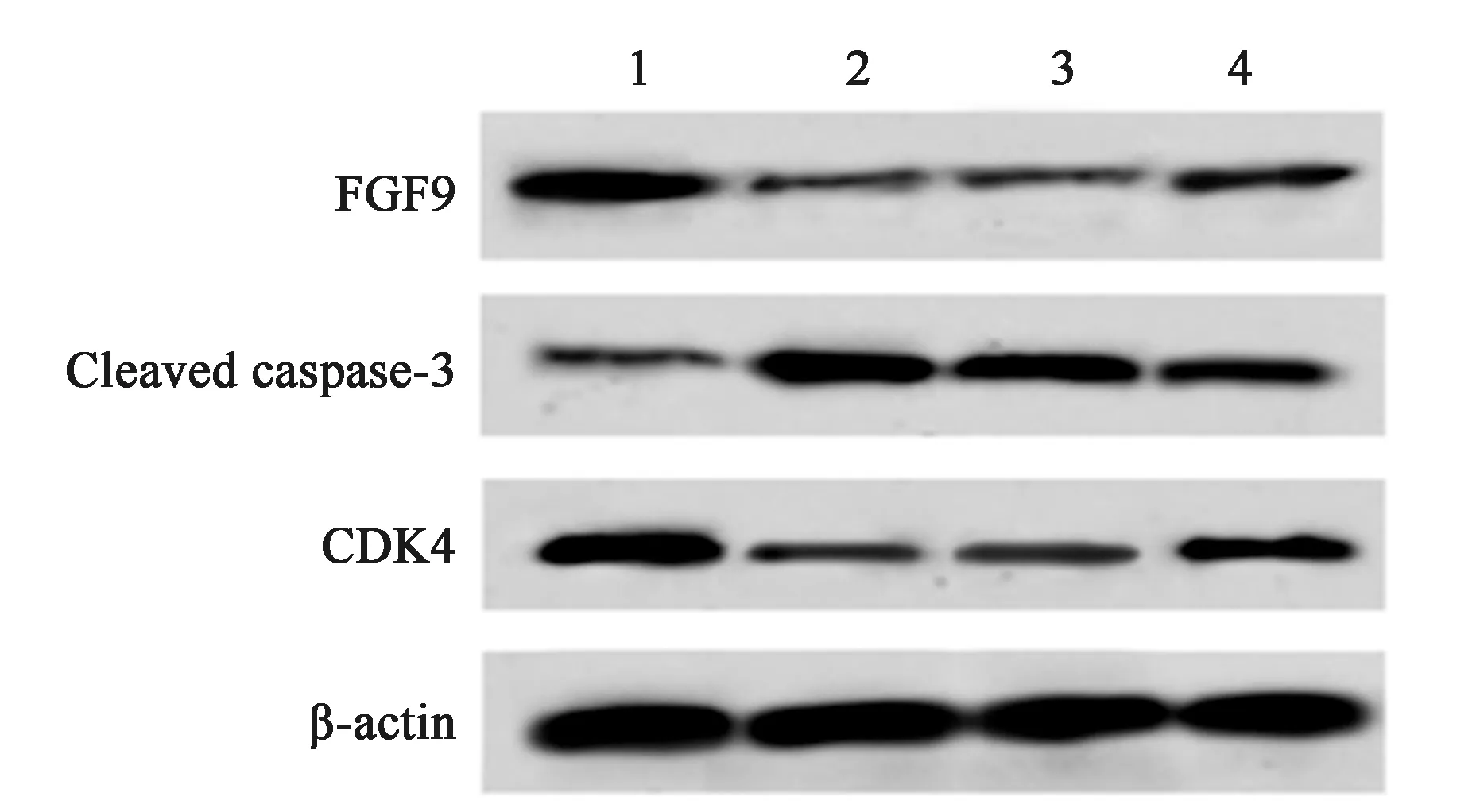
1~4:NC组,H/R组,H/R+pcDNA组,H/R+pcDNA+FGF9组图3 过表达FGF9对H/R处理心肌细胞CDK4和Cleaved caspase-3表达的影响

表3 过表达FGF9对缺氧处理心肌细胞存活率、细胞凋亡、GSH-Px和SOD含量及CDK4和Cleaved caspase-3表达的影响
与NC组相比较:1)P<0.05;与H/R+pcDNA组相比较:2)P<0.05

表4 CYPS和降低FGF9表达对缺氧处理心肌细胞存活率、细胞凋亡、GSH-Px和SOD含量及CDK4和Cleaved caspase-3表达的影响
与NC组相比较:1)P<0.05;与H/R组相比较:2)P<0.05;与H/R+CYPS+si-con组相比:3)P<0.05
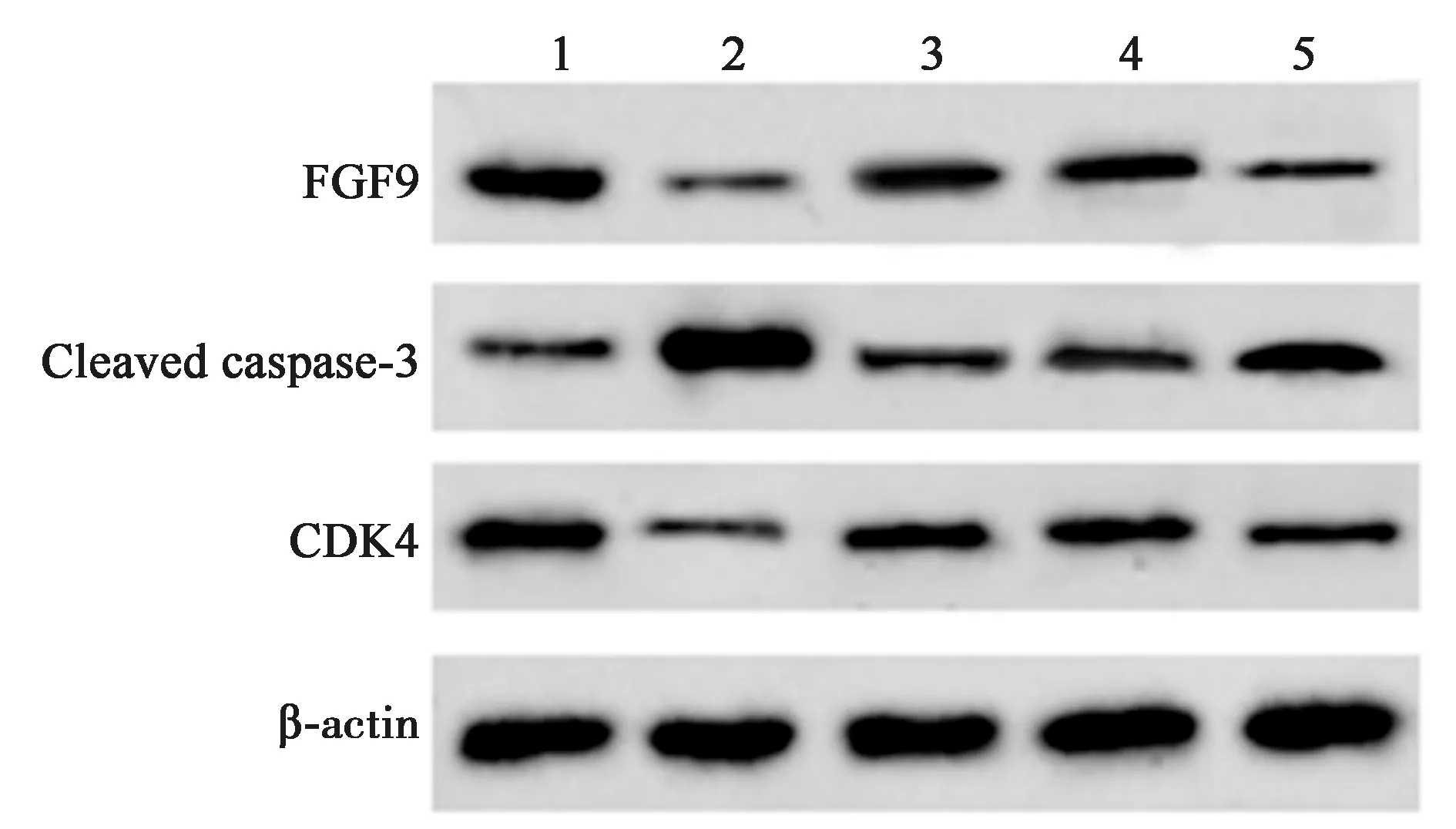
1~5:NC组,H/R组,H/R+CYPS组,H/R+CYPS+si-con组,H/R+CYPS+si-FGF9组图4 CYPS和沉默FGF9表达对缺氧处理心肌细胞FGF9、CDK4和Cleaved caspase-3蛋白表达的影响
3 讨 论
心肌梗死区域心肌细胞凋亡率明显升高,心肌缺血、缺氧等均可诱导心肌细胞凋亡。研究指出,减少心肌细胞凋亡可减少心肌梗死面积并延缓心室重构〔10〕。因而减少心肌细胞凋亡成为治疗心肌梗死的主要途径。既往研究表明,从植物中提取多糖成分可有效保护心肌梗死后的心肌细胞,并抑制H/R所致的心肌细胞凋亡〔11〕。
CYPS可通过降低糖尿病大鼠体内氧化应激反应有效改善大鼠血糖水平,并可保护胰岛及血小板功能〔12〕。CYPS可通过增强脑组织中三磷酸腺苷(ATP)酶活性增强机体清除氧自由基能力进而防止老年性痴呆〔13〕。研究表明,CYPS可增强肝癌细胞对胰岛素的敏感性及改善细胞葡萄糖消耗能力〔14〕。本研究结果提示CYPS可通过促进CDK4表达进而促进心肌细胞存活。CDK4是正向调控细胞周期的重要因子之一,CDK激活后可与Cyclin形成复合物进而促进细胞周期由G1期进入S期,促进细胞增殖〔15〕。GSH-Px与SOD可构成机体抗氧化防御系统,其含量升高可增强机体抗氧化能力〔16〕。本研究结果提示CYPS可有效提高H/R损伤心肌细胞自由基清除能力,并有效降低氧化应激损伤。Cleaved caspase-3是线粒体凋亡途径中执行凋亡的重要因子,其表达水平升高可促进细胞凋亡〔17〕。本研究提示,CYPS可通过降低Cleaved caspase-3表达进而抑制H/R导致的心肌细胞凋亡。
FGF9广泛存在于哺乳动物中枢神经或外周神经系统中,并可有效促进神经元细胞生长,若神经元受损时可明显促进神经元再生并有效延缓神经元细胞死亡〔18,19〕。FGF9能够介导单核细胞向M2分化,赋予心脏保护作用〔20〕。本研究提示,CYPS可通过上调FGF9表达而对H/R损伤心肌细胞发挥保护作用。
综上,CYPS可有效保护H/R损伤心肌细胞,可能与上调FGF9表达及增强抗氧化能力有关,并可降低心肌细胞凋亡率,为临床合理用药提供参考依据。但关于CYPS对H/R损伤心肌细胞保护作用的其他作用机制仍需深入研究。
