黄连素对博来霉素诱导肺泡上皮细胞形态及TGF-β1分泌水平的影响
2020-04-29皮玉琪程立胡先平
皮玉琪,程立,胡先平
1锦州医科大学国药东风总医院研究生培养基地,湖北十堰442000;2湖北医药学院附属国药东风总医院
肺纤维化是由于过多的成纤维细胞聚集和细胞外基质(ECM)成分如胶原蛋白沉积而导致正常的肺组织结构改变、功能丧失的一类疾病。肺纤维化主要累及肺间质、肺泡和(或)细支气管,表现为毛细血管内皮细胞与急性弥散性肺泡上皮细胞损伤,最终可导致呼吸衰竭,病死率为50%~70%[1,2]。近年来,肺纤维化的发病率呈上升趋势,临床上仍缺乏有效的治疗手段。因此,寻找对肺纤维化有效的治疗药物已成为当前医学的迫切需要。黄连素又称小檗碱,是从黄连等植物中提取的活性生物碱。许多研究表明,黄连素具有保护心肌细胞、抗血小板凝集、减少血栓形成、修复内皮细胞、改善血管功能以及抗焦虑、镇静、降糖、降血脂、抗氧化自由基等作用[3,4],除此之外,国内多项研究表明,黄连素可通过多种途径抗心脏、肝脏、肾脏等多脏器纤维化进程[5~8]。目前对黄连素在肺间质纤维化进展中的作用研究多为大鼠实验,关于黄连素对人肺泡上皮细胞的抗肺纤维化作用机制,以及黄连素抗博来霉素诱导肺间质纤维化的作用和机制,目前也尚未明确。博来霉素已临床应用30余年,抗癌活性强,同时无明显的骨髓功能和免疫功能抑制,但主要不良反应为肺纤维化,因此常被用于各种肺纤维化模型的诱导[9]。2018年8月~2019年2月,本研究以人肺泡上皮细胞A549作为研究对象,通过博来霉素诱导肺纤维化模型,观察不同浓度黄连素处理A549细胞后细胞形态和转化生长因子β1(TGF-β1)分泌水平的变化,初步探讨黄连素抗肺纤维化的作用及机制。现报告如下。
1 材料与方法
1.1 细胞与主要实验材料 A549细胞[10]购于中国科学院干细胞库,接种于含10% FBS的DMEM/F12培养基,置于37 ℃、5% CO2的恒温细胞培养箱中培养,1~2 d换液1次,细胞密度达80%时,用含0.25% EDTA-Na2胰酶消化,传代。黄连素、MTT试剂购自Sigma公司,博来霉素购自浙江海正公司,人TGF-β1ELISA试剂盒购自欣博盛公司,FBS购自BI公司,DMEM/F12购自Gibco公司,DMSO购自MP公司。细胞保温箱(Thermo公司),全波段酶标仪(型号MQX-200),倒置显微镜(OLYMPUS CKX41)。
1.2 博来霉素作用浓度筛选 消化对数生长期A549细胞,用不含FBS的DMEM/F12培养基处理成细胞悬液(排除FBS对细胞增殖的影响),按5×104/mL、各取200 μL细胞悬液接种于96孔板,培养24 h后铺满孔底。将博来霉素溶解于PBS中,设置实验组、对照组和空白组。实验组分为6个亚组,分别加入含4、6、8、10、12.5、25 μg/mL博来霉素的DMEM/F12无血清培养基;对照组细胞在无血清培养基中培养,仅加PBS;空白组只有培养基和PBS,不含细胞。每组设置6个复孔。培养24、48 h后每孔加入MTT 20 μL继续孵育4 h,吸弃上清,加入150 μL的DMSO,充分震荡混匀15 min后用全波段酶标仪检测各孔490 nm处光密度(OD)值,取均值,计算细胞增殖抑制率。细胞增殖抑制率=[1-(实验组OD值-空白组OD值)/(对照组OD值-空白组OD值)]×100%。结果显示,博来霉素能够显著抑制A549细胞增殖,8、10、12.5、25 μg/mL博来霉素作用24、48 h后细胞增殖抑制率高于4 μg/mL浓度(P均<0.05)。其中,10 μg/mL博来霉素作用24 h时,细胞增殖抑制率在50%左右,选取此作用浓度用于肺纤维化诱导实验。详见表1。
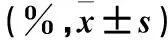
表1 不同浓度博来霉素作用不同时间后A549细胞增殖抑制率比较
注:与同时点4 μg/mL浓度相比,*P<0.05。
1.3 细胞分组及黄连素给药方法 将黄连素粉末溶解于DMSO中配制黄连素溶液,博来霉素溶于PBS中配制博来霉素溶液。将A549细胞分为博来霉素组、黄连素1组、黄连素2组、黄连素3组、黄连素4组、DMSO组、培养基组。博来霉素组加入10 μg/mL博来霉素,黄连素1、2、3、4组分别加入60、80、100、125 μmol/L黄连素和10 μg/mL博来霉素混合溶液,DMSO组加入DMSO,培养基组加入不含FBS的DMEM/F12培养基。
1.4 细胞形态观察 分别于处理24、48 h后经倒置显微镜观察各组细胞形态并拍摄照片。
1.5 细胞上清液TGF-β1检测 分别于处理24、48 h后,取各组细胞培养液离心,取上清液分装于1.5 mL的EP管在-20 ℃保存。采用ELISA法检测TGF-β1,每组设置3个复孔,重复3次。根据ELISA试剂盒说明书操作。在空白孔中加入标准品和标本通用稀释液,其余相应孔中加标本和不同浓度标准品(100 μL/孔)。用封板胶纸封住反应孔,37 ℃孵箱孵育90 min后洗板5次,在空白孔加入生物素化抗体工作液(100 μL/孔)。用新的封板胶纸封住反应孔,37 ℃孵箱孵育60 min后洗板5次。在空白孔加酶结合物稀释液,其余各孔加入酶结合物工作液(100 μL/孔)。用新的封板胶纸封住反应孔,37 ℃孵箱孵育30 min后洗板5次。加入显色底物TMB(100 μL/孔),避光37 ℃孵箱孵育15 min后加入终止液(100 μL/孔),混匀后即刻用全波段酶标仪测量OD450值,根据结果制作标准曲线和标准浓度公式,并将各孔OD值带入公式得出各组细胞上清液的TGF-β1浓度。
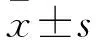
2 结果
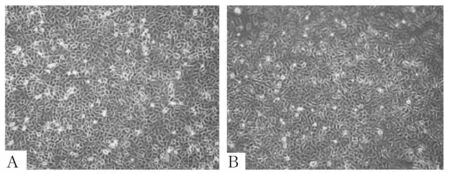
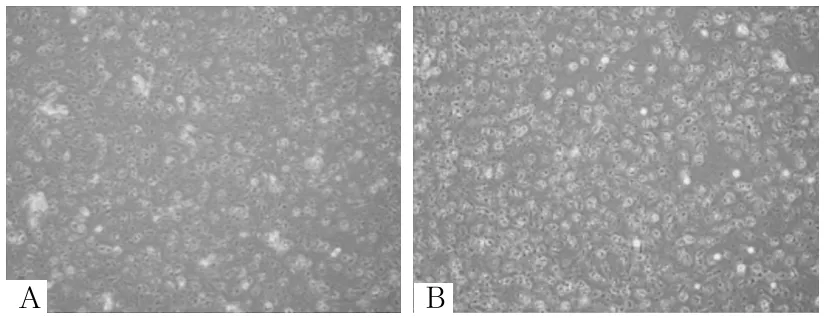
2.1 各组细胞形态 培养基组培养24、48 h细胞呈三角形、铺路石、鹅卵石样,细胞大小均匀,排列紧密,无突触及多角,胞内细胞质均匀透亮,细胞间无明显间隙(图1)。博来霉素组A549细胞培养24、48 h后细胞变小,细胞呈现梭形、纺锤形、扁大多形性,边缘不规则,多有触角,胞内细胞质不均匀,细胞间隙增加,处理48 h后变化更加明显(图2)。DMSO组培养24、48 h后细胞逐渐变大,可见较多大圆形细胞,细胞间隙增大,细胞核增大、高亮,胞质变少且不均匀(图3)。黄连素1、2、3、4组培养24、48 h后细胞状态与原始A549细胞相比均有不同程度改变,细胞逐渐趋向多角形、扁大形,但均较博来霉素组更加趋向于正常细胞,其中黄连素4组培养24 h细胞形态最趋向正常细胞(图4~7)。
注:A为培养24 h细胞形态;B为培养48 h细胞形态。
图1 培养基组培养24、48 h细胞形态

注:A为培养24 h细胞形态;B为培养48 h细胞形态。
图2 博来霉素组培养24、48 h细胞形态
注:A为培养24 h细胞形态;B为培养48 h细胞形态。
图3 DMSO组培养24、48 h细胞形态
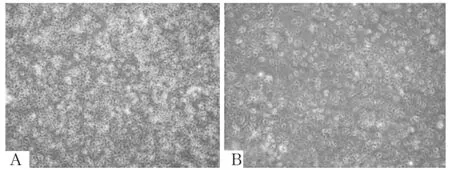
注:A为培养24 h细胞形态;B为培养48 h细胞形态。
图4 黄连素1组培养24、48 h细胞形态

注:A为培养24 h细胞形态;B为培养48 h细胞形态。
图5 黄连素2组培养24、48 h细胞形态
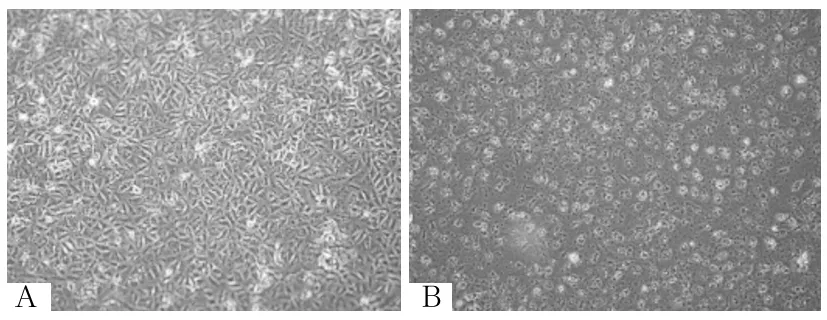
注:A为培养24 h细胞形态;B为培养48 h细胞形态。
图6 黄连素3组培养24、48 h细胞形态
2.2 各组细胞上清液中TGF-β1水平 博来霉素组、DMSO组培养24、48 h细胞上清液TGF-β1水平均高于培养基组(P均<0.05)。黄连素1、2、3、4组培养24、48 h细胞上清液TGF-β1水平均低于博来霉素组(P均<0.05)。黄连素3、4组培养24、48 h细胞上清液中TGF-β1水平低于黄连素1、2组(P均<0.05)。详见表2。

注:A为培养24 h细胞形态;B为培养48 h细胞形态。
图7 黄连素4组培养24、48 h细胞形态
表2 各组培养24、48 h细胞上清液TGF-β1水平比较
注:与培养基组相比,*P<0.05;与博来霉素组相比,#P<0.05;与黄连素1、2组相比,△P<0.05。
3 讨论
肺纤维化的机制目前仍不十分明确,以往认为炎症是导致肺纤维化的首要条件之一,近些年来大量研究报道,在特发性肺纤维化和间质性肺炎中,炎症反应不一定是必要条件,而肺泡上皮-间充质转化(EMT)及相关信号转导通路在诱导肺纤维化中的作用逐渐得到认可[11]。
成年人肺中存在两种肺泡上皮细胞,分别为Ⅰ型肺泡上皮细胞(AEC-Ⅰ)和Ⅱ型肺泡上皮细胞(AEC-Ⅱ)。AEC-Ⅰ为终末分化的细胞,覆盖90%的肺泡表面;AEC-Ⅱ产生、分泌表面活性剂来维持肺泡张力,调节肺泡液平衡,并且在细胞凋亡或受到损伤时分化成AEC-Ⅰ来修复受损屏障[12]。修复过程中可能出现ECM的异样沉积。ECM是细胞外分泌大分子的复杂网络,例如胶原蛋白、酶和糖蛋白,其主要功能包括结构支架和细胞、组织的生化支持。ECM的稳态对于器官发育至关重要,ECM持续异样沉积或失调会导致病理修复,进一步导致EMT[13]。
EMT是肺纤维化的关键过程,而肺泡上皮细胞作为哨兵和效应系统在EMT的过程中起着关键作用。在EMT的过程中有许多通路和细胞因子参与,如TGF-β信号通路、PI3K-AKT-mTOR信号通路、Wnt/β-catenin信号通路、MAPK信号通路及NF-κB信号通路[14,15]。其中至关重要的细胞因子是TGF-β,TGF-β是一种多效性的细胞因子,可由多种细胞产生,调节细胞增殖、分化、迁移、黏附,调节ECM的代谢,参与肺胚胎发育、组织损伤和修复[16,17]。TGF-β有三种亚型即TGF-β1、TGF-β2、TGF-β3,其中TGF-β1亚型与肺纤维化发生发展关系最为密切[18]。因此,减少TGF-β1的表达可能延缓肺纤维化进程[19]。
正常人肺泡上皮细胞常表现为鹅卵石、类方形等,细胞光滑无明显突触,连接紧密。而肺纤维化细胞常表现为纺锤形、长梭形、多形性伴有多触角。本实验通过博来霉素诱导24 h后的A549细胞有纤维化特点,可认为博来霉素诱导了肺泡上皮细胞纤维化。通过检测各组细胞上清液中TGF-β1水平,我们发现,博来霉素组、DMSO组培养24、48 h细胞上清液TGF-β1水平均高于培养基组,证实了博来霉素具有诱导A549细胞纤维化的作用。DMSO是一种良好的溶剂,本实验中黄连素必须溶于DMSO才可获得均匀、溶解度好的溶液,博来霉素溶于PBS即可。PBS对细胞无损坏作用,但DMSO对细胞具有毒性作用。因此,我们设计了DMSO组用来排除不同溶剂溶解两种药物造成的误差。DMSO组细胞上清液TGF-β1水平高于所有黄连素组,进一步表明黄连素可以降低DMSO对细胞的损伤。但DMSO组细胞形态与博来霉素诱导的肺纤维化细胞有所区别,其光镜下细胞形态变化类似于一种病理性死亡的变化。
一项研究显示,低浓度的TGF-β1可增加心脏成纤维细胞的活力,促进胶原Ⅲ的合成,而黄连素可呈浓度依赖性地抑制心脏成纤维细胞的活力,降低胶原Ⅲ的合成,促进p38-MAPK蛋白磷酸化[5]。孙斯凡等[6]研究证实,黄连素可减少大鼠肾皮质的TGF-β1、TβRI表达,上调smad7和IκBα的表达,从而减轻肾脏炎症及纤维化。黄连素还能通过减少S1P2受体表达,抑制S1P2-MAPK(主要是ERK1/2和p38-MAPK)通路介导的纤维连接蛋白表达,发挥抗糖尿病肾纤维化的作用[20]。结合以上研究可知,黄连素可以通过多种信号途径抗脏器纤维化,这些信号途径也可能出现在肺组织中。
本研究结果显示,黄连素药物组细胞形态更加趋向于原始的铺路石样形态,且高浓度黄连素组细胞形态稳定性更好;黄连素1、2、3、4组培养24、48 h细胞上清液TGF-β1水平均低于博来霉素组,黄连素3、4组培养24、48 h细胞上清液中TGF-β1水平低于黄连素1、2组,这表明黄连素能够抑制博来霉素诱导的A549细胞形态向多触角形细胞改变,减少TGF-β1的分泌,并且随着黄连素浓度增高、这种作用更加明显,黄连素可能通过下调TGF-β1水平而达到抗肺纤维化的作用。
总之,本研究表明,黄连素可降低博来霉素诱导的A549细胞TGF-β1的分泌水平,并且黄连素浓度越高,保护细胞、延缓细胞纤维化的作用越强。我们认为,黄连素有望成为治疗肺纤维化的新药物。
