一种新型罗丹明席夫碱(RHBS)制备及多功能性研究*
2020-04-28光善仪徐洪耀
彭 丽,光善仪,徐洪耀
(1.东华大学 化学化工与生物工程学院,生态纺织教育部重点实验室,上海 201620;2.东华大学 分析测试中心与材料学院,纤维改性国家重点实验室,上海 201620)
0 引 言
功能材料由于其独特的功能性是材料领域的研究热点[1-2],多功能新材料是功能材料领域前沿课题[3-4],近年来备受材料领域研究者的重视[5]。配合物由于兼具有机和无机的优点近年来受到广泛重视[6-10],罗丹明是一类生物性荧光材料,由于其具有很好的配位能力,在配合物领域也受到广泛关注,然而以前的研究主要集中在单功能材料的分子设计与性能[11-14],多功能材料制备与性能研究报道较少。
本文以罗丹明B酰肼及3-溴取代水杨醛为原料,通过在水杨醛中引入3-溴取代基来调制其材料性能;基于醛基(或酮)化合物与含氨基化合物的亲核加成脱水缩合制备席夫碱,得到一种新型罗丹明席夫碱化合物(RHBS)。RHBS与锌离子结合,在丙酮溶液中制备出了新的红光发光材料,研究了其光学性能及其荧光量子产率,并进一步探索研究了RHBS对Zn(Ⅱ)的荧光发光光谱选择性及其它离子干扰。结果显示RHBS是Zn(Ⅱ)的很好的荧光探针材料,对Zn(Ⅱ)呈现出了多功能的性能。该研究为未来新型多功能材料分子设计与应用奠定了基础。
1 实 验
1.1 仪器与试剂
Bruker AVANCE/DMX600型核磁共振仪器;Nicolet 8700型傅里叶变换红外光谱仪(KBr压片);Lambda 35型紫外及可见分光光度计;LS 55型荧光分光光度计。
3-溴水杨醛、无水乙醇、Zn(NO3)2·6H2O均为分析纯,其中罗丹明B酰肼是自制的,所用原料罗丹明B及水合肼均为分析纯。
1.2 材料制备
1.2.1 配体RHBS的合成
称取罗丹明B酰肼(0.2283 g, 0.5 mmol)于100 mL三口烧瓶中,加10 mL无水乙醇将其溶解。用恒压滴液漏斗将溶解在10mL无水乙醇中的3-溴水杨醛(0.1045 g, 0.52 mmol)于30 min内缓慢地加入到三口烧瓶中。在N2保护下,于80 ℃下回流6h,用薄层层析硅胶板跟踪反应至反应完全。将反应液自然冷却至室温,有沉淀产生,静置2 h使沉淀完全。过滤后,乙醇多次重结晶得到浅粉色固体,产率为78.5%。1H NMR(600 MHz, DMSO-d6)δ: 11.39(s, 1H, -OH), 9.07(s, 1H, -N=C-H), 7.94(d,J=7.2 Hz, 1H, Ar-H), 7.65(t,J=7.5 Hz, 1H, Ar-H), 7.60(t,J=7.2 Hz, 1H, Ar-H), 7.56(d,J=7.8 Hz, 1H, Ar-H), 7.30(d,J=7.8 Hz, 1H, Ar-H), 7.15(d,J=7.2 Hz, 1H, Ar-H), 6.82(t,J=7.8 Hz, 1H, Ar-H), 6.46-6.44(m, 4H, Ar-H), 6.36(dd,J1=2.4 Hz,J2=2.4 Hz, 2H, Ar-H), 3.30(q,J1=7.2 Hz,J2=7.2 Hz, 8H, -CH2-), 1.07(t,J=6.9 Hz, 12H, -CH3)。FTIR(KBr, cm-1): 3 436(-OH), 1731、1715(C=O), 1633(C=N)。
1.2.2 配合物[RHBS-Zn(Ⅱ)]的合成
称取配体化合物RHBS(0.3198 g, 0.5 mmol)和Zn(NO3)2·6H2O(0.1487 g, 0.5 mmol)于100 mL三口烧瓶中,加入30 mL丙酮溶液充分溶解后,60 ℃回流搅拌4 h。冷却,将反应液于室温下静置使溶剂自然挥发,得到红色晶体。
2 结果与讨论
2.1 配合物[RHBS-Zn(Ⅱ)]的结构分析
2.1.1 配合物[RHBS-Zn(Ⅱ)]的核磁分析
首先用(CD3)2O作氘代试剂,通过氢谱核磁滴定来推测配体与金属离子的配位点。如图1所示,其中化学位移为11.64×10-6处的单重信号峰为配体RHBS羟基质子信号峰,9.08 ×10-6处的单重峰为席夫碱配体RHBS碳氮双键上的质子信号峰。当引入Zn(NO3)2·6H2O时,核磁氢谱11.64×10-6处的羟基质子峰消失,而9.08 ×10-6处的HC=N上的质子峰并未消失。说明配体与金属离子的配位机理可能是Zn(Ⅱ)的去质子化作用。其他芳环质子信号峰显示出整体向低场位移的趋势,说明配位导致了芳环质子化学环境的变化,这可能是由于配体轨道和Zn(Ⅱ)轨道重叠,π电子的离域能力增强,席夫碱配体羰基上的O、亚胺基上的N、酚基上的O与Zn(Ⅱ)发生配位,使整个配合物的共轭性增加,从而导致芳环质子信号峰整体向低场位移。

图1 配体RHBS及配合物[RHBS-Zn(Ⅱ)]的1H- NMR谱图
2.1.2 配合物[RHBS-Zn(Ⅱ)]的红外分析
图2为配体RHBS和配合物[RHBS-Zn(Ⅱ)]的傅里叶变换红外光谱图,其中2 980~2 800 cm-1范围内的吸收带对应于席夫碱配体RHBS脂肪族甲基及亚甲基的不对称及对称伸缩振动。1731、1715 cm-1处的尖峰为配体羰基的伸缩振动吸收峰,1 633 cm-1处则为配体RHBS上C=N双键的特征吸收峰。与配体相比,配合物[RHBS-Zn(Ⅱ)]的C=O、C=N双键的伸缩振动往低波数方向移动,这是由于配体与Zn(Ⅱ)配位轨道重叠,电子云密度平均化,使化学键的力常数降低,振动频率降低。

图2 配体RHBS及配合物[RHBS-Zn(Ⅱ)]的FT-IR谱图
2.2 配合物[RHBS-Zn(Ⅱ)]的光学性能
2.2.1 配合物[RHBS-Zn(Ⅱ)]的电子吸收光谱
图3为配体及配合物的紫外-可见光谱图。配体RHBS本身在400 nm之后没有任何吸收;然而与Zn(Ⅱ)配位络合后在428 nm处呈现一个弱吸收峰,在556 nm处呈现一个强烈的吸收峰,这可能是RHBS与Zn(Ⅱ)形成配合物的结果。
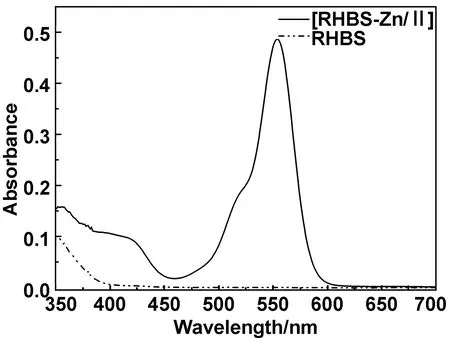
图3 配体RHBS与配合物[RHBS-Zn(Ⅱ)]的紫外-可见吸收光谱
2.2.2 配合物[RHBS-Zn(Ⅱ)]的发光性能
通过手持紫外灯照射,可以发现配合物[RHBS-Zn(Ⅱ)]有明显的红色荧光产生。因此,我们进一步测定了配合物[RHBS-Zn(Ⅱ)]在丙酮溶液中的激发和发射光谱。如图4所示,在556 nm处激发时,配合物的最大荧光发射波长为587 nm。与配体相比,配合物在587 nm处有近210倍的荧光增强。因此,该新型席夫碱配合物[RHBS-Zn(Ⅱ)]可作为一种较好的红色荧光发光材料。

图4 配合物[RHBS-Zn(Ⅱ)]的激发和发射光谱
2.2.3 配合物[RHBS-Zn(Ⅱ)]的发光量子效率
量子产率又称为荧光效率[15-16],是荧光分子在激发态时发射的光子数与在基态时吸收的光子数之比,数学形式表示为:量子产率=发射的光子数/吸收的光子数。量子产率可以用来表示化合物发的荧光强度,量子产率越小,荧光强度越弱,反之,则越强。
传统的量子产率测试方法采用的是相对法,待测样品必须与一个量子产率已知的标准样品进行比较,而确定一个发光标准样是非常困难的。因此,本文采用绝对荧光量子产率。这样可以避免由于选择标准样品而引起的巨大误差,还可以对激发光波长和荧光发射波长有重叠的样品进行自吸收矫正。由表1可知,以丙酮溶液背景,配合物的绝对荧光量子产率为0.151。
表1 配合物[RHBS-Zn(Ⅱ)]的绝对荧光量子产率
Table 1 Absolute fluorescence quantum yield of complex[RHBS-Zn(Ⅱ)]

次号123456均值QY0.150.160.150.140.160.150.151
2.3 配体RHBS对Zn(Ⅱ)配位选择性能
为进一步探究配体RHBS与其他金属离子是否有类似的配位响应,我们固定配体RHBS的浓度为10 μmol/L,然后依次向其中加入等浓度的不同金属离子,并定容至10 mL,分别测量它们的荧光发射光谱。如图5(a)所示,在556 nm波长激发下,只有Zn(Ⅱ)在587 nm呈现出荧光发射峰,说明配体RHBS对Zn(Ⅱ)配位具有很强的荧光选择性。如图5(b)可知,向锌离子配合物[RHBS-Zn(Ⅱ)]的丙酮溶液中加入等浓度的其他金属离子,发现其他金属离子的存在并不会对[RHBS-Zn(Ⅱ)]的荧光产生明显的干扰,RHBS可以作为高选择性Zn(Ⅱ)荧光探针。然而在以前的工作中发现,没有3-位溴基团取代,得到罗丹明席夫碱,在556 nm波长光激发下,与Zn(Ⅱ)和Al(Ⅲ)均在587 nm波长均有较强发光峰,无法实现选择性识别。因此,吸电子基溴的引入,可有效屏蔽了Al(Ⅲ)的影响,实现了对Zn(Ⅱ)的选择性识别。配合物[RHBS-Zn(Ⅱ)]不仅具有很好的红光发光性能,也是一种很好红光发光材料,在发光领域具有较好的应用前景。同时也发现,该配体RHBS对Zn(Ⅱ)具有很好荧光发光选择性,因此在Zn(Ⅱ)领域也具有一定潜在应用价值。
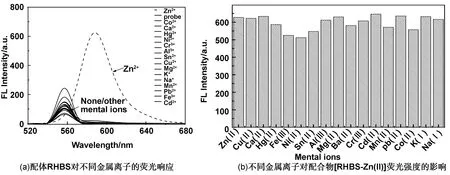
图5 (a)配体RHBS对不同金属离子的荧光响应和(b)不同金属离子对配合物[RHBS-Zn(Ⅱ)]荧光强度的影响
2.4 配合物中RHBS与Zn(Ⅱ)的配比分析
为进一步确定席夫碱配体RHBS与Zn(Ⅱ)的配位比,采用Job’s Plot曲线法来确定配体RHBS与Zn(Ⅱ)配位时的化学计量比。保持配体RHBS和Zn(Ⅱ)的总浓度恒定为100 μmol/L,通过逐步改变配体和Zn(Ⅱ)间的配比,以寻找荧光发射强度最大比值。如图6所示的Job’s Plot,当Zn(Ⅱ)占比为0.5时,荧光发射强度最大。因此,可以确定配体RHBS与Zn(Ⅱ)之间是以1∶1的方式形成配合物[RHBS-Zn(Ⅱ)]。
综合上述,可以推断出Zn(Ⅱ)是以1∶1的方式与席夫碱配体RHBS亚胺基中的N原子、羰基中的O原子及酚基中的O原子配位,形成锌离子配合物[RHBS-Zn(Ⅱ)]。推测的配位结构模型如图7所示。

图6 RHBS与Zn(Ⅱ)的Job’s Plot

图7 配体RHBS与Zn(Ⅱ)的配位机制
3 结 论
本文通过简单的制备方法合成了一种新型罗丹明席夫碱化合物,该化合物与锌离子配合制得新型配合物[RHBS-Zn(Ⅱ)]。实验结果表明:配合物[RHBS-Zn(Ⅱ)]与锌离子是以1∶1的方式结合,Zn(Ⅱ)与席夫碱配体RHBS碳氮双键中的N原子、碳氧双键中的O原子及酚基中的O原子配位形成的。当配合物在556 nm波长处激发时,发光峰波长在587 nm,呈现红光发光性能,且发光量子效率15.1%。因此,这种新型的配合物[RHBS-Zn(Ⅱ)]是一种较好的红光发光材料。同时配体RHBS对Zn(Ⅱ)在587 nm发光波长具有很好的荧光选择性,并且不受其他金属离子的干扰。因此,RHBS也是一种潜在的Zn(Ⅱ)荧光探针材料。
