人参皂甙Rb1通过促肺泡细胞线粒体自噬以抑制凋亡在大鼠肺气肿模型治疗的机制
2020-04-28潘志鹏王俊段晨霞陈嘉平魏成功
潘志鹏 王俊 段晨霞 陈嘉平 魏成功
肺气肿是全球统一认定的一大医学难题,经过长期的的研究显示:该病主要是以肺泡实质性损伤相关及进一步的慢性气道炎症浸润有关[1]。目前临床上认为此过程为渐进性加重,不可逆转,同时亦缺乏明确有效的治疗手段。人参皂甙Rb1(GS-R1)是人参皂甙中最主要的活性物质,在损伤后具有抗炎作用[2]。目前GS-Rb1的细胞保护作用多集中在神经系统及心血管系统方面有关[3-4],而在呼吸系统方面涉及较少。线粒体自噬为细胞清除体内受损的线粒体,缓解凋亡通路激活的保护性反应。本研究通过肺气肿形成后调控肺泡线粒体自噬功能,明确 GS-Rb1下调肺泡细胞凋亡的相关性,旨在探讨GS-Rb1对肺气肿治疗作用的具体机制,为肺气肿分子水平的治疗奠定基础。
资料与方法
一、实验动物、试剂及仪器
40只体重150~200g的雄性SD大鼠由中山大学实验动物中心提供(许可证号SCXK粤2011-0029)、猪胰蛋白酶(PPE)(Roche/美国)、 GS-Rb1 (上海邦景/中国),氯喹 (Sigma/美国)、anti-LC3-B(sigma/美国)、anti-P62 (Abcam/英国)、anti-PGC-1a(Novus Biologicals/美国)、anti-mtTFA(Abcam/英国)anti-Cyto C(Abcam/英国)、anti-Bax(Abcam/英国)、anti-Bcl-2(Santa Cruz/美国)、anti-GAPDH(Abcam/英国)、辣根酶标记二抗 (江莱生物/中国)、化学发光试剂盒(中山金桥生物科技/中国)、所有ELISA试剂盒(武汉博士德生物/中国)、蛋白电泳仪(Bio-Rad/美国)、M200Pro免疫酶标仪(TECAN/奥地利)。
二、 动物模型制作
实验用大鼠在通风房间内按照光照:黑暗时间比例为12:12 h,给予水和食物适应性喂养1周,动物伦理已得到广州中医药大学附属广东中西医结合医院医院实验动物伦理委员会的同意。将体积分数为10%的水合氯醛以30 mg/kg给予大鼠腹腔注射麻醉满意后,将大鼠固定于操作平台,以颈部正中切口进入,分离颈部肌肉暴露气管并将4号注射器头刺入以维持PPE(1u/g)的持续性滴入,最后再注入2mL空气,以保证PPE完全进入气管,随后缝合切口,再将大鼠立直旋转,按摩双侧胸腔,以促进PPE均匀分布于双肺中。阴性对照组给予相同的手术过程,并注入等量的PBS。待动物清醒后,放入原鼠笼中,以普通固体饮食,培养至12周至肺气肿模型成功建立。
三、药物的干预及分组
40只SD大鼠被随机分为①阴性对照(Control)组、②GS-Rb1治疗(PPE+ GS-Rb1)组、③GS-Rb+氯喹(CLQ)阻断(PPE+GS-Rb1+CLQ)组、④肺气肿组(PPE)组。①气管给予PBS,②③均采用气管内给予PPE法制作肺气肿模型,建模12周肺气肿形成后,分别隔日腹腔注射GS-Rb1(40 mg/kg)及GS-Rb1(40 mg/kg)+CLQ(3 mg/kg)(按照Chen W等人的前期实验方法)[3],④肺气肿形成后不给予处理,各组均继续饲养2周开始实验。根据我们之前预实验及前期实验显示,为获得P值在0.05水平,1-beta在0.20水平,根据Effect-Size计算出所需要的每组动物数量为8(G-Power3.0)。在本实验中,我们预定每组10只动物,以防动物意外死亡引起样本量的不足。
四、ELFA法对支气管肺泡灌洗液(Bronchoalveolar lavage fluid, BALF)中NAPDH氧化酶活性的测定。
大鼠称重,给予水合氯醛腹腔麻醉(具体同前),按原切口进入,无菌条件下暴露气管与肺门,于右主支气管处结扎右肺,以Hanks液5mL*6次行左肺灌洗,共计30毫升回收的BALF存入硅胶管中,离心后取上清液,分装于试管内,并在-20摄氏度保存。将上述上清液置入96孔荧光板中,再加入80ulPBS及6.25ul的1M的光泽精,再加入100uM的NAPDH后开始发生反应。采用多功能酶标仪,在吸收波长340nm,检测速度30秒,时间为5 min。
五、BALF中总细胞数及中性粒细胞百分比计数
采用1.4部的BALF离心后的沉淀物,离心后加入生理盐水中,定容至200 μL,混匀后置入细胞涂片离心机,1000转/分*10 min,再1500转/分*5 min,涂好的细胞涂片进行瑞氏-吉姆萨染色,400*光学显微镜下进行炎细胞的分类及计数
六、HE染色观察肺气肿病理学改变
将左肺组织标本去除血管及结缔组织,取部分肺组织,多聚甲醛固定、脱水、石蜡包埋,再经苏木素-伊红染色(HE染色)病理切片,显微镜下观察大鼠肺气肿情况。采用肺泡平均内衬间隔(MLI),在MetaMorph/UIC/US病理图像分析系统视野正中划“十”字,计数通过该十字的肺泡间隔数(Ns),测定十字线总长度(L),MLI=L/Ns,其数值反应肺泡平均直径,计数平均肺泡数,病理图像分析系统下每个视野面积计数所含肺泡数,MAN=该视野肺泡数/该视野面积,其数值反应平均肺泡密度。
七、免疫蛋白印记(WB)实验
将左肺剩余组织标本用冰冷的PBS洗涤两次;加入RIPA裂解缓冲液(Santa Cruze),含1%的蛋白酶抑制剂混合物。冰上匀浆、裂解10min,低温离心12000转/分*15 min,收集上清液,BCA法测定蛋白浓度。取30ug总蛋白,经12%的SDS-PAGE Gel电泳分离,常规方法转印至硝酸纤维素(NC)膜上,5%脱脂牛奶-TBST封闭2 h,再分别将anti-LC3-B(1 ∶1000)、anti-P62(1 ∶1500)、anti-PGC-1a(1 ∶1000)、anti-mtTFA(1 ∶1000)anti-Cyto C(1 ∶1000)、anti-Bax(1 ∶1000)、anti-Bcl-2(1 ∶1000)、anti-GAPDH(1 ∶2500)加入封闭液,4摄氏度轻摇过夜,回收一抗液体,给予TBST溶液洗涤NC膜,加入辣根酶标记二抗与封闭液按1 ∶2000的比例混合液,37摄氏度下,孵育1 h,再采用化学发光试剂盒进行发光显影。采用Image J 1.36b软件下行吸光度分析,以Control组LC3-Ⅱ/LC3-Ⅰ比值100%,其余组的LC3-Ⅱ/LC3-Ⅰ比值与之比较,其它蛋白以吸光度值/GAPDH为相对含量,以Control组目标蛋白/GAPDH为100%,其余组与之进行比较。
八、统计学分析
结 果
一、GS-Rb1可明显降低BALF中NAPDH氧化酶的活性,并且可被自噬抑制剂所抑制。
PPE+GS-Rb1组的NAPDH氧化酶活性尽管较Control组升高(P<0.05),但相对于PPE组却明显降低(P<0.05),具有治疗效应。采用自噬抑制剂CLQ后,此种效应可被明显抑制(P<0.05)(见表1)。

表1 NAPDH氧化酶活性的变化(n=10)
各实验组与Control组比较:*P<0.05,PPE+GS-Rb1+CLQ组与PPE+GS-Rb1组比较:#P<0.05,PPE+GS-Rb1与PPE比较:▽P<0.05。
二、GS-Rb1可明显降低BALF中细胞数及中性粒细胞百分比,且可被自噬抑制剂所抑制。
给予GS-Rb1治疗后,BALF中白细胞数及中性粒细胞的百分比均较PPE组明显降低(P<0.05),与Control组无明显差异(P>0.05)。但CLQ可明显降低GS-Rb1的此种保护效应(P<0.05)(见表2)。

表2 BALF中白细胞数及中性粒细胞的百分比
各实验组与Control组比较:*P<0.05,PPE+GS-Rb1+CLQ组与PPE+GS-Rb1组比较:#P<0.05,PPE+GS-Rb1与PPE比较:▽P<0.05。
三、GS-Rb1可明显缓解肺气肿的病理学改变,且可被自噬抑制剂所抑制。
PPE组大鼠肺泡腔融合、肺泡间隔断裂、气道上皮细胞排列紊乱、局部上皮细胞增生、管壁粗厚、周围伴有炎症细胞浸润。在给予GS-Rb1治疗后,肺泡腔扩大程度明显好转,肺泡间隔增宽减少,少量炎性细胞浸润,但在给予自噬抑制剂CLQ后,可明显阻断GS-Rb1的此种治疗作用。PPE+GS-Rb1+CLQ组MLI明显高于Control及PPE+GS-Rb1组(P<0.05),而MAN明显低于Control及GS-Rb1治疗组(P<0.05)(见图1、表3)。

图1 肺组织病理学切片 ×200
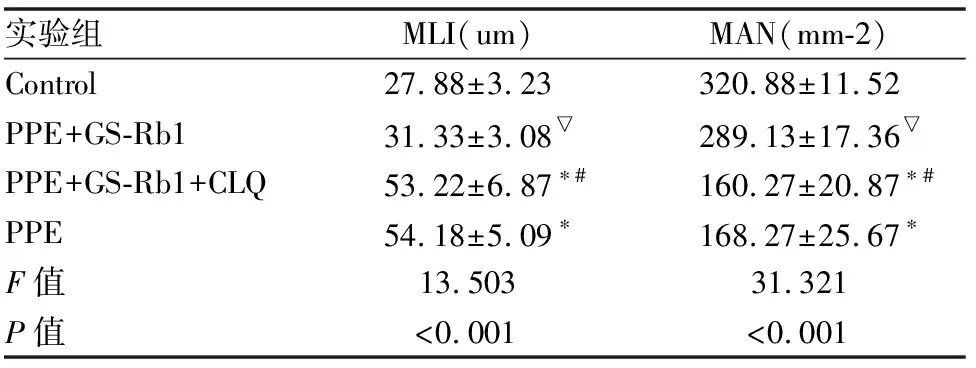
表3 各组大鼠MLI/MAN的变化
各实验组与Control组比较:*P<0.05, PPE+GS-Rb1+CLQ组与PPE+GS-Rb1组比较:#P<0.05,PPE+GS-Rb1与PPE比较:▽P<0.05。
四、GS-Rb1使用后可明显上调肺泡细胞的自噬功能。
相对于PPE组,GS-Rb1治疗后自噬相关蛋白LC3Ⅱ/LC3Ⅰ比例明显升高,P62表达明显降低(P<0.05)。同时自噬抑制剂CLQ则可明显抑制GS-Rb1的此种效应(见图2)。

图2 自噬相关蛋白的表达(n=10)
各实验组与Control组比较:*P<0.05,PPE+GS-Rb1+CLQ组与PPE+GS-Rb1组比较:#P<0.05, PPE+GS-Rb1与PPE比较:▽P<0.05。
五、GS-Rb1可明显上调肺泡细胞线粒体功能相关蛋白PGC-1a、mtTFA表达,并且和自噬有关。
GS-Rb1可明显上调损伤后肺泡细胞中PGC-1a及mtTFA(P<0.05),其中PGC-1a与Control组无明显差异(P>0.05),同时此种效应可被CLQ明显的抑制((P<0.05)(见图2)。
六、GS-Rb1可通过激活自噬上调凋亡抑制因子Bcl-2的表达,同时下调凋亡促进因子Bax及凋亡标志蛋白Cyto C的表达。

图3 PGC-1a及mtTFA表达的变化(n=10)
*各实验组与Control组比较:*P<0.05, PPE+GS-Rb1+CLQ组与PPE+GS-Rb1组比较:#P<0.05,PPE+GS-Rb1与PPE比较:▽P<0.05。
GS-Rb1治疗组较PPE组可明显降低促凋亡蛋白Cyto C, Bax及升高凋亡抑制蛋白Bcl-2表达(P<0.05),但给予自噬抑制剂CLQ后,则可明显抑制GS-Rb1的此种效应(P<0.05)(见图4)。
讨 论
随着现在大气环境的恶化,肺气肿的发病率呈逐年上升的趋势,成为危害人类健康的主要疾病之一。目前对于肺气肿的发病机制仍不完全明确,普遍认为是肺泡细胞凋亡、氧化应激反应的增强及炎性细胞浸润为主,呈不可逆转性,且目前临床上对此缺乏有效的治疗药物。

图4 凋亡蛋白Cyto C, Bax及凋亡抑制蛋白Bcl-2的表达(n=10)
各实验组与Control组比较:*P<0.05, PPE+GS-Rb1+CLQ组与PPE+GS-Rb1组比较:#P<0.05,PPE+GS-Rb1与PPE比较:▽P<0.05。
人参皂甙(GS)已被证明是人参的最主要的活性成分。目前有大量的实验证明,GS具有抗炎、抗氧化及降低脂质类代谢产物的作用[5]。Rb1则作为GS中含量最为主要的成分,而得到越来越多的重视。目前对于GS-Rb1研究注意涉及于神经损伤后修复方面,GS-Rb1具有抑制氧化应激因子NOX1、NOX2、NOX4、NAPDH的功能[3]。但以上的研究尚未对GS-Rb1参与调节的损伤因子的具体机制进行深入分析。
目前针对于GS-Rb1的研究多集中在神经损伤的疾病中。有研究显示,GS-Rb1对脑损伤的缓解可能和其对Cx40的上调的抑制有关[6],而Cx40的异常升高则与线粒体-内质网紊乱引起的氧化应激的增强密切相关[7]。而在本实验中,我们在给予大鼠GS-Rb1后,可显著抑制肺泡细胞中NAPDH氧化酶的活性,降低炎症细胞的浸润,同时缓解肺气肿的病理性损伤。因此本实验也明确了GS-Rb1对肺泡细胞的保护作用与线粒体损伤后修复有关,这也为我们下一步深入探讨GS-Rb1与肺泡细胞线粒体自噬相关性奠定了基础。
自噬是存在与真核细胞中的生命现象,在正常细胞中自噬活性较低。而大量的研究则显示,自噬与损伤性疾病密切相关。当细胞处于组织损伤、缺血缺氧所导致的内质网应激等情况下,自噬通过哺乳动物雷帕霉素靶蛋白依赖性通路(mTOR)被激活,从而通过清除细胞内受损的细胞器、蛋白质,以维持细胞内稳态。线粒体自噬是目前研究的较多的一种自噬形式,是选择性清除受损的线粒体的过程。线粒体在损伤后可因:(1)ROS过度累积而导致自身DNA损伤,产生结构及功能的紊乱;(2)ATP减少所致的钙超载;(3)线粒体膜通透性改变,其膜间隙的细胞色素C及促凋亡蛋白释放入胞浆,引起细胞凋亡。近来的研究显示,自噬早于凋亡的出现,并可通过清除受损的线粒体而抑制凋亡[8]。近年来的研究也显示,氧化应激促进因子 Cx40的清除也与自噬明确相关[9],这提示,线粒体自噬可能通过抑制氧化应激下游的炎性产物的增多而起到细胞保护作用,在本实验中,我们使用GS-Rb1后,可明显上调肺泡细胞LC3Ⅱ/LC3Ⅰ的比例、下调P62的表达、抑制线粒体功能蛋白PGC-1a及mtTFA及凋亡抑制蛋白Bcl-2的下调,而凋亡促进因子Bax及Cyto C的表达的上调受到明显的抑制,而自噬抑制剂CLQ则可明显的抑制此种效应,这证明GS-Rb1可能通过增强线粒体自噬的作用,从而抑制肺泡细胞的凋亡。
结合上述的情况,我们认为GS-Rb1肺泡保护效应可能与线粒体自噬的激活、线粒体功能的保护、凋亡及氧化应激抑制有关。在此基础上,我们下一步将注重于GS-Rb1对自噬相关基因及信号传导通路的的研究,为进一步了解GS-Rb1通过自噬参与细胞的保护机制及为肺气肿的的基因靶点治疗奠定基础。
