186例耳聋患者线粒体DNA 12S rRNA基因筛查及家系分析
2020-04-28戴显宁陈茜王倩王海坚童郁许锴
戴显宁 陈茜 王倩 王海坚 童郁 许锴
耳聋是造成儿童言语交流障碍的最常见原因之一。据全国第二次残疾人抽样调查显示,我国现有的听力障碍患者约2 000余万,其中0~6岁听力障碍儿童超80万。50%以上的听力障碍儿童是遗传性易感体质,且90%以上的聋儿出生于听力正常、没有耳聋家族史的家庭[1]。由于耳毒性药物使用不当导致的听力障碍儿童约占30%~40%[2-4],其中20%~30%的药物性耳聋患者存在线粒体DNA(mtDNA)突变[5-6]。研究报道位于mtDNA 12S rRNA基因上的1494C>T及1555A>G位点突变可使部分携带者对氨基糖甙类抗生素超敏感,从而出现临床上常见的“一针致聋”现象[7-10]。因此,本研究通过对温州市特殊教育学校186例耳聋患者进行mtDNA 12S rRNA基因筛查及家系分析,明确部分药物性耳聋患者的发病原因,提高患者用药安全性,通过遗传咨询为下一代防聋治聋提供依据,现报道如下。
1 对象和方法
1.1 对象 2016至2018年期间温州市人民医院共对温州特殊教育学校192例耳聋患者进行耳聋基因筛查,排除3例Warrdenburg综合征、2例Pendred综合征以及1例耳聋伴骨骼发育异常患者,最终本研究共纳入186例非综合征耳聋患者作为研究对象。排除标准:(1)明确有外耳或中耳先天性畸形患者;(2)综合征性耳聋患者;(3)伴有其它先天性疾病患者(如:先天性心脏病、染色体异常等)。其中男104例,女82例;年龄6~16(11.4±2.9)岁;37例有使用氨基糖甙类药物史,占19.9%。临床资料以书面问卷调查形式开展,包括患者的发病诱因、发病年龄、听力损失严重程度、抗生素用药史、家族遗传史等。本研究经温州市人民医院医学伦理委员批准,检查前告知患者监护人基因筛查可能存在的风险并签署知情同意书。
1.2 方法
1.2.1 听力检测 由温州市人民医院的耳鼻喉科医师在温州特殊教育学校使用AD266纯音听阈测试仪对患者进行听力检测,听力损失严重程度按世界卫生组织耳聋分级标准分类[11],见表1。

表1 听力损失分级标准
1.2.2 mtDNA 12S rRNA基因筛查 患者均抽取静脉血3~5ml,EDTA-K2抗凝。采用苏州天隆生物科技有限公司试剂盒(批号:E0819050121)提取全血基因组DNA,提取过程严格按照试剂盒说明书操作。用德国恒通SMA-4000型紫外分光光度计测定DNA浓度和纯度,待测DNA于-20℃保存。mtDNA 12S rRNA目的片段引物设计参照文献[12],并由杭州擎科生物工程技术有限公司合成,Mit-1F:5′-CTCCTCAAAGCAATACACTG-3′;Mit-1R:5′-TGCTAAATCCACCTTCGACC-3′;Mit-2F:5′-CGATCAACCTCACCACCTCT-3′;Mit-2R:5′-TGGACA ACCAGCTATACCA-3′。PCR反应条件:94℃预变性5 min;94℃变性 30 s,58℃退火 30 s,72℃延伸 45 s,35 个循环;72℃延伸10min。PCR产物送至杭州擎科生物工程技术有限公司进行Sanger测序。
1.2.3 结果分析 测序结果采用DNAstar2.0生物学软件进行分析。采用Clustal X 2.0生物学软件将人类mtDNA 12S rRNA基因序列与12种灵长类动物相应序列进行种间并对,计算保守指数(conservation index,CI)。CI≥75%时提示该位点较保守[13]。
2 结果
2.1 患者mtDNA 12S rRNA基因筛查结果 186例患者mtDNA 12S rRNA基因共筛查出变异类型16种(均已有报道)。与氨基糖甙类明确相关的1555A>G位点突变10例,占5.4%,其中男7例,女3例,听力损失程度从轻度至极重度不等。计算变异位点保守性发现CI>75%的变异位点包括 827A>G、1095T>C、1107T>C、1382A>C、1431G>A、1541T>C、1555A>G,见表 2。
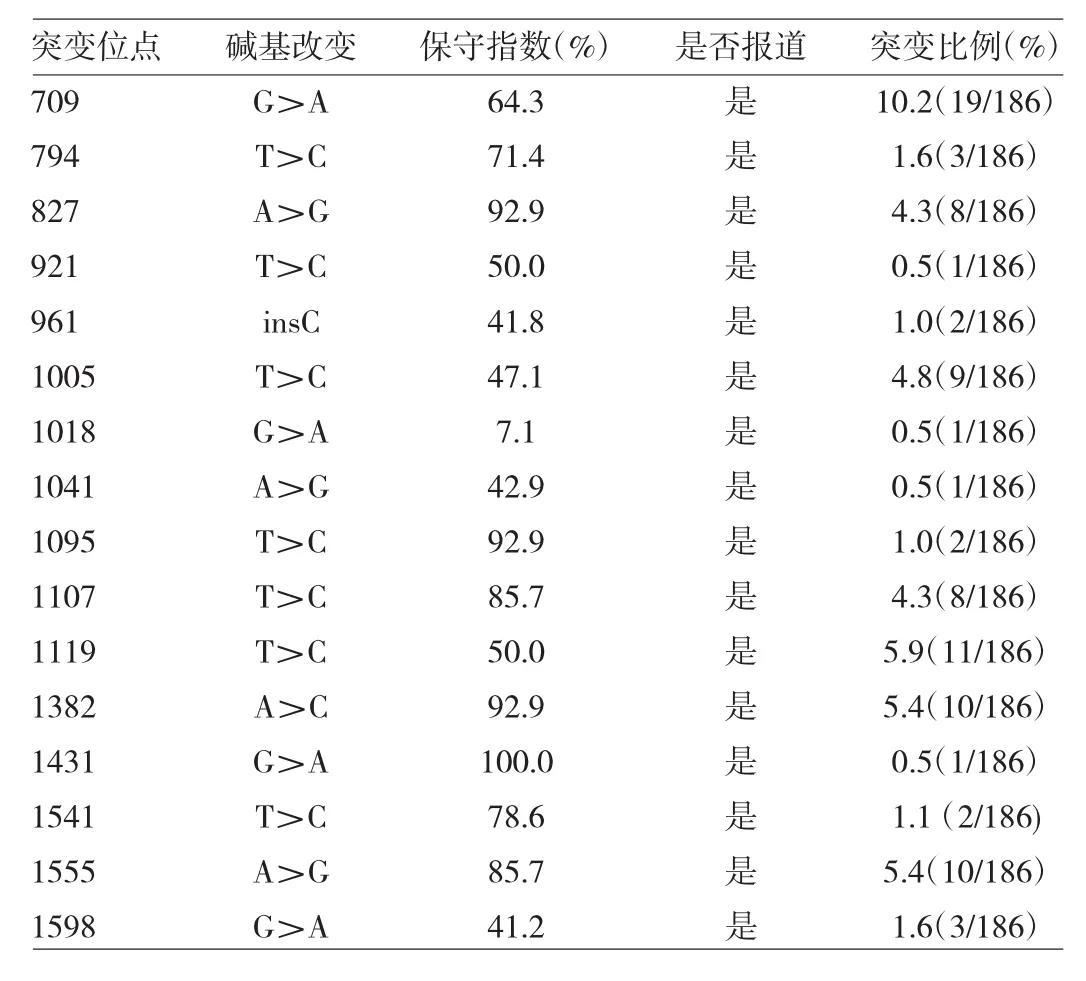
表2 186例患者mtDNA 12S rRNA基因筛查变异位点
2.2 携带mtDNA 12S rRNA基因1555A>G位点突变患者家系分析 该10例患者的家系评估、遗传学特征分析显示家系平均耳聋外显率(母系成员耳聋患者/所有母系成员)约为26.8%。听力损失程度和发病年龄也表现出一定程度差异(表3),母系成员多表现为听力正常,呈散发性。其中WZ-152家系存在1555A>G和1095T>C双位点突变,WZ163家系存在1555A>G和961insC双位点突变。7个家系的先证者(家系中第1个被本研究确诊为耳聋的人,即本研究耳聋基因检测患者,家系图中箭头所示)有氨基糖甙类药物史,耳聋外显率分别为 33.3%、20.0%、28.6%、50.0%、20.0%、42.9%、25.0%,平均外显率为31.4%。3个非药物耳聋家系的外显率分别为16.7%、25.0%、25.0%;平均外显率为22.2%,见图1。
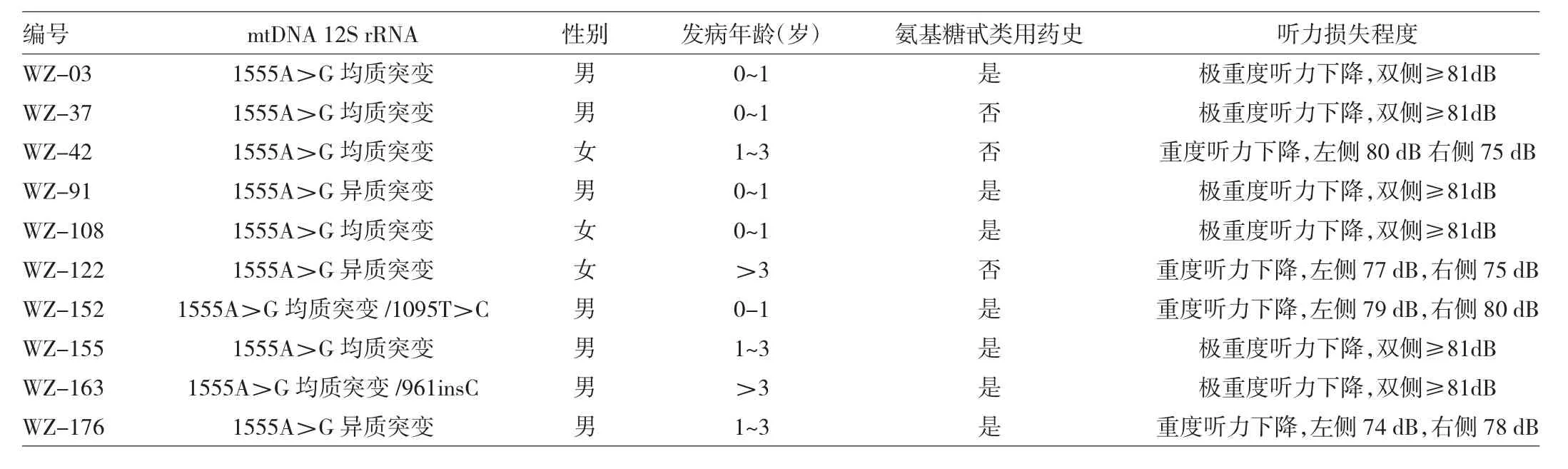
表3 10例携带mtDNA 12S rRNA基因1555A>G位点突变患者相关临床资料
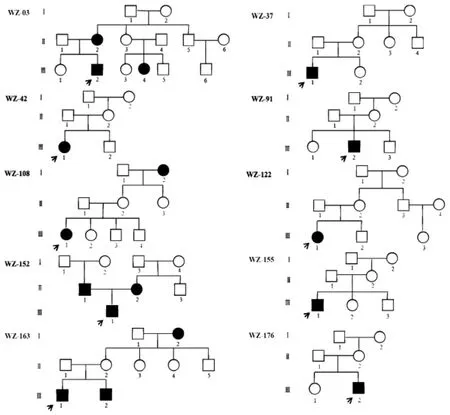
图1 10例携带mtDNA 12S rRNA基因1555A>G位点突变患者家系图(箭头所指为先证者)
3 讨论
耳聋是严重影响人们正常生活的常见健康问题之一,其中药物性耳聋是新生儿先天性或后天性聋及成人后天性耳聋的主要原因,约20%~30%的药物性耳聋患者因存在mtDNA突变,对氨基糖甙类药物极其敏感。氨基糖甙类抗生素致聋可分为两类,一类因使用耳毒性药物而致聋;另一类有遗传背景或易感体质,即携带mtDNA 12S rRNA的1494C>T及1555A>G突变位点。这类人群接触一次或低剂量氨基糖甙类药物即可能致听力损失。耳聋患者多在用药数天后出现听力下降,逐步加重。且临床表现上主要以耳聋、耳鸣为主,多双侧对称及高频听力缺失,可逐渐向低频听力缺失发展,少数患者甚至继续恶化,至全聋。
本研究通过对温州特殊教育学校186例耳聋患者mtDNA 12S rRNA检测,筛选出变异类型16种,其中与药物性耳聋相关的1555A>G位点突变10例,突变率为5.4%,低于李守霞等[14]报道的邢台市特教学校耳聋患者1555A>G位点突变的7.5%,高于彭光华等[15]报道的浙江省7所聋校456例患者1555A>G位点突变的4.4%。可能原因为样本入选数量、地区性差异,环境因素及遗传背景等在疾病的发生发展与表现上有着不同程度的影响。龚莎莎等[15]研究报道称仅在中国患者和西班牙患者家系中发现了1494C>T位点突变,但本研究结果未见1494C>T位点突变。此外,本研究还发现其他一些可能与耳聋相关的突变位点,如彭光华等[16]报道的1095T>C位点,CI高达92.9%,该位点在对照组和一些药物性耳聋患者中均有出现,可能造成结构上一定程度的改变,具有功能意义,但本身不足以造成耳聋表型。同样也有研究表明961 insC位点可能也与非综合征聋有关[17]。1999年,Casano等[18]报道了1例氨基糖甙类药物致聋家系同时存在A1555G和961insC双位点突变,该研究表明961位点C插入可能导致mtDNA 12S rRNA的结构发生改变,从而影响氨基糖甙类药物的结合。但目前尚无关于961insC位点突变单独导致耳聋发生的情况报道,因此提示961insC可能协同A1555G突变增加家系中耳聋外显率及表现度,导致A1555G突变患者对氨基糖甙类药物产生超敏性。此外,其余变异位点在对照组和患者中携带比率都较高或者CI较低,可能是线粒体单体型特异位点[19]。
本研究186例非综合征耳聋患者中明确有氨基糖甙类药物史占19.9%,但与药物性耳聋相关的1555A>G位点突变率仅为5.4%,可能是由于本研究仅筛查了mtDNA 12S rRNA相关热点区域,导致了由于mtDNA上其他继发位点突变造成的药物性耳聋患者的漏筛。因此,需进一步完善本研究mtDNA上其他位点的筛查。从10例携带1555A>G位点突变的耳聋家系图中可以看出,只有小部分母系成员表现耳聋,而绝大多数成员都表现为听力正常,平均外显率仅26.8%,听力损失程度和发病年龄也表现一定程度差异性,且同一家系母系成员或不同家系成员之间在听力损失严重程度、抗生素使用情况及耳聋外显率等方面均存在明显差异,提示1555A>G基因突变本身可能不是造成耳聋的唯一原因,可能原因是区别于核基因突变,mtDNA突变存在阈值效应,当突变的mtDNA达到一定的比例时,才有受损的表型出现,即同质突变和异质突变。但不同个体细胞内突变mtDNA阈值又受核基因、环境等影响而呈现个体差异性。从而导致部分携带者用药后仍表现听力正常或轻度下降。因此其他修饰因子如继发突变、线粒体单倍型和核修饰基因等可能参与调节耳聋的外显率及表型表达[20]。
由此可见,mtDNA 12S rRNA突变是部分氨基糖甙类药物致聋患者的分子基础,但突变并不是造成耳聋的唯一因素,其他修饰因子如继发突变、线粒体单体型和核基因调控等均有可能影响耳聋的外显率及表型表达。但对于基因携带者可以通过评估家族成员药物敏感史和mtDNA基因筛查提高耳聋患者使用氨基糖甙类抗生素治疗的安全性,同时对于耳聋患者婚配及生育指导有着重要的社会意义,可为下一代防聋治聋提供依据。
