绿原酸对颞下颌关节软骨细胞增殖、凋亡和炎症因子释放的影响及作用机制研究
2020-04-28陈昕婷林微微陈建治
陈昕婷 林微微 陈建治
颞下颌关节紊乱病是一类临床症状表现为颞下颌关节区疼痛、异常关节音或伴有下颌运动障碍的疾病的总称,人群中发病率为20%~40%,是口腔科常见病、多发病之一[1]。颞下颌关节骨关节炎是颞下颌关节紊乱病的一种重要类型,是一类主要累及颞下颌关节髁突软骨、滑膜及软骨下骨的以关节软骨和软骨下骨骨质改变为主要特征的器质性病变[2]。研究显示,颞下颌关节骨关节炎的发生与软骨细胞增殖、凋亡、炎症因子释放和软骨基质减少密切相关[3]。绿原酸又名咖啡鞣酸,是由咖啡酸和奎尼酸形成的缩酚酸,为极性有机酸。绿原酸的生物活性广泛,随着研究的深入,许多新的药效被陆续挖掘,包括抗感染、抗病毒、抗肿瘤、抗氧化、抑菌等[4-5]。绿原酸能够通过抑制NLRP3炎性复合体/核因子κB(NF-κB)通路发挥对关节炎的治疗作用[6],但其作用机制尚不完全明了。基于此,本研究采用不同浓度绿原酸干预白细胞介素1β(IL-1β)诱导的颞下颌关节软骨细胞损伤,分析绿原酸对软骨细胞增殖、凋亡和炎症因子释放的影响,以探讨绿原酸对颞下颌关节骨关节炎的保护作用机制,现报道如下。
1 材料和方法
1.1 材料
1.1.1 细胞来源 取6周龄雄性SD大鼠购自上海斯莱克公司,体重140~160g,由浙江中医药大学动物研究中心在25℃,空气湿度65%的环境中统一喂养。采用胰蛋白酶消化法[7]获取原代颞下颌关节软骨细胞,具体方法为戊巴比妥钠麻醉下处死SD大鼠,75%乙醇消毒10min,在超净台中切取颞下颌关节髁突软骨,剪成小块并碾磨,在37℃胰蛋白酶溶液中培养2h;倒掉胰蛋白酶消化液,使用磷酸盐缓冲液冲洗,然后在37℃的0.2%胶原酶溶液中培养过夜;消化后以800r/min离心15min收集原代颞下颌关节软骨细胞。
1.1.2 主要试剂 含量≥98%的绿原酸购自杭州诺扬生物技术有限公司;重组人IL-1β购自上海生工生物科技有限公司;DMEM/F-12培养基购自美国Gibco公司;胎牛血清购自美国Gibco公司;CCK-8试剂盒购自上海碧云天生物技术有限公司;磷酸盐缓冲液和胰蛋白酶购自上海碧云天生物技术有限公司;RNA逆转录试剂盒购自日本TaKaRa公司;TRIzol购自美国Promega公司;RNA扩增试剂盒购自日本TaKaRa公司;PCR引物购自上海生工生物科技有限公司;蛋白提取试剂盒购自上海碧云天生物技术有限公司;PVDF膜购自美国Millipore公司;兔抗人Wnt-5A、Ror2和GAPDHL均购自美国Sigma-Aldrich公司;HRP标记的羊抗兔IgG购自美国Abcam公司。
1.1.3 主要仪器 PCR扩增仪(0900544s型)购自德国Eppendorf公司;恒温振荡器(THZ-C-1型)购自苏州培英实验设备有限公司;台式冷冻离心机(5804R型)购自德国Eppendorf公司;离心浓缩仪(TDZ4-WS型)购自长沙湘智离心机仪器有限公司;低温超速离心机(CT15RE型)购自日本Himac公司;低温储存箱系列(HYC-360型)购自中国Haier公司;超低温冰箱(MDF-U54V型)购自日本Panasonic公司;光学显微镜(SOIF、XSP-ZCA型)购自上海光学仪器工厂;恒温培养箱(SPX-250B-Z型)购自上海博迅医疗生物仪器股份有限公司;蛋白电泳仪(Powerpmac 043BR80551型)购自美国BIO-RAD公司;高速离心机(5424型)购自德国Eppendorf公司;流式细胞仪购自美国BIO-RAD公司。
1.2 方法
1.2.1 细胞培养与干预 软骨细胞在含有10%胎牛血清的DMEM/F-12培养基中于37℃、5%二氧化碳条件下在细胞培养箱中培养。将软骨细胞分为模型组、实验组、对照组。模型组细胞采用含10ng/ml IL-1β的培养基进行培养,实验组细胞采用含10ng/ml IL-1β和不同浓度绿原酸(10、20、40、80 和 160μmol/L)的培养基进行培养,对照组细胞进行常规培养。
1.2.2 细胞增殖实验 采用CCK-8法。取对数生长期的软骨细胞,不同组的细胞以1×105个/孔的密度接种到96孔培养板中,每组设置5个复孔,在37℃、5%二氧化碳条件下分别培养24、48h,每孔加入10μl的CCK-8溶液,在培养箱中继续培养2h后于酶标仪中测定细胞在450nm的OD值。
1.2.3 细胞凋亡实验 采用流式细胞术。取对数生长期的软骨细胞,不同组的细胞以1×105个/孔的密度接种到12孔板中,胰蛋白酶消化收集培养48 h后细胞,磷酸盐缓冲液洗涤后制备成细胞悬液,然后加入10μl Annexin V-FITC和5μl碘化丙啶染色液,轻轻混匀,室温避光孵育20 min,用流式细胞仪检测细胞凋亡情况。
1.2.4 肿瘤坏死因子 α(TNF-α)、IL-6、基质金属蛋白酶 3(MMP-3)、MMP-13、Wnt-5A 和 Ror2 mRNA 表达检测 采用qRT-PCR法。不同组细胞培养48h后,采用TRIzol试剂从细胞中提取总RNA,通过紫外分光光度仪测定OD260/OD280值,取用OD260/OD280值在1.8~2.0的样本。采用RNA逆转录试剂盒将RNA反转录成cDNA,然后采用RNA扩增试剂盒通过实时定量PCR扩增cDNA。以GAPDH为靶基因内参,采用2-ΔΔCt法计算靶基因的相对表达水平。
1.2.5 Wnt-5A和Ror2蛋白表达检测 采用Western blot法。不同组细胞培养48h后,采用蛋白提取试剂盒提取细胞中的总蛋白,然后用BCA试剂盒检测蛋白浓度。每孔加入50μg的待测蛋白于SDS-PAGE凝胶,110V电泳后转膜至PVDF膜,5%脱脂奶粉37℃封闭1h,分别加入兔抗人Wnt-5A、Ror2和GAPDH一抗4℃孵育过夜,TBST洗膜 3×10min,二抗 37℃ 孵育1 h,TBST洗膜3×30min,ECL显影。运用Quantity One软件分析蛋白条带灰度值,以GAPDH作内参,计算相对表达水平。
1.3 统计学处理 采用SPSS 21.0统计软件。计量资料以表示,多组比较采用单因素方差分析,两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 绿原酸对细胞增殖的影响 采用IL-1β诱导软骨细胞损伤后,模型组、实验组细胞在24h和48h的增殖能力均较对照组明显减弱,差异均有统计学意义(均P<0.05)。在培养24h后,40μmol/L实验组较模型组细胞增殖能力增强,差异具有统计学意义(P<0.05),见图1a。在培养48h后,20、40和80μmol/L实验组较模型组细胞增殖能力均增强,差异均有统计学意义(均P<0.05),见图1b。因此在后续实验中选用20、40和80μmol/L的绿原酸对软骨细胞干预48h。
2.2 绿原酸对细胞凋亡的影响 采用IL-1β诱导软骨细胞损伤后,模型组、实验组细胞凋亡率较对照组均明显升高,但实验组细胞凋亡率低于模型组,差异均有统计学意义(均P<0.05),即 20、40和80μmol/L绿原酸均能明显抑制软骨细胞凋亡,见图2。
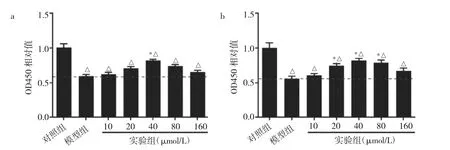
图1 绿原酸对细胞增殖的影响(a:培养24h的增殖能力比较;b:培养48h的增殖能力比较)
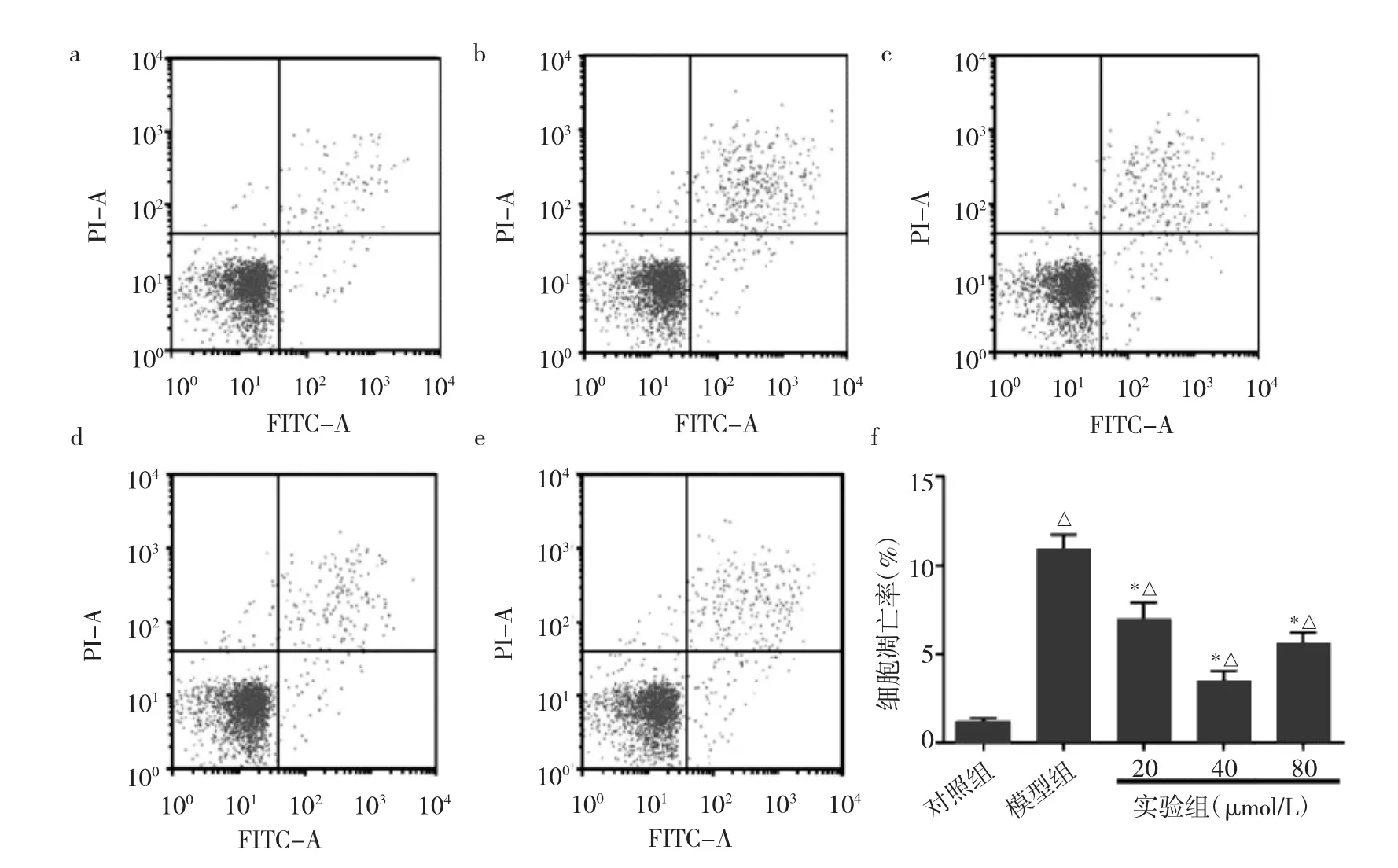
图2 绿原酸对细胞凋亡的影响(a:对照组细胞流式图;b:模型组细胞流式图;c:20μmol/L实验组细胞流式图;d:40μmol/L实验组细胞流式图;e:80μmol/L实验组细胞流式图;f:不同组软骨细胞凋亡率比较)
2.3 绿原酸对细胞炎症因子释放的影响 采用IL-1β诱导软骨细胞损伤后,模型组、实验组细胞炎症因子TNF-α和IL-6的mRNA表达水平均较对照组明显升高,MMP-3和MMP-13的mRNA表达水平亦均较对照组明显升高,但实验组细胞TNF-α和IL-6的mRNA表达水平均低于模型组,差异均有统计学意义(均P<0.05)。即20、40和80μmol/L绿原酸均能明显抑制软骨细胞TNF-α的mRNA表达水平,40和80μmol/L绿原酸均能明显抑制软骨细胞IL-6、MMP-3mRNA表达水平(均P<0.05)。40μmol/L实验组软骨细胞较模型组MMP-13的mRNA表达水平明显降低,差异具有统计学意义(P<0.05),见图 3。
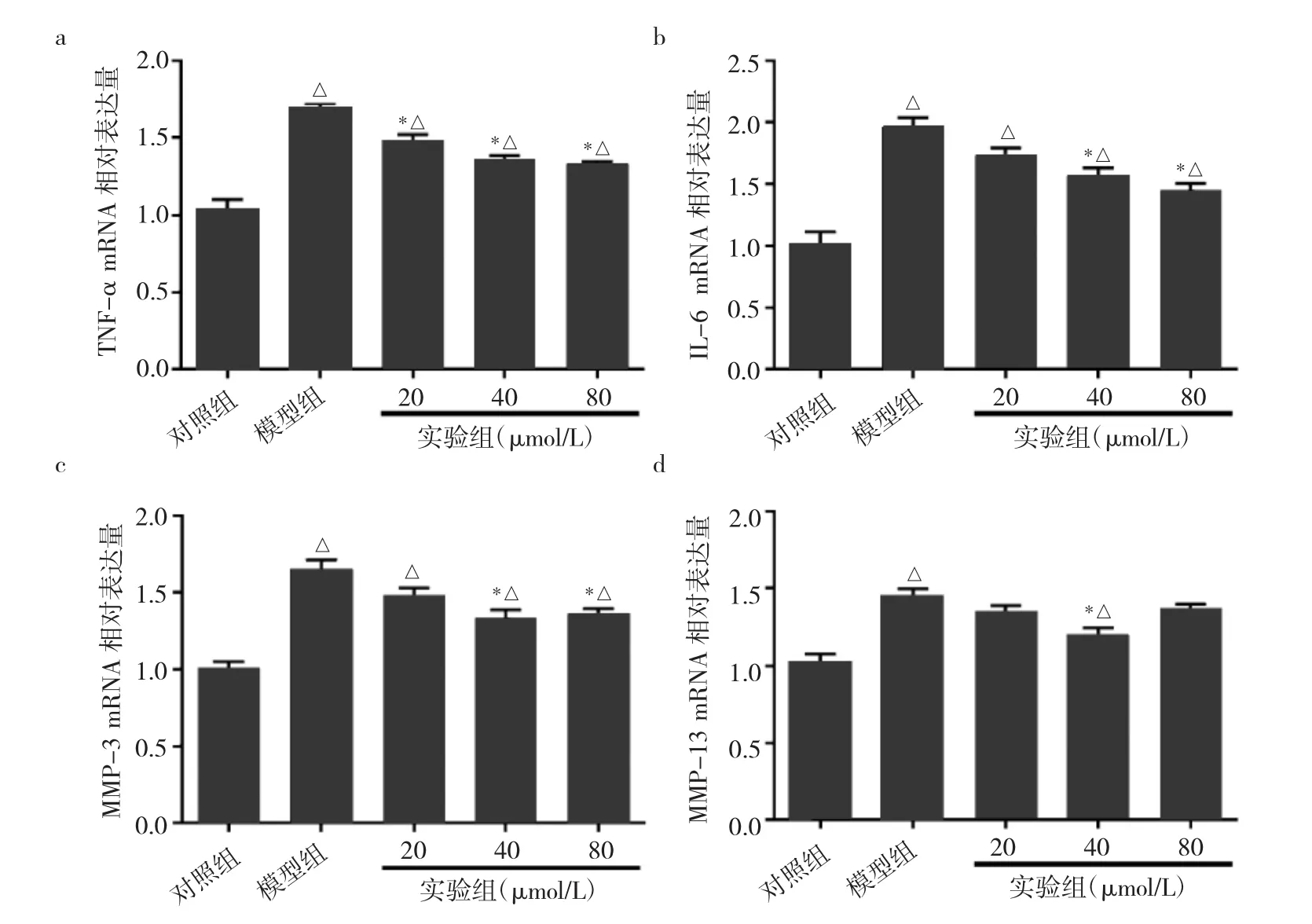
图3 绿原酸对细胞炎症因子释放的影响(a:TNF-α mRNA的表达水平比较;b:IL-6 mRNA的表达水平比较;c:MMP-3 mRNA的表达水平比较;d:MMP-13 mRNA的表达水平比较)
2.4 绿原酸对细胞Wnt-5A/Ror2信号通路的影响 采用IL-1β诱导颞下颌关节软骨细胞损伤后,模型组、实验组细胞中Wnt-5A、Ror2的mRNA和蛋白表达水平均较对照组明显升高,差异有统计学意义(均P<0.05)。20、40和80μmol/L实验组细胞 Wnt-5A、Ror2 mRNA 和蛋白的表达水平均低于模型组,差异均有统计学意义(均 P<0.05),见图 4。
3 讨论
颞下颌关节骨关节炎是一种以关节软骨损伤为主要特征,伴有滑膜及软骨下骨组织改变的关节退行性疾病,其发病率呈现逐年增多趋势,容易复发,严重影响患者的口腔功能和生活质量[8]。目前对颞下颌关节骨关节炎的常规治疗效果不理想,治疗方法多以保守治疗为主,包括服用非甾体类抗生素、局部理疗、关节腔注射药物等[9]。目前采用中药治疗颞下颌关节骨关节炎的研究尚少。
IL-1是一种重要的炎症因子,由IL-1α与IL-1β两种蛋白质组成,可与IL-1受体结合,从而激活下游炎症通路。其作为炎症的始动因子,在软骨细胞炎症反应和细胞凋亡过程中起到关键作用[10]。IL-1β可能通过刺激TNF-α、IL-6、ICAM-1等炎症因子的分泌和抑制胶原蛋白、组织金属蛋白酶抑制因子等的合成来干扰关节软骨细胞代谢,显著抑制软骨细胞合成基质,使软骨细胞变性及细胞外基质降解,引发关节炎症和破坏,是造成颞下颌关节器质性损害的一种重要炎症介质[11]。本研究采用IL-1β诱导颞下颌关节软骨细胞损伤,结果显示IL-1β能够明显抑制软骨细胞增殖、促进细胞凋亡和炎症因子的释放。这提示本研究IL-1β诱导颞下颌关节软骨细胞损伤造模成功。
研究显示,绿原酸可以降低关节液中IL-1β、TNF-α和MMP-3含量以及MMP-3酶活性,对关节软骨损伤具有一定的保护作用[12]。绿原酸可以提高内皮细胞线粒体膜电位、上调Bcl-2和下调Caspase,降低细胞凋亡率,对内皮细胞起保护作用[13]。同时绿原酸能够抑制软骨样细胞凋亡,降低细胞内的活性氧水平,稳定细胞的氧化还原状态来保护线粒体膜电位,促进凋亡抑制基因Bcl-2和抑制半胱氨酸蛋白酶表达有关[14]。本研究结果显示不同浓度绿原酸干预IL-1β诱导的颞下颌关节软骨细胞损伤后,绿原酸能够促进软骨细胞增殖,抑制软骨细胞凋亡,抑制 TNF-α、IL-6、MMP-3 和 MMP-13 的表达水平。这提示绿原酸在颞下颌关节软骨细胞中具有促进细胞增殖、抑制细胞凋亡和炎症因子释放的作用。
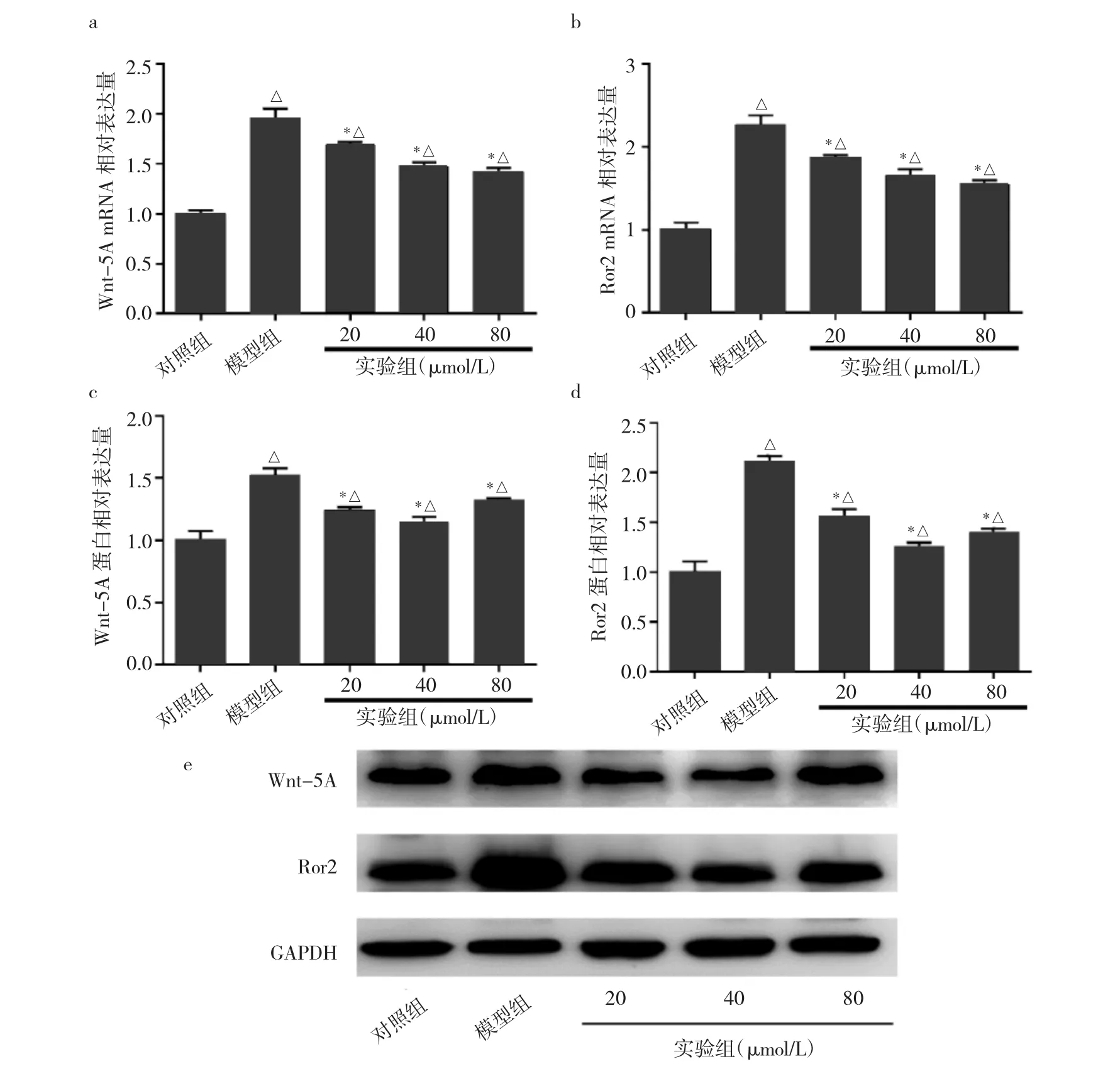
图4 绿原酸对细胞Wnt-5A/Ror2信号通路的影响(a:Wnt-5A mRNA的表达水平比较;b:Ror2 mRNA的表达水平比较;c:Wnt-5A蛋白的表达水平;d:Ror2蛋白的表达水平;e:Wnt-5A和Ror2蛋白电泳图)
基质金属蛋白酶是一组锌依赖性的对细胞外基质分解代谢起催化作用的蛋白水解酶,能降解几乎所有的软骨细胞外基质,在软骨细胞外基质的降解过程中发挥重要作用[15]。成纤维细胞、中性粒细胞、软骨细胞等多种细胞可分泌基质金属蛋白酶,基质金属蛋白酶以无活性酶原形式出胞,无活性酶原能被多种炎症因子激活,从而导致细胞外基质降解的发生[16]。本研究结果显示,绿原酸能够明显抑制MMP-3和MMP-13的表达,这提示绿原酸能够抑制颞下颌关节骨关节炎中软骨细胞外基质的降解。
Wnt信号通路与软骨细胞的分化发育密切相关,是较早发现的与颞下颌关节骨关节炎的发生有关的信号通路之一[17]。研究发现Wnt-5A/Ror2信号通路激活可以上调软骨细胞 MMP-1、MMP-3、MMP-9和 MMP-13的表达,从而参与骨关节炎的软骨破坏过程[18]。Wnt-5A可以促进骨髓间充质干细胞向成骨方向分化,通过下调Runx2、Cxcl12的表达和Rankl/Opg比例,进而抑制细胞的成骨分化[19]。本研究结果显示,不同浓度的绿原酸均能够降低Wnt-5A、Ror2 mRNA和蛋白的表达水平,提示绿原酸能抑制IL-1β诱导的颞下颌关节软骨细胞中Wnt-5A/Ror2信号通路的激活,进而抑制软骨细胞的损伤。
综上所述,绿原酸或通过抑制Wnt-5A/Ror2信号通路调控IL-1β诱导的颞下颌关节软骨细胞增殖、凋亡和炎症因子释放。绿原酸或可作为治疗颞下颌关节骨关节炎的药物。
