4株羊肚菌胞外多糖含量及其生物活性的研究
2020-04-28柏秋月邓百万杨学英解修超刘军生罗阳兰
柏秋月,邓百万,,杨学英,解修超,刘军生,罗阳兰
(1.陕西理工大学陕西省食药用菌工程技术研究中心,陕西 汉中 723001;2.陕西理工大学生物科学与工程学院,陕西 汉中 723001)
羊肚菌(Morchella esculenta),俗称羊肚菜、羊肚蘑,隶属于子囊菌门(Ascomycota)盘菌目(Pezizales)羊肚菌属(Morchella),是一种珍贵的食药用菌[1]。研究表明,羊肚菌营养丰富,含有多种维生素、蛋白质和多种氨基酸[2]。羊肚菌还含有多种活性成分,如多糖、脂肪酸化合物[3]、矿物质[4]等,活性十分广泛。其多糖成分具有抗氧化、抗肿瘤、抗疲劳、抑菌等功效[5]。因此,羊肚菌在保健及医学界中备受关注。且有文献报道,真菌多糖具有良好的抗氧化作用,能够有效缓解氧化压力[6]。
但目前大多数抗氧化剂为人工合成,对人类健康有一定的危害,因此,寻求无毒无害的天然抗氧化剂成为了国内外研究的热点[7]。现在对羊肚菌的研究主要集中在羊肚菌分类以及人工栽培等问题上,而有关陕南地区羊肚菌多糖成分生理活性的研究较少。
为此,本研究挑选了4 株于陕南地区生长较优的羊肚菌菌株为研究对象,通过液体培养并采用Sevag法[8]去除蛋白提取羊肚菌胞外多糖,检测不同羊肚菌菌株胞外多糖水平是否有差异,并对其体外抑菌、抗氧化活性以及其对α-淀粉酶的抑制作用进行对比,旨在为羊肚菌药食资源开发和利用提供一定的试验依据。
1 材料与方法
1.1 材料与试剂
供试的4 株羊肚菌(Morchella esculenta,编号为YS-Y、XH-0、XH-2、XH-4) 菌种、枯草芽孢杆菌(Bacillus subtilis,菌株保藏号 CMCC63501)、金黄色葡萄球菌(Staphyloccocus aureus,菌株保藏号 ATCC25925)、大肠埃希菌(Escherichia coli,菌株保藏号ATCC25922)、白色念珠菌(Candida albicans,菌株保藏号CM CC85021):陕西省食药用菌工程技术研究中心提供;维生素C(分析纯,批号:20160105):天津市天新精细化工开发中心;伏格列波糖片(批号172180801):石家庄市华新药业有限责任公司;DPPH、ABTS:Sigma 公司。
1.2 仪器与设备
EYELAN100O 型旋转蒸发仪:上海爱郎仪器有限公司;SW-CJ-1D 型单人超净工作台:上海苏净实业有限公司;YXQ-LS-50S 型高压灭菌锅:上海博讯实业有限公司医疗设备厂;KQ5200DE 超声波清洗器:昆山市超声仪器有限公司;UA2550 型紫外分光光度计:日本岛津公司;DYCZ-22A 型水平电泳仪:北京六一厂。
1.3 方法
1.3.1 羊肚菌菌种的培养
将供试的4 株羊肚菌在超净工作台中各取0.5 cm2接种于马铃薯琼脂(potato dextrose agar,PDA)固体培养基和察式培养基上,25 ℃,培养3 d~4 d。
1.3.2 羊肚菌菌种形态鉴定及内源转录间隔区(internal transcribed spacer,ITS)分子鉴定
将察氏培养基上的菌丝采用棉蓝染色法在光学显微镜下对菌丝体的形态和大小进行鉴定[9]。
将PDA 培养基上培养的羊肚菌菌丝体利用十六烷基三甲基溴化铵法(cetyltrimethylammonium ammonium bromide,CTAB)提取DNA,并采用真菌通用引物ITS-1 (5′TCCGTAGGTGAACCTGCGG-3′) 和 ITS-4(5′TCCTCCGCTTATTGATATGC-3′)进行扩增。聚合酶链式反应(polymerase chain reaction,PCR)反应体系(50 μL):2×Taq Master Mix 25 μL,10 μmoL/L 上、下游引物各 2 μL,模板 DNA 1 μL,ddH2O 补至 50 μL。PCR反应条件:94 ℃预变性 5 min;94 ℃变性 1 min,58 ℃退火 45 s,72 ℃延伸 1 min,36 个循环;72 ℃延伸 10 min。4 ℃保存,备用;PCR 产物送上海生工生物工程有限公司测序,将测得序列提交NCBI 数据库进行Blast 同源比对,使用MEGA7.0 软件分析,使用Neighbor-Joining法构建菌株系统进化树,确定菌株的分类地位。
1.3.3 羊肚菌多糖的提取
取供试的4 株羊肚菌在超净工作台中各取0.5 cm2接种于含PDA 液体培养基150 mL 的250 mL 三角瓶中,25 ℃,160 r/min 液体培养 6 d~7d 直至瓶中长满菌丝球,进行抽滤,收集其滤液,用旋转蒸发仪40 ℃浓缩至60 mL,并采用Sevag 法脱蛋白,取滤液与Sevag 试剂按 3∶1(体积比)置于 250 mL 三角瓶中,120 r/min 振荡30 min,转入分液漏斗中静置30 min,重复3 次,取上层清液。真空浓缩至50 mL 后转入三角瓶中,并加入3 倍体积的无水乙醇,4 ℃静置过夜。3 500 r/min 离心10 min,45 ℃干燥至恒重,即得到羊肚菌胞外多糖。
1.3.4 羊肚菌多糖含量的测定
称取0.100 0 g 预先干燥至恒质量的分析纯葡萄糖,去离子水定容至100 mL,得到1 mg/mL 的溶液,取0.1、0.2、0.4、0.6、0.8、1.0 mL,去离子水补至 10 mL,得到 10、20、40、60、80、100 μg/mL 的溶液,以去离子水为空白试剂;再取0.100 0 g 不同的羊肚菌胞外多糖,去离子水定容至10 mL,得到10 mg/mL 的溶液。
采用苯酚-浓硫酸法[10]测定总糖含量:分别取不同浓度的葡萄糖标品和不同羊肚菌胞外多糖溶液1 mL于试管中,加入5%的苯酚溶液1 mL,浓硫酸5 mL,混匀后沸水浴15 min,立即放入冷水中冷却5 min,定容至10 mL,于490 nm 处测定吸光度,得到葡萄糖中总糖的线形回归方程:y=0.041 3x+0.039 3,R2=0.997 4;采用 3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)法测定还原糖含量:分别取不同浓度的葡萄糖标品和不同羊肚菌胞外多糖溶液1 mL 于试管中,加入4 mL DNS,1 mL 去离子水。沸水浴5 min,立即置于冷水中,冷却至25 ℃,定容至10 mL,摇匀,于540 nm 测定其吸光度,得到葡萄糖中还原糖的线形回归方程:y=0.210 9x-0.019 8,R2=0.998 7。以上两者之差即为羊肚菌胞外多糖的含量,计算公式为:
羊肚菌胞外多糖含量=总糖含量-还原糖含量
1.4 羊肚菌抑菌活性研究
采用滤纸片扩散法[11]研究羊肚菌多糖成分对致病菌的抑菌效果,将活化的枯草芽孢杆菌(Bacillus subtilis)、金黄色葡萄球菌(Staphyloccocus aureus)、大肠埃希菌(Escherichia coli)、白色念珠菌(Candida albicans)稀释于无菌水中制备成菌悬液,均匀地涂布在牛肉膏蛋白胨培养基上,以浸泡过无菌水的滤纸片为阴性对照组,以浸泡青霉素溶液(10 mg/mL)的滤纸片为阳性对照组,以羊肚菌胞外多糖溶液(10 mg/mL)的滤纸(直径为5 mm)为样品组,轻放在培养基表面,置于37 ℃恒温箱中培养,24 h 后以十字交叉法测定抑菌直径D,抑菌效果(E)按下列公式计算:
E=(D样品组-D阴性对照组)/(D阳性对照组-D阴性对照组)
1.5 抗氧化活性的测定
1.5.1 还原能力的测定
参照文献[12],稍加改动,将不同的羊肚菌样品配制成 0.1、0.2、0.4、0.6、0.8、1.0 mg/mL 不同浓度的样品溶液,取1 mL 样品,加入1 mL pH6.6 的磷酸缓冲液、1 mL 1%的铁氰化钾溶液,混匀后置于50 ℃水浴,反应20 min,然后加入1 mL 10 %的三氯乙酸,混匀后静置10 min,取上清液2 mL,加入2 mL 去离子水和200 μL 0.1%三氯化铁溶液,静置 10 min 后测定OD700,以VC为阳性对照,每样重复3 次,取平均值。
1.5.2 DPPH 自由基清除能力的测定
参照文献[13],稍加改动,将不同的羊肚菌样品配制成 1、2、4、6、8、10 mg/mL 不同浓度的样品溶液,取2 mL 的样品溶液加入1 mL 0.2 mmol/LDPPH-乙醇溶液,混匀,放置 25 ℃暗处 10 min 后测定 OD517,以 VC为阳性对照,每样重复3 次,取平均值,并按以下公式计算DPPH 自由基清除率:
清除率/%=[1-(AS-ASB)/(AC-ACB)]×100
式中:AS为2 mL 样品液+1 mL DPPH-乙醇溶液的样品吸光值;ASB为2 mL 样品液+1 mL 99.9 %乙醇溶液的样品对照组吸光值;AC为2 mL 去离子水+1 mL DPPH-99.9%乙醇溶液的空白组吸光值;ACB为2 mL 去离子水+1 mL 99.9%乙醇溶液的空白对照组吸光值。
1.5.3 ABTS+自由基清除能力的测定
参照文献[14],稍加改动,将 7 mmol/L 的 ABTS 溶液和2.45 mmol/L 的过硫酸钾溶液等体积混合,避光条件下,25 ℃静置过夜,形成ABTS 储备液。使用前将ABTS 储备液用无水乙醇稀释(约稀释50 倍),即OD734为0.7±0.02。将不同的羊肚菌样品配制成0.1、0.2、0.4、0.6、0.8、1.0 mg/mL 不同浓度的样品溶液,取 1 mL 样品溶入2 mL ABTS 工作液,振荡混匀,置于暗处5 min 后测定OD734,每样重复3 次,取平均值,并按以下公式计算ABTS+自由基清除率:
清除率/%=[1-(AS-ASB)/(AC-ACB)]×100
式中:AS为 1 mL 样品液+2 mL ABTS 工作液的样品吸光值;ASB为1 mL 样品+2 mL 99.9%乙醇溶液的样品对照组吸收值;AC为1 mL 去离子水+2 mL ABTS工作液的空白组吸光值;ACB为1 mL 去离子水+2 mL 99.9%乙醇溶液的空白对照组吸光值。
1.5.4 羟自由基清除作用
参照文献[15],稍加改动,将不同的羊肚菌样品配制成 0.1、0.2、0.4、0.6、0.8、1.0 mg/mL 不同浓度的样品溶液,取1 mL 样品分别加入9 mmol/L FeSO4和9 mmol/L水杨酸-乙醇溶液各2 mL,最后加入1.2 mmol/L H2O2启动反应,于37 ℃反应30 min,以去离子水调零在波长510 nm 处测定样品吸光度A1;另以去离子水代替H2O2溶液重复以上操作,测定羊肚菌本身的吸光度值A2,同时以去离子水代替羊肚菌样品测定吸光度A0,以0.1 mg/L 为阳性对照,每样重复3 次,取平均值,并按以下公式计算羟自由基清除率:
清除率/%=[1-(A1-A2)/A0]×100
1.5.5 α 淀粉酶抑制作用的测定
参照文献[16],稍加改动,分别取不同羊肚菌样品0.5 mL,加入0.5 mL 1 unit/mL 的α 淀粉酶溶液与0.5 mL 0.25%的淀粉溶液,混匀于37 ℃恒温反应10 min,然后加入1 mLDNS 溶液,37 ℃恒温反应5 min 后,在沸水浴中加热15 min,冷却后用磷酸缓冲液定容至10 mL,测定OD575;以磷酸缓冲液代替α 淀粉酶作空白对照。以伏格列波糖片为阳性对照,每样重复3 次,取平均值,并按以下公式计算α 淀粉酶活性的抑制率:
清除率/%=[1-(AS-ASB)/(AC-ACB)]×100
式中:AS为 0.5 mL 样品液+0.5 mL α-淀粉酶溶液的样品组吸光值;ASB为0.5 mL 样品液+0.5 mL 磷酸缓冲液(替代α-淀粉酶溶液)的样品对照组吸光值;AC为0.5 mL 去离子水+0.5 mL α-淀粉酶溶液的空白组吸光值;ACB为0.5 mL 去离子水+0.5 mL 磷酸缓冲液(替代α-淀粉酶溶液)的空白对照组吸光值。
1.6 数据处理与分析
使用MEGA7.0 软件分析,使用Neighbor-Joining法构建菌株系统进化树。
采用Excel 2010 软件进行线性拟合,得到相关方程,计算相应的数据进行显著性分析。
2 结果与分析
2.1 菌株菌落形态及显微特征
羊肚菌菌落形态与显微特征图见图1。
羊肚菌菌落形态及显微特征:菌落边缘整齐,菌丝紧贴培养基表面生长,气生菌丝较少。在显微镜下观察,菌丝呈竹节状且具有分枝,有隔,分隔处缢缩,隔膜明显加厚[17]。
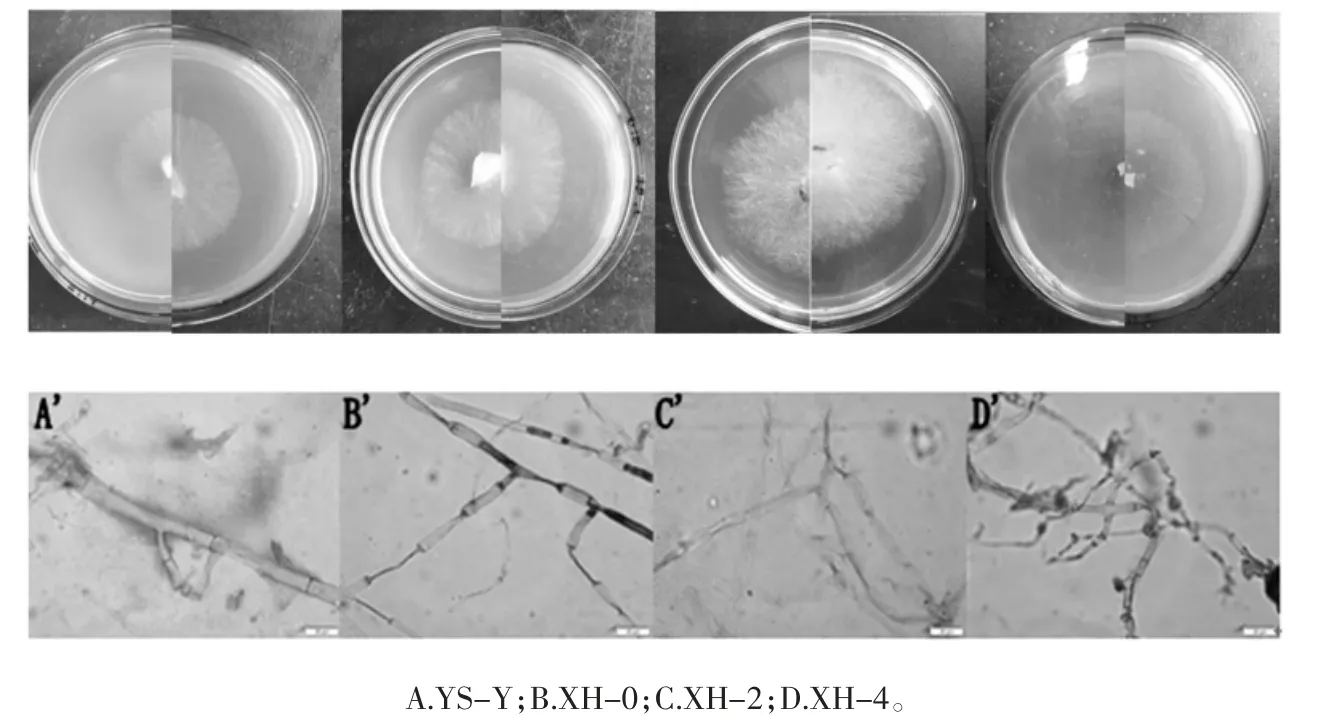
图1 羊肚菌菌落形态与显微特征图Fig.1 Morphology and microscopic characteristics of Morchella colonies
2.2 菌株序列分析
羊肚菌系统发育树见图2。
菌株 YS-Y 、XH-0、XH-2、XH-4 ITS 的扩增结果显示其序列大小在800 bp 左右。
将以上4 株菌种ITS 序列测序后,提交至Gen-Bank 数据库中,进行序列分析和相似性比较,并建立系统发育树。由图2 可知,菌株XH-0、XH-2、XH-4、YS-Y 与羊肚菌相似率达97%,说明4 株菌株属于羊肚菌。
2.3 4株羊肚菌胞外多糖含量
根据1.3.4 的方法及计算公式,得出菌株胞外多糖含量如表1。
菌株 YS-Y 、XH-0、XH-2、XH-4 胞外多糖的含量分别为10.05%、5.80%、19.89%、8.34%。将数据进行方差分析结果表明P<0.01,各菌株胞外多糖含量差异极显著。
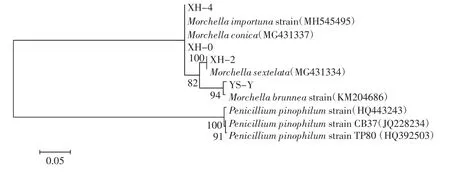
图2 羊肚菌系统发育树Fig.2 Morchella phylogenetic tree
2.4 羊肚菌胞外多糖抑菌活性分析
阴性对照组纸片周围无抑菌圈出现,表明水对细菌和真菌的生长无抑制作用。阳性对照组10 mg/mL 青霉素溶液周围出现抑菌圈,且>1 cm,表明试验方法无误且可行。4 种羊肚菌胞外多糖成分对枯草芽孢杆菌(Bacillus subtilis)、金黄色葡萄球菌(Staphyloccocus aureus)、大肠埃希菌(Escherichia coli)、白色念珠菌(Candida albicans)抑菌程度不同,抑菌效果见表2。

表2 羊肚菌胞外多糖成分抗菌分析Table 2 Antibacterial analysis of extracellular polysaccharide components from Morchella sp.
上述研究表明,4 株羊肚菌对金黄色葡萄球菌和大肠杆菌的抑制效果较好,对白色念球菌和枯草芽孢杆菌的抑制效果较差,菌株XH-2 对金黄色葡萄球菌和大肠杆菌的抑制效果最好,但对枯草芽孢杆菌无抑制作用,其余3 株对枯草芽孢杆菌的抑制效果较低。
2.5 4株羊肚菌抗氧化能力的评价
2.5.1 还原能力测定
羊肚菌胞外多糖的还原能力见图3。

图3 羊肚菌胞外多糖的还原能力Fig.3 Reduction ability of extracellular polysaccharides from Morchella esculenta
由图3 可知,4 株羊肚菌胞外多糖表现出不同程度的还原能力,且随质量浓度的升高而逐渐增加,4 株羊肚菌以及 VC的还原力大小 VC>XH-2>XH-0>XH-4>YS-Y。当质量浓度由0.1 mg/mL 升至0.6 mg/mL 时,菌株XH-0 的还原能力变化最快;当质量浓度由0.8 mg/mL 升至1.0mg/mL 时,菌株XH-2 的还原能力变化最快,当质量浓度达到1.0 mg/mL 时,菌株YS-Y、XH-0、XH-2、XH-4 以及 VC的 OD700吸光值分别为0.10±0.02、0.13±0.03、0.13±0.06、0.12±0.06 和 0.16±0.08。结果表明,菌株XH-2 胞外多糖的还原能力优于其他3 株,其次是菌株XH-0,但4 株羊肚菌的还原能力都不及VC。
2.5.2 DPPH 自由基清除能力的测定
羊肚菌胞外多糖的DPPH 自由基清除率见图4。
由图4 可知,4 株羊肚菌胞外多糖都具有一定的DPPH 自由基清除能力,随着质量浓度的增加,其DPPH 自由基的清除能力也在不断地增加,且呈现出明显的剂量效应关系,4 株羊肚菌以及VC的DPPH 自由基的清除能力大小为 VC>XH-4>XH-2>YH-Y>XH-0,当质量浓度达到1.0 mg/mL 时,其清除率分别为72.30%、39.37%、39.24%、38.58%、34.32%;通过其关系进行线性回归方程的拟合进而计算出YS-Y、XH-0、XH-2、XH-4 以及 VC的 EC50分别为 23.32、25.23、17.86、16.68、1.74 mg/mL。结果表明,菌株 XH-4 胞外多糖的DPPH 自由基清除率高于其它3 株,其EC50为16.68 mg/mL,这比鲍敏等[18]研究的羊肚菌胞外多糖对DPPH 自由基的清除率低,可能是由于提取工艺未优化,多糖活性受损导致的。
2.5.3 ABTS+自由基清除能力测定
羊肚菌胞外多糖的ABTS+自由基清除率见图5。
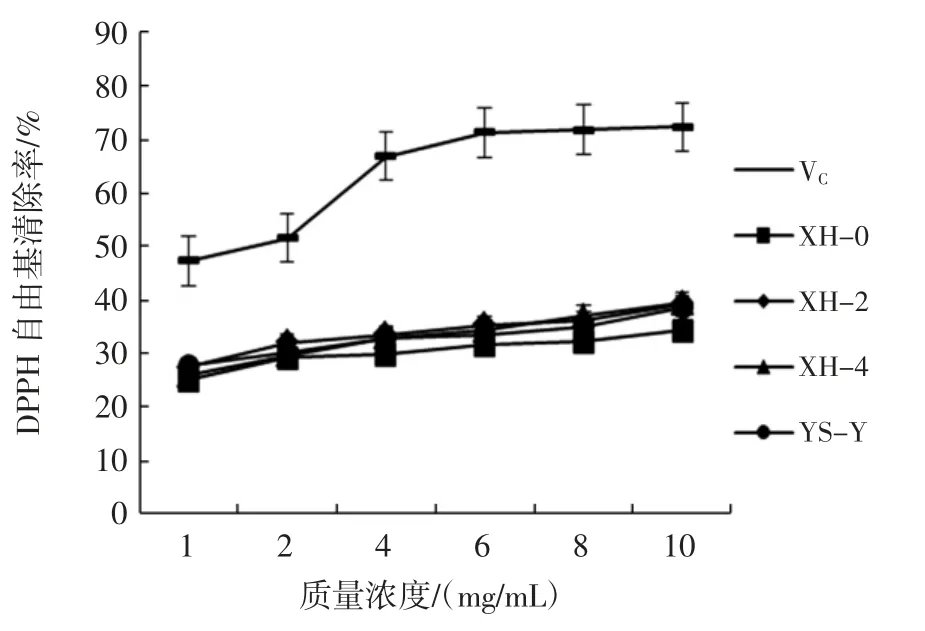
图4 羊肚菌胞外多糖的DPPH 自由基清除率Fig.4 DPPH free radical scavenging rate of extracellular polysaccharides from Morchella esculenta
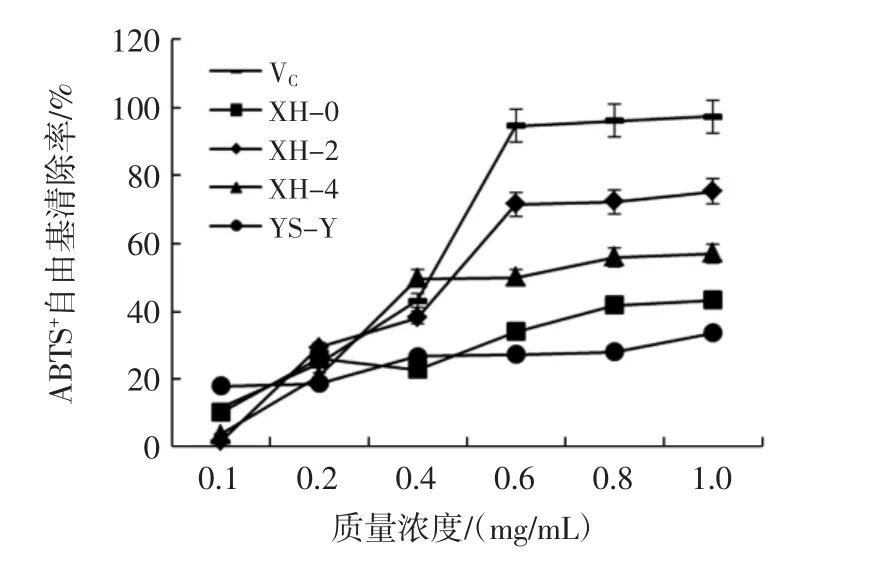
图5 羊肚菌胞外多糖的ABTS+自由基清除率Fig.5 ABTS+free radical scavenging rate of extracellular polysaccharides from Morchella esculenta
由图5 可知,4 株羊肚菌胞外多糖有着较强的ABTS+自由基清除能力,一般认为某种质的EC50低于10 mg/mL,表明其具有较好的抗氧化性[19]。其多糖成分对ABTS+自由基清除率随着其质量浓度的增加,清除能力也不断增加。4 株羊肚菌以及VC的ABTS+自由基清除能力大小为 VC>XH-2>XH-4>XH-0>YS-Y,当浓度达到1.0 mg/mL 时,其ABTS+自由基清除率分别为97.47%、75.25%、56.82%、43.18%、33.33%;4 种羊肚菌胞外多糖成分以VC的ABTS+自由基清除率通过线性拟合计算得出其 EC50分别为 0.49、0.56、0.87、0.97、1.91 mg/mL。结果表明,4 株羊肚菌都具有较强的ABTS+自由基清除率,菌株XH-2 的ABTS+自由基清除率高于其它3 株。
2.5.4 羟自由基清除能力的测定
羟基是一种对机体危害最大的活性氧自由基,它可以损害机体内所有的生物大分子,羟自由基不能被特异的酶促反应降解,因此,维持细胞和机体正常的功能必须清除羟自由基[20]。羊肚菌胞外多糖的羟自由基清除率见图6。
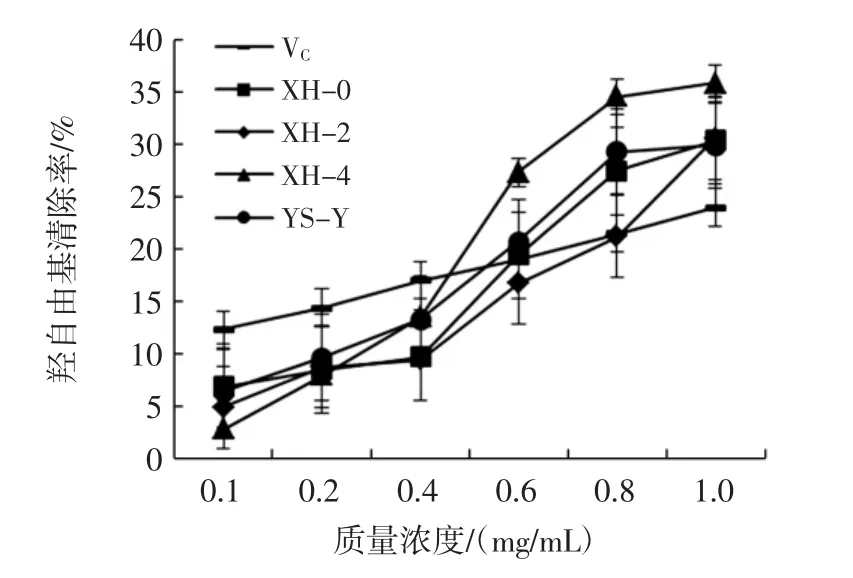
图6 羊肚菌胞外多糖的羟自由基清除率Fig.6 Scavenging rate of hydroxyl radicals of extracellular polysaccharides from Morchella esculenta
由图6 可知,4 株羊肚菌胞外多糖有一定程度的羟自由基清除能力,随着质量浓度的增加其清除能力也不断增强。4 株羊肚菌以及VC的羟自由基清除能力大小为 XH-4>XH-0>YS-Y>XH-2 >VC。当浓度达到1.0 mg/mL 时,其羟自由基清除率分别为35.78 %、30.50%、30.34%、29.83%、23.94%,对羟自由基的清除率进行线性拟合并计算出其EC50分别为1.40、1.75、1.76、2.09、3.09 mg/mL。结果表明,4 株羊肚菌的羟自由基清除率高于VC,且菌株XH-4 的羟自由基清除率达到了75.25%,这与任嘉兴等[21]研究结果相近,说明菌株XH-4 具有较强的羟自由基清除能力。
2.5.5 对α 淀粉酶抑制效果的测定
羊肚菌胞外多糖对α 淀粉酶的抑制率见图7。
由图7 可知,羊肚菌胞外多糖成分对α-淀粉酶有较强的抑制作用,并且随着其浓度的增加,对α-淀粉酶的抑制作用也不断增强。4 种羊肚菌胞外多糖以及伏格列波糖片对α-淀粉酶的抑制率从大到小排序为伏格列波糖片>XH-2>YS-Y>XH-4>XH-0,当浓度达到1.0 mg/mL 时,其抑制率分别为47.38%、35.04%、32.91%、32.20%、25.97%,对4 种羊肚菌胞外多糖以及伏格列波糖片对α-淀粉酶的抑制率进行线性回归方程拟合,计算其各自的EC50分别为1.15、1.55、2.04、2.27、2.38 mg/mL,说明4 株羊肚菌对α-淀粉酶的抑制作用较强,菌株XH-2 对α-淀粉酶的抑制率优于其他3 株,但都低于伏格列波糖片。

图7 羊肚菌胞外多糖对α 淀粉酶的抑制率Fig.7 Inhibitory rate of extracellular polysaccharide from Morchella esculenta on alpha amylase
3 结论
4 株羊肚菌菌株对金黄色葡萄球菌和大肠杆菌都有较好的抑制效果,菌株XH-2 对这两种致病菌的抑制效果最好,这可能与羊肚菌的抗菌和抗病毒的活性成分有关。
采用Sevag 法提取的羊肚菌胞外多糖具有一定程度的抗氧化能力和对α-淀粉酶的抑制能力。4 株羊肚菌对羟自由基清除能力都高于VC,且当质量浓度达到1.0 mg/mL,菌株XH-4 羟自由基清除率达到了75.25%;菌株XH-2 的还原力为0.13±0.06,优于其他3 株,且与VC差异不显著。且其菌株对ABTS+自由基的清除能力和对α-淀粉酶的抑制能力均优于其他3 株,其EC50分别为 0.56 mg/mL 和 1.55 mg/mL,其 EC50均低于10 mg/mL,表明其具有较好的还原力和清除能力。菌株XH-4 对DPPH 自由基清除能力高于其它3 株,其EC50为16.68 mg/mL。由此可知,菌株XH-2 和菌株XH-4 的抗氧化性以及对α-淀粉酶的抑制能力效果较好,可为开发羊肚菌的天然高效氧化剂提供一定的依据。
结果表明羊肚菌胞外多糖有一定的抗氧化作用以及抑菌效果,但本研究只对体外进行了抗氧化和抑菌能力测定,未在体内进行测定,因此需要进行后续试验对羊肚菌胞外多糖在体内的生物活性进行验证,并且未测定4 株羊肚菌菌株对致病菌的最小抑菌浓度和最小杀菌浓度,需要后续试验进一步测定,以期为羊肚菌药用资源开发提供一定的依据。
