蛹虫草对小鼠体液免疫功能和NK 细胞活性的影响
2020-04-28赵宏宇崔林虎张伟云
赵宏宇,崔林虎,张伟云
(1.吉林省中医药科学院,吉林长春130021;2.延边林业科学研究院,吉林延吉133001;3.长春工业大学,吉林长春130012)
《新华本草纲要》记载,蛹虫草“全草味甘,性平。有益肺肾,补精髓,止血化痰的功能”[1]。蛹虫草,又称北虫草、北冬虫夏草。国内于1958 年在吉林省首次发现,经鉴定它与冬虫夏草[Cordy ceps sinensis(Berk.)Sacc.]为同一属[2],蛹虫草不但同冬虫夏草同属,而且功效近似,故常有医家将其作为冬虫夏草的替代品入药应用,现代研究表明,蛹虫草不仅在成分上同冬虫夏草相近,在药理和临床试验方面也多有相同之处,证明蛹虫草可以作为冬虫夏草的替代品[3]。虽然蛹虫草的自然资源非常有限,但人工培育已获成功[4-6],并已实现规模化生产。随着蛹虫草的大量应用,国内外学者也对其进行了大量药理学研究,包括抗肿瘤[7]、抗疲劳[8]、抗疟[9]、抗氧化[10]、耐缺氧[11]以及免疫调节[12-14]作用。研究表明蛹虫草对机体的免疫系统具有广泛的影响,该试验观察了蛹虫草对小鼠体液免疫功能及NK 细胞活性的调节作用,为蛹虫草的临床应用提供了试验依据。
1 材料与方法
1.1 试验材料
供试品:蛹虫草粉,本品由铁岭市云欣虫草生物有限公司提供。人体推荐剂量1.0 g/60 kg。
试验动物: 雄性KM 小鼠,体重18~20 g,SPF级。试验动物提供单位:辽宁长生生物技术有限公司;动物室环境条件:温度:19~23℃,相对湿度40%~65%。
主要仪器:手术器械、T1000 型电子天平、数显恒温水浴锅、一次性培养皿、JA2003 型电子天平、96孔微量血凝实验板、SG-603 生物安全柜、离心机、200目筛网、多功能酶标仪、细胞离心管、高压灭菌锅、二氧化碳培养箱、JJ-100 电子天平、血细胞计数板。
试剂:SA 缓冲液、2%绵羊红细胞SRBC、台酚蓝、小牛血清、RPMI1640、YAC-1 细胞、LDH 基质液。
1.2 试验方法[15-16]
1.2.1 供试品给予方式及剂量分组。受试样品设83.3、166.7、333.3 mg/kg·BW 3 个剂量组,即为受试样品人体推荐用量的5、10、20 倍,另设0 g/kg·BW/d 组以蒸馏水灌胃。配制方法为:称取受试物4.17、8.33、16.67 g,分别用蒸馏水定容至1 000 mL,混匀,低温保存,蒸馏水为对照组。每天按20 mL/kg·BW 灌胃给药。
小鼠按体重随机分为2 个大组,每大组合计小鼠40 只,每大组下设对照组、供试品低、中、高剂量组,每剂量组10 只小鼠。其中一组小鼠进行淋巴器官/体重比值测定及NK 细胞活性试验;二组小鼠进行抗体生成细胞检测和半数溶血值HC50的测定。
1.2.2 抗体生成细胞检测。在清洁玻片上刷上一薄层琼脂糖,干后可长期保存备用。小鼠灌胃1 个月后,将压积SRBC 用生理盐水配成2%(v/v)的细胞悬液,每只小鼠腹腔注射0.2 mL。将SRBC 免疫4 d 后的小鼠颈椎脱臼处死,取出脾脏,放在盛有适量无菌Hank’s 液的小平皿中,轻轻磨碎脾脏,制成细胞悬液,经200 目筛网过滤,离心(1 000 r/min)10 min,用Hank’s 液洗2 遍,最后将细胞悬液在5 mL RPMI1640 培养液中,计数细胞,并将细胞浓度调整为5×106个/mL。表层培养基加热溶解后,放45℃水浴保温,与等量pH 7.2~7.4 2 倍浓度的Hank’s 液混合,分装小试管,每管0.5 mL,再向管内加10%SRBC(v/v,用SA 缓冲液配制)50 μL,25 μL 脾细胞悬液,迅速混匀,倾倒于已刷琼脂糖薄层的玻片上,做平行片,待琼脂凝固后,将玻片水平扣放在片架上,放入37℃、5% CO2培养箱中孵育1.5 h,然后将制备好的补体(采集豚鼠血,分离出血清(10 只豚鼠的混合血清),将1 mL SRBC 加入到5 mL 豚鼠血清中,混匀后放置4℃保存30 min,放置期间再混匀几次,到时经2 000 r/min 离心10 min,取上清液分装,-70℃保存)1:8 稀释后加入到玻片架凹槽内,继续孵育1.5 h 后,计数溶血空斑数。
1.2.3 血清溶血素测定。小鼠灌胃1 个月后,将2%(v/v)压积SRBC 的细胞悬液,每只小鼠腹腔注射0.2 mL 进行免疫。免疫4 d 后小鼠摘除眼球取血于离心管内,放置1 h,将凝固血与管壁剥离,使血清充分析出。2 000 r/min 离心10 min,分离并收集血清。血清200 倍稀释后,按检验方法测定样品管及SRBC半数溶血时的光密度值。溶血素的量以半数溶血值(HC50)表示。
HC50=样品光密度值/SRBC 半数溶血时光密度值×稀释倍数
1.2.4 NK 细胞活性测定。试验前24 h 将靶细胞(YAC-1 细胞)传代培养,应用前以Hank’s 液洗3次,用RPMI1640 完全培养液调整细胞浓度为4×105个/mL。小鼠灌胃1 个月后,颈椎脱臼处死小鼠,无菌取脾,置于盛有适量无菌Hank’s 液的小平皿中,用镊子轻轻将脾磨碎,制成单细胞悬液,200 目筛网过滤,用Hank’s 液洗2 次,每次离心10 min(1 000 r/min),弃上清将细胞浆弹起,加入0.5 mL 灭菌水20 s,裂解红细胞再加入0.5 mL 2 倍Hank’s 液及8 mL Hank’s 液,1 000 r/min 离心10 min,用含10%小牛血清RPMI1640 完全培养液重悬,1%冰乙酸稀释后计数,台酚兰染色计数活细胞数(均在95%以上),用RPMI1640 完全培养液调整细胞浓度为2×107个/mL。取靶细胞和效应细胞各100 μL(靶效比50∶1),靶细胞自然释放孔加靶细胞和培养液各100 μL,靶细胞最大释放孔加靶细胞和2.5%Triton 各100 μL,上述各项均设3 个平行孔,于37℃、5%CO2培养箱中培养4 h,然后将96 孔培养板以1 500 r/min 离心5 min,每孔吸取上清液100 μL 置平底96 孔培养板中,同时加入LDH 基质液100 μL,37℃反应10 min,每孔加入1 mol/L 的HCl 30 μL,在酶标仪490 nm 处测定光密度值。
NK 细胞活性(%)=(反应孔OD 值-自然释放孔OD 值)/(最大释放孔OD 值-自然释放孔OD 值)×100 1.2.5 数据处理。用SPSS 软件对数据进行方差齐性检验,满足方差齐要求的数据资料,用单因素方差分析方法中多个试验组与一个对照组间均数的两两比较方法进行统计处理;对非正态分布或方差不齐的数据资料用秩和检验进行统计处理。
2 结果与分析
2.1 蛹虫草对小鼠体重的影响
各组小鼠灌胃不同剂量的蛹虫草1 个月后,由表1、2 可见,83.3、166.7、333.3 mg/kg·BW 组与0 g/kg·BW/d 组比较,差异无统计学意义(P>0.05)。
2.2 蛹虫草对小鼠淋巴器官/体重比值的影响
各组小鼠灌胃不同剂量的蛹虫草1 个月后,取小鼠的胸腺和脾称重,计算脏体比。由表3 可见,83.3、166.7、333.3 mg/kg·BW 组胸腺体比和脾体比与0 g/kg·BW/d 组比较,差异无统计学意义(P>0.05)。

表2 实验二组试验前后小鼠体重变化(x±S)
2.3 蛹虫草对小鼠溶血空斑数的影响
各组小鼠灌胃不同剂量的蛹虫草1 个月后,用Jerne 改良玻片法进行小鼠抗体生成细胞实验,计算溶血空斑数。由表4 可见,166.7、333.3 mg/kg·BW 组小鼠溶血空斑数高于0 g/kg·BW/d 组,差异有统计学意义(P<0.05)。
2.4 蛹虫草对小鼠血清半数溶血值(HC50)的影响
各组小鼠灌胃不同剂量的蛹虫草1 个月后,用半数溶血值法测定小鼠的血清半数溶血值(HC50)。由表5 可见,166.7、333.3 mg/kg·BW 组小鼠血清半数溶血值(HC50)与0 g/kg·BW/d 组比较,差异有统计学意义(P<0.05)。
2.5 蛹虫草对小鼠NK 细胞活性的影响
各组小鼠灌胃不同剂量的蛹虫草1 个月后,用乳酸脱氢酶测定法进行小鼠NK 细胞活性测定。由表6 可见,83.3、166.7、333.3 mg/kg·BW 组小鼠NK细胞活性与0 g/kg·BW/d 组比较,差异均有统计学意义(P<0.05)。

表3 蛹虫草对小鼠淋巴器官/体重比值的影响(x±S)

表4 蛹虫草对小鼠溶血空斑数的影响(x±S)

表5 蛹虫草对小鼠血清半数溶血值(HC50)的影响(x±S)
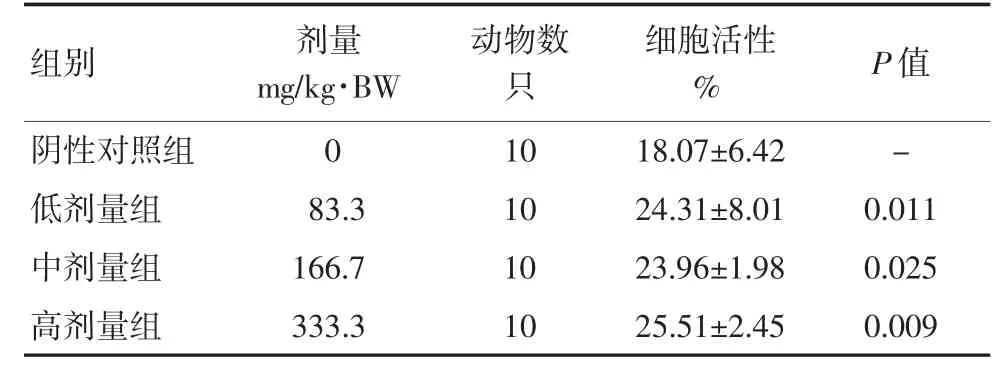
表6 蛹虫草对小鼠NK 细胞活性的影响(x±S)
3 讨论
体液免疫是机体免疫功能的重要组成部分,B细胞通过识别、活化、增殖抗原并分泌抗体来实现体液免疫。在血清中分泌出的抗体(溶血素)含量直接反映机体体液免疫能力。在使用SRBC 对机体进行免疫后,B 细胞分化浆细胞分泌抗体,因此血清中出现溶血素,因为补体的参与作用,溶血素与SRBC 同时孵育,会出现溶血反应,通过对释放出的血红蛋白进行含量测定,可以推断出机体血清中抗体(溶血素)的含量。该试验发现,蛹虫草中、高剂量组(166.7、333.3 mg/kg·BW)能显著提高小鼠血清半数溶血值。抗体生成细胞数同样是反映机体体液免疫能力的重要指标,在使用SRBC 对机体进行免疫后,取小鼠脾细胞悬液,将该细胞悬液混合SRBC,因为补体的参与作用,产生抗体的脾细胞周围的SRBC 可以溶解并形成空斑。溶血空斑的数目同抗体生成细胞数有直接关联。该试验发现蛹虫草中、高剂量组(166.7、333.3 mg/kg·BW)能显著增强抗体生成细胞能力。由此可见,蛹虫草可明显增加B 淋巴细胞产生抗体的能力,增加机体的体液免疫功能。
自然杀伤细胞(NK)可以直接杀伤靶细胞,它不依赖抗体和补体而直接实现免疫功能,是机体免疫不可或缺的组成之一。活化的NK 细胞可分泌和合成多种细胞因子,有免疫调节作用,并可以达到直接杀伤靶细胞的目的。所以NK 细胞的活性是衡量机体免疫的重要指标。该试验发现,蛹虫草各剂量组均能显著增强小鼠NK 细胞活性。
综上所述,蛹虫草具有免疫增强作用,可能是通过增强体液免疫功能及增强NK 细胞活性实现的。其具体机理尚需进一步研究,该试验为蛹虫草的免疫机制研究提供一定的基础支持。
